通心络对高脂饮食诱导内质网应激致小鼠血管内皮细胞凋亡的保护作用*
郝媛媛,刘 妍,李翠茹,高怀林
(1. 河北中医学院中西医结合学院 石家庄 050200;2. 河北中医学院基础医学院 石家庄 050200;3. 河北以岭医院 石家庄 050091;4. 络病研究与创新中药国家重点实验室 石家庄 050035)
现代社会物资丰富,饮食结构发生了巨大变化,由于能量摄入过剩造成的脂代谢异常人口增多。内皮功能障碍与内质网应激及其介导的细胞凋亡相关,高血糖、氧化应激、缺氧、钙超载等均会引起内质网应激[1]。此外,研究表明,心血管疾病、肥胖、炎症等均与内质网应激关系密切[2,3]。内质网作为蛋白质翻译、折叠、运输的细胞器,在维持细胞稳态方面具有重要作用。未折叠蛋白反应(unfolded protein response,UPR)是一种细胞自我保护机制[4],以适应内质网应激的发生。早期通过减少蛋白质的合成,增加蛋白质的折叠和转运速度来恢复内质网的稳态,但如果损伤过于严重,适应机制不足以处理未折叠蛋白负荷,ERs会引起细胞凋亡[5]。过度或长时间的ERS 能通过激活CHOP、JNK、Caspase12以及bcl-2家族引起的细胞凋亡[6,7]。
在脉络学说营卫理论为指导下,探讨“营卫不通,血凝不流”的基本病机,依据中医学的“脉”与西医学的“血管”在解剖形态上具有同一性,将在动、静脉中发生的多种血管疾病统称为“脉络-血管系统病”[8]。内皮细胞作为微血管的基本构成单位,在心血管事件链中发挥重要作用。本研究采高脂饮食喂养的C57BL/6J 小鼠,通心络遵循了“络以通为用”的治疗原则进行干预,观察其对内质网应激介导的细胞凋亡的影响,以评价通心络对肥胖模型下小鼠的防治效果及血管内皮功能的保护作用。
1 材料
1.1 动物
5-6 周龄SPF 级雄性C57BL/6J 小鼠45 只,体质量18-22 g,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2016-0006),实验动物饲养于河北省中西医结合医药研究院新药评价中心。温度22-24℃,湿度50-60%,每笼5只,12 h明暗交替,自由进食饮水。
1.2 主要试剂
总胆固醇(CHO)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)试剂盒(北京九强生物技术有限公司);去甲肾上腺素(NE,天津金耀氨基酸有限公司);乙酰胆碱(Ach,美国Sigma 公司);羧甲基纤维素钠(CMC-Na,阿拉丁);BCA 蛋白浓度测定试剂盒(美国Thermo scientific 公司);PSS 碳酸盐缓冲液,KPSS 碳酸盐缓冲液;Eastep®Super总RNA提取试剂盒(美国Promega公司);反转录试剂盒、荧光定量PCR 试剂盒(日本Takara 公司);GRP78 抗体、Caspase-9 抗体(Abcam 公司);Caspase-3抗体、Caspase-7抗体(CST 公司);引物(生工生物工程(上海)股份有限公司)。
1.3 实验仪器
DMT 620四通道微血管张力测定仪(DMT,丹麦),PowerLab 生物信号采集分析系统(AD instruments Co,Australia),显微镜,显微手术解剖工具(Geuder,德国),电子天平(JA12002,上海越平科学仪器有限公司),微量移液器(Corning,美国),恒温水浴锅(DK-98-Ⅱ,天津市泰斯特仪器有限公司),纯水仪(A10,Thermo),无菌工作台(AIR TECH,苏净集团安泰公司),7080 全自动生化分析仪(日立公司,日本),Primo vert 倒置显微镜(蔡司,德国),SYNERGY4多功能酶标仪(BioTek 公司,美国),Odyssey双色红外线扫膜仪(Li-Cor 公司,美国),ABI 7900 Real-Time PCR System(美国ABI公司)。
2 方法
2.1 药物制备
通心络超微粉(批号:S-130901)由石家庄以岭药业有限公司提供。将通心络粉末溶解于0.5%羟甲基纤维素钠(CMC-Na)溶液中,制备成浓度为1.5 g·(kg·天)-1的灌胃混悬液。
2.2 实验动物模分组与给药
45 只SPF 级雄性C57BL/6J 小鼠,适应性喂养1 周后,随机分为3 组(n = 15),低脂对照组(低脂饮食,LFD+CMC),模型组(高脂饮食,HFD+CMC),通心络组(高脂饮食+ 通心络干预,1.5 g·(kg·天)-1,HFD +TXL),根据本实验室前期研究选取通心络的最优给药浓度为1.5 g·(kg·天)-1。在18 周给药期间,每周称量小鼠体质量。
2.3 血液生化指标
小鼠喂养18 周后,禁食12 h,摘眼球取血,冰上静置30 min,4℃,3000 r·min-1,离心10 min,取上清,检测TC,TG,HDL-C,LDL-C水平。
2.4 肠系膜动脉血管环的制备
参考之前的报道[9],用CO2吸入法处死小鼠,迅速取出肠血管组织,置于持续通氧的预冷PSS 缓冲液中,在解剖显微镜视野下,剥离血管周围的脂肪组织及结缔组织,选取Ⅲ级肠系膜动脉分支,剪取2 mm 左右血管,置于37 ℃含5 mL PSS 缓冲液的Chamber 中,用两根钨丝穿过血管,一根固定在张力转换器,另一根固定在可调节负荷的装置上,缓慢调至平衡状态,使血管不受力,将固定有血管的Chamber 移至Interface 上,同时连接传感器,并向浴槽内持续通入含有95% O2和5% CO2混合气体。稳定15 min 后,进行调零设置。肠系膜动脉初始张力给与1.5 mN,平衡1 h后,再次进行调零设置。给与60 mmol·L-1的K-PSS 溶液刺激血管,待收缩力达到平台期时,更换PSS缓冲液洗脱4 次,每次5 min,直至基线附近,如此循环3 次。加入5 μL 的10-3mol·L-1NE 收缩血管,当收缩值达到平台期后加入乙酰胆碱(累加剂量10-8-10-5mol·L-1)舒张血管。舒张功能以血管舒张率表示,(Ach舒张幅度占PE 预收缩幅度的百分比)[10]。实验结束后,收集肠系膜动脉,存放于-80℃冰箱冻存。
2.5 RT-PCR 检测内质网应激及凋亡相关基因mRNA表达
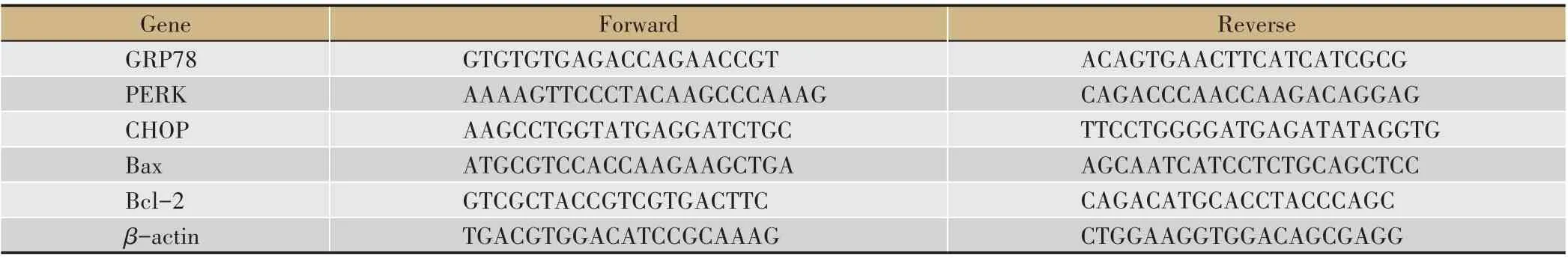
表1 引物设计
根据制造商的说明,提取肠系膜动脉中总RNA,使用微量核酸蛋白检测仪(Gene 2000)测定RNA 的纯度及浓度,选取A260/A280 值在1.9-2.1 范围的样品,按照Prime Script TM 合成试剂盒说明书进行逆转录,获得cDNA,按照SYBR Green PCR Master Mix 试剂盒说明书,在ABI 7900 H 序列检测PCR 系统进行实时荧光定量PCR反应。引物设计如表1。
2.6 细胞培养与分组
将HUVEC 细胞株培养于含10%胎牛血清、1‰三抗的高糖DMEM 培养基中,37℃、5%CO2培养箱中孵育,当细胞处于对数生长期则开始实验,实验分为3个组:正常对照组(control group);模型组(Hcy group);通心络组(TXL group)。
2.7 MTS法确定Hcy给药浓度
按照1 × 105的密度,将HUVEC 细胞接种于96 孔板中,待细胞贴壁生长至70%后,分别加入含不同浓度的Hcy 培养液(0.25、1、2、4、6、8、10 mM),继续培养24 h。吸取上清,每孔加入100 μL 的MTS(5 mg·mL-1),37℃孵育1 h 后,选择490 nm、630 nm 波长,在酶标仪上测定各孔光吸收值,记录结果,结合细胞形态观察并确定最适造模浓度。
2.8 药物细胞毒性检测
当细胞密度达到70%时,将HUVEC 细胞以每孔1×105的密度接种于96 孔板中,置于培养箱培养24 h后。分别用无血清(control group)、40、60、80、100 、150、200、400、600、800 μg·mL-1的TXL 处理细胞。处理24 h 后每孔加入100 μL MTS(5 mg·mL-1),37℃孵育1 h,选择490 nm、630 nm波长,在酶标仪上测定各孔光吸收值,记录结果,分析TXL对HUVEC细胞的毒性。
2.9 通心络药效实验
分别用无血清(control group),2 mM Hcy(Hcy group)、2 mM Hcy + 100 μg·mL-1TXL,2 mM Hcy + 200 μg·mL-1TXL,2 mM Hcy + 400 μg·mL-1TXL,2 mM Hcy +600 μg·mL-1TXL,2 mM Hcy + 800 μg·mL-1TXL 处理细胞,确定最适给药浓度。

图1 各组小鼠体质量变化趋势图
2.10 Western blot
检测内质网应激相关蛋白表达收集细胞裂解液的蛋白样品,采用BCA 法进行蛋白定量,将提取的蛋白进行SDS-PAGE,然后转移到NC膜上,37℃封闭1 h,一抗4℃孵育过夜,TBST 洗膜3 次,10 min/次,然后荧光二抗37℃摇床孵育1 h,TBST 洗膜3 次,10 min/次,通过Odyssey 成像系统检测带信号,并通过图像分析软件(LI-CO,USA)进行量化。
3 统计学分析
采用SPSS19.0 统计软件对数据统计分析,数据以(x ±s)表示,采用单因素方差分析(One-Way ANOVA)进行检验,方差齐性两两检验采用LSD,方差不齐用Dunnett’s T3法,P <0.05为差异有统计学意义。
4 结果
4.1 TXL对高脂饮食小鼠体质量和血脂的影响
与LFD 组小鼠相比,高脂饲料喂养(HFD)组小鼠体质量从第四周开始明显增加,直至实验结束,TXL组小鼠体质量较HFD组有所减轻(图1)。与LFD组比较,HFD 组小鼠TC、TG、LDL-C 明显升高,而TXL 组小鼠TC、TG、LDL-C的水平显著降低(P<0.05)(图2)。

图2 各组小鼠血脂水平比较
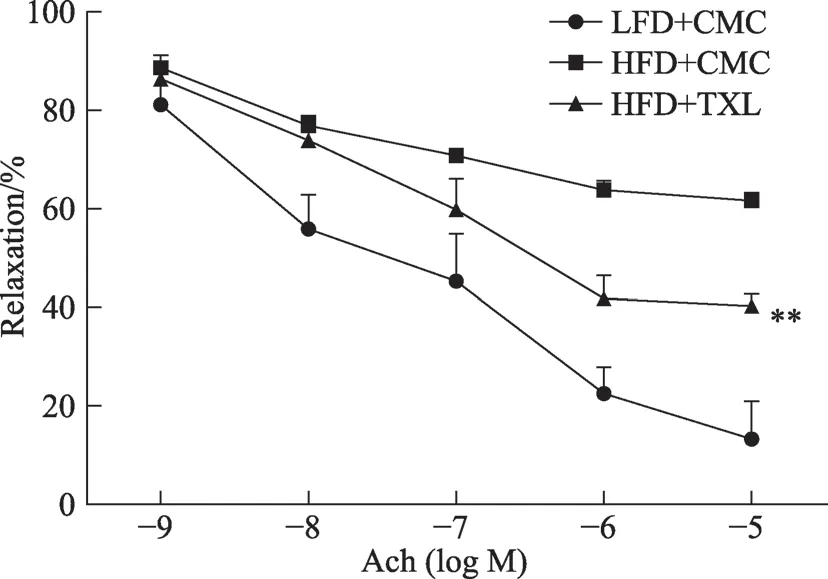
图3 通心络对Ach诱导的小鼠肠系膜动脉舒张功能的影响
4.2 TXL在Ach介导小鼠肠系膜动脉舒张中的作用
在终浓度为10-5mol·L-1的NE 诱发最大收缩后,分别累计浓度梯度Ach(10-9、10-8、10-7、10-6、10-5)mol·L-1介导的舒张作用下,LFD 组肠系膜动脉血管舒张率为(86.6 ± 15.1)%,HFD 组肠系膜动脉血管舒张率为(38.36±3.0)%,TXL 组血管舒张率为(61.21±4.7)%,差异有统计学意义(P <0.01),表明TXL 可改善高脂饮食小鼠的内皮依赖性血管舒张反应(图3)。
4.3 TXL对GRP78、凋亡通路蛋白及mRNA的表达
GRP78,又称免疫球蛋白重链结合蛋白,是内质网应激的标志性蛋白。与HFD 组相比,经TXL 干预后,GRP78、PERK、CHOP、Bax mRNA 表达下调(P<0.05),Bcl-2mRNA表达显著上调(P<0.01)。
4.4 TXL对细胞活力的影响

图4 通心络对GRP78、PERK、CHOP、Bax、Bcl-2 mRNA表达的影响

图5a 不同浓度Hcy对HUVEC细胞生存活性的影响

图5b 不同浓度TXL对HUVEC细胞生存活性的影响
使用MTS 实验研究了不同浓度的Hcy 对HUVEC细胞存活状态的影响,结果显示,造模浓度为2 mM时,对细胞有明显的损伤作用,随后,观察TXL 对HUVEC 细胞的毒性,在处理24 h 中,没有发现明显的细胞毒性作用,且当通心络浓度为200 μg·mL-1,TXL对Hcy 孵育的HUVEC 细胞具有明显的保护作用(图5a-c)。
4.5 通心络通过抗凋亡途径保护血管内皮
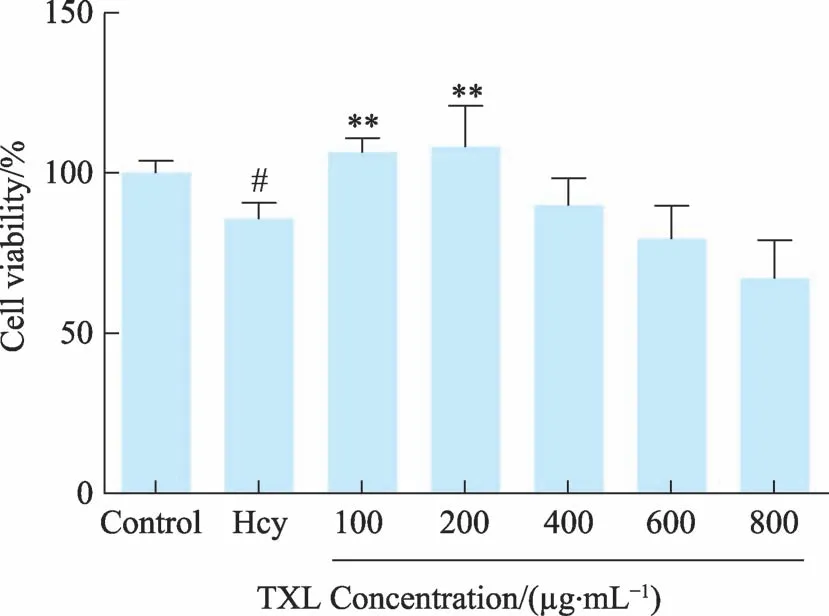
图5c TXL对Hcy诱导的细胞损伤的影响
与control group 比较,Hcy group 凋亡相关蛋白Caspase-3,Cleaved Caspase-3,Caspase-7,Caspase-9,表达升高(P <0.05);与Hcy group 比较,TXL group Caspase-3, Cleaved Caspase-3,Caspase-7,Caspase-9蛋白表达明显降低(P <0.05),表明通心络能减少内皮细胞凋亡。
5 讨论
内皮功能障碍是心血管事件的早期风险标志之一[11],其特征是eNOS 活性和/或表达降低,以及一氧化氮(NO)生物利用度降低[12]。而肥胖造成的脂质沉积则是引起内皮功能障碍的重要原因之一。肥胖患者的血管稳态受损是由多种因素引起的,包括缺氧、免疫失衡、氧化应激和脂肪因子分泌模式的改变,这些干扰因素独立或协同地降低血管NO 的生物利用度,这被认为是内皮功能障碍进展中的1 个关键步骤[13]。内质网应激加剧代谢功能障碍,从而导致血脂异常、脂肪肝和胰岛素抵抗[5]。研究表明,胰高血糖素样肽1(GLP1)激活UCP2/AMPK通路,抑制内质网应激,恢复eNOS 活性,进而改善内皮细胞功能[14];在肺动脉高压患者中,描述了ERs对eNOS表达的负面影响[15]。
长期的高脂饮食会引起甘油三酯和胆固醇的升高,导致高脂血症,而高脂血可通过氧化应激、炎症反应、OX-LDL等作用机制导致血管内皮损伤,造成内皮功能紊乱,增加内皮炎症反应。本实验采取高脂饮食喂养C57BL/6J小鼠复制肥胖模型,以期进一步探究通心络在肥胖模型下,对血管内皮功能的影响。实验结果显示,通心络可降低血清中TC、TG、LDL-C 水平。前期研究显示[16],通心络具有剂量依赖性调节血脂水平,可通过激活PI3K/AKT 信号通路的表达,上调NO的浓度,减少ET-1的表达,改善血管内皮功能。
肠系膜动脉是形成外周阻力的主要血管,对血压的调节有着重要意义[17]。血管内皮细胞通过与血管壁和管腔细胞之间多个复杂的相互作用来维持血管内环境稳定[18]。血管的收缩、舒张功能失调可能会导致心脑血管疾病的发生。血管舒缩活动的异常,引起血管张力的升高,外周阻力增大,进而引起高血压的发生。本实验进一步研究,小鼠肥胖模型下肠系膜动脉内皮舒张功能,提示高脂喂养所致脂代谢紊乱可引起内皮性舒张功能障碍,通心络组的血管舒张率较高脂组明显提高,表明通心络可改善高脂饮食动物的内皮依赖性血管舒张反应,保护血管内皮功能。
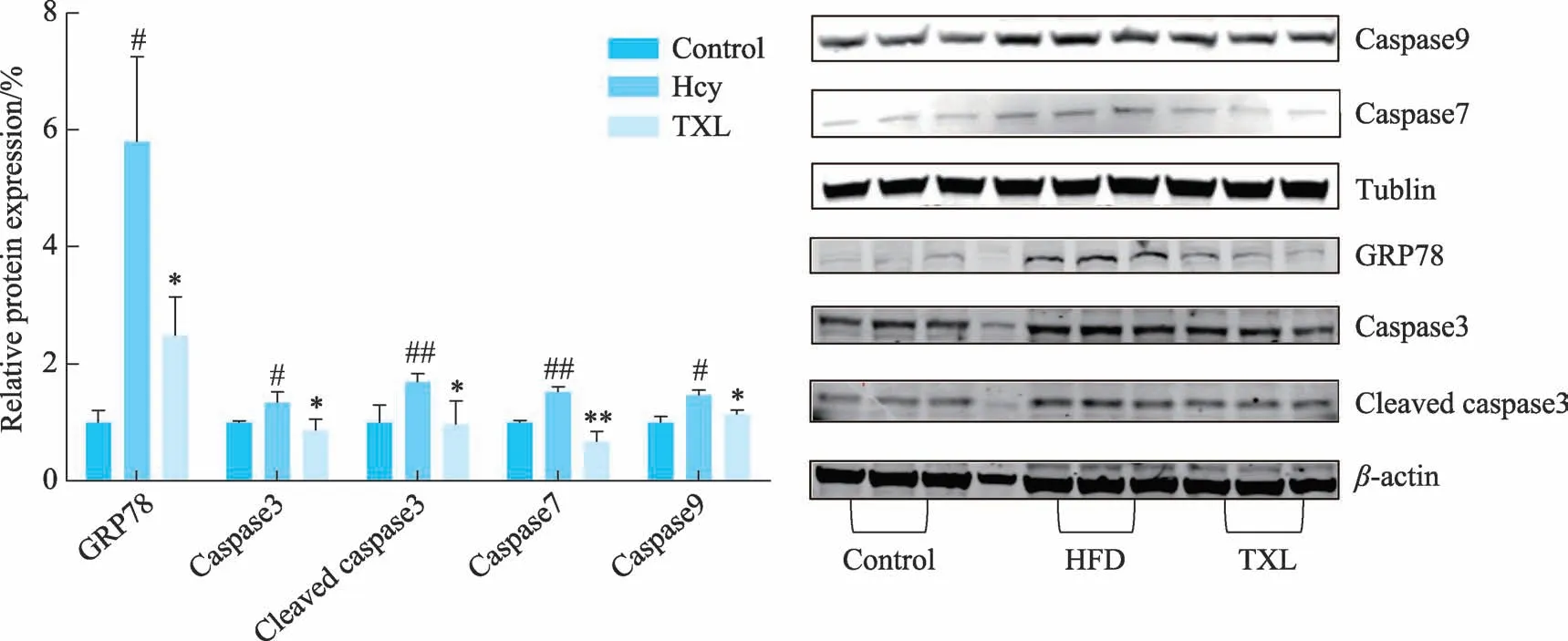
图6 TXL对Hcy诱导的HUVEC细胞损伤蛋白表达情况的影响
GRP78 是内质网应激的标志性蛋白。检测HUVEC 细胞中GRP78 蛋白表达明显上调,提示内质网应激的发生,而经通心络干预后,GRP78 表达下调。长期且严重的ERs通过激活CHOP、JNK、Caspase-12 3条通路诱导细胞凋亡,上调Caspase-3、Caspase-7、Caspase-9 的蛋白表达,通心络干预后凋亡相关的蛋白表达较Hcy 组明显下调。另外,通心络能增加抗凋亡蛋白Bcl-2的基因表达,降低促凋亡蛋白Bax的基因表达。ERs 发生后,激活Caspase-12,进而激活Caspase-9、Caspase-3 等效应Caspase。N 端前域长的Caspase-8、Caspase-9 作为凋亡的启始蛋白,位于级联反应凋亡的最上游,N 端前域短的Caspase-3、Caspase-7 位于凋亡“瀑布”反应下游,Caspase-3 在促凋亡信号的最后一步被激活,而抑制Caspase 活性则能减弱细胞的损伤和凋亡[19]。Caspase-3 是死亡受体途径、线粒体途径和内质网途径三者共同的效应分子。
通心络以络病学说为指导,益气活血、搜风通络为原则而创立。由人参、蜈蚣、全蝎、水蛭、土鳖虫、赤芍、酸枣仁、降香等药物组成。方中人参益气通络,蜈蚣、土鳖虫通络剔瘀,全蝎、蝉蜕搜风解痉,赤芍凉血化瘀,酸枣仁养血安神,配伍芳香之檀香、降香、乳香、冰片入络通窍[8]。有研究表明,通心络通过激活PI3K/Akt通路,来实现抗ERs所致凋亡作用[20]。大量实验和临床证据表明[16,21,22],通心络可降低NO 水平,改善血管内皮功能、氧化应激指标和减轻微炎症状态等多重作用。最新研究显示[23],通心络胶囊可延缓颈动脉平均内中膜厚度、斑块面积和血管重构指数的进展。通心络的独特理论特色和确切临床效果引起了国内中西医学界的关注,其可改善血管内皮功能这一血管病始动因素,并可有效阻断血管病变的不同病理环节,体现了通络中药标本兼治、防治结合的作用特点。但针对肥胖导致的血管损伤并未见报道,本研究发现,通心络能改善细胞的内质网应激,发挥抗细胞凋亡的作用,有效预防高脂膳食导致的血管内皮功能损害。

