盐角草在Cd、Pb、Li污染盐土修复中的应用潜力
娄腾雪,吕素莲,李银心
1中国科学院植物研究所 植物分子生理学重点实验室,北京 100093
2中国科学院大学 生命科学学院,北京 100049
我国一方面人口众多,耕地不足,淡水资源极度贫乏,另一方面盐碱荒漠面积巨大。据统计,全世界盐碱地的面积为9.54亿hm2,其中我国约为1亿 hm2,主要分布在沿海滩涂和内陆盆地。这些盐碱地是重要的后备土地资源。利用盐碱地种植藜麦、盐角草等盐生经济作物可为人类的粮食供应提供新的保障;同时盐碱地是巨大的碳库,在碳循环中扮演着重要的角色,在生态系统构成中具有不可替代的作用。
然而,随着矿产开采和工业废水的排放,重金属镉 (Cd)、铅 (Pb) 等污染物通过水网输入,造成严重的土壤污染,其中包括一部分盐渍化后备土地。Cd、Pb在土壤中滞留时间长,易在表土积累,可被植物吸收,是中国土壤-植物生态系统中主要的重金属污染[1]。而且,有研究表明,盐土中重金属具有更大的生物有效性,盐分提高了重金属的潜在风险[2]。除了重金属污染外,近年来锂工业发展迅猛,大量工业废水及废弃锂电池和锂卤化物被排放到土壤中,造成了土壤锂污染[3-4]。而且,随着人们对电子产品、汽车等锂能源产品需求量的不断增长,未来锂污染将更加严重。在自然环境下,与碱土及普通土壤相比,盐土中的总锂量和有效锂含量均更高[5]。锂是最轻的碱金属,不是植物生长的必需元素,但低浓度锂能促进植物生长,而高浓度锂对植物会产生毒害作用[6],主要表现为生物量降低、叶绿素含量减少、细胞膜完整性破坏以及生理生化过程改变等[7]。目前关于植物对锂的吸收利用机制鲜有报道。盐分和这些金属污染物的双重影响,严重威胁着盐碱地的开发利用与生产安全。
利用植物修复污染土地是一项经济有效的策略。而目前已报道的400多种重金属超累积植物大多为甜土植物,并不适用于盐土重金属污染的修复。近年来,利用盐生植物修复盐土重金属污染的研究逐渐引起人们的关注。除了耐盐外,相对于甜土植物,一些盐生植物在提取修复土壤重金属污染方面也具有一定的优势。比如,海马齿对Cd、Pb的提取修复能力远高于芥菜和烟草[8-9]。
盐角草Salicornia europaea为藜科盐角草属的一年生真盐生植物,被认为是世界上最耐盐的陆生植物之一[10]。在实验室条件下,200-400 mmol/L NaCl可以促进盐角草的生长[11]。研究表明盐角草对 Cd、Pb胁迫具有较强的耐受性,具有修复重金属污染土壤的潜力[12-13]。但关于盐角草对Cd、Pb胁迫的生理响应及耐受机制还不清楚。关于盐角草对 Li胁迫的耐受性和吸收累积特性的研究还未见报道。本研究采用土培盆栽试验比较了盐渍环境下盐角草对Cd、Pb、Li胁迫的耐受性及对这3种离子的吸收特性,并通过研究3种离子胁迫对抗氧化物酶 (超氧化物歧化酶 (SOD)、过氧化物酶 (POD)、过氧化氢酶 (CAT)、抗坏血酸过氧化物酶 (APX)、谷胱甘肽过氧化物酶 (GPX))系统的影响,探讨盐角草的耐受机理,以期为利用盐角草进行污染盐土的修复提供理论依据。
1 材料与方法
1.1 材料与处理
盐角草种子采自山东省东营市中国科学院高耐盐经济植物繁殖基地。将种子播种于7 cm×7 cm的花盆中,待种子萌发后进行200 mmol/L NaCl浇灌。生长 30 d后,选择长势一致的植株进行Cd、Pb、Li胁迫处理。用分别含有不同浓度CdCl2·2.5H2O、Pb(NO3)2和 LiCl 的 200 mmol/L NaCl溶液对植株进行浇灌处理。Cd处理设置6个浓度,分别为0、1、5、10、20、50 mmol/L CdCl2·2.5H2O;Pb处理设置5个浓度,分别为0、5、10、20、50 mmol/L Pb(NO3)2;Li处理设置6个浓度,分别为 0、20、50、100、200、400 mmol/L LiCl。以浇灌200 mmol/L NaCl溶液的植株为对照。每个处理重复5次。花盆随机排列并定期调换位置以减少光照等差别带来的影响。处理后第30天,采集根部和地上部样品测定各项生长生理指标和离子含量。
1.2 测定方法
1.2.1株高和生物量的测定
以盆为单位,每处理选取3盆,每盆选取相同高度、成熟度一致且生长状况相近的5株植株进行株高和生物量的测定。株高采用直尺法测定;鲜重和干重采用烘干称重法,分别取盐角草根和地上部分,置于烘箱中105 ℃杀青30 min,75 ℃烘至恒重,称重后用不锈钢植物粉碎机磨碎,备测。
1.2.2抗氧化物酶相关基因表达量的测定
分别收取不同处理下的盐角草地上部分,用液氮研磨成粉末。采用Trizol法提取RNA,参照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix (购自全式金公司) 试剂盒说明书进行RNA样品的反转录。从盐角草转录组[14]中搜索编码抗氧化物酶的unigenes,并在 NCBI网站 (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 上进行Blast确认。相关基因的引物信息见表1。采用qRT-PCR方法检测抗氧化物酶基因的表达量。所用仪器为Stratagene Mx3000P (购自Agilent公司),所用试剂为THUNDERBIRD SYBR®qPCR mix (购自 TOYOBO公司)。设定反应程序为:95 ℃预变性1 min;95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸30 s,40个循环;融解曲线分析:95 ℃,15 s;55 ℃,30 s;95 ℃,30 s。以Setubulin基因为内参,采用 2–ΔΔCt法[15]计算基因的相对表达量。
1.2.3丙二醛含量和抗氧化物酶活性的测定
取地上部分0.1 g鲜样,加入1 mL试剂盒提供的提取液,进行冰浴匀浆;8 000×g、4 ℃离心10 min;取上清液,按照试剂盒说明书用比色法测定相关指标。试剂盒购自北京索莱宝科技有限公司。MDA含量采用硫代巴比妥酸法测定,SOD采用氮蓝四唑光还原法测定,POD采用愈创木酚法测定,CAT采用紫外吸收法测定,APX采用过氧化氢紫外分光光度法测定,GPX采用DTNB比色法测定。每个处理3个重复。
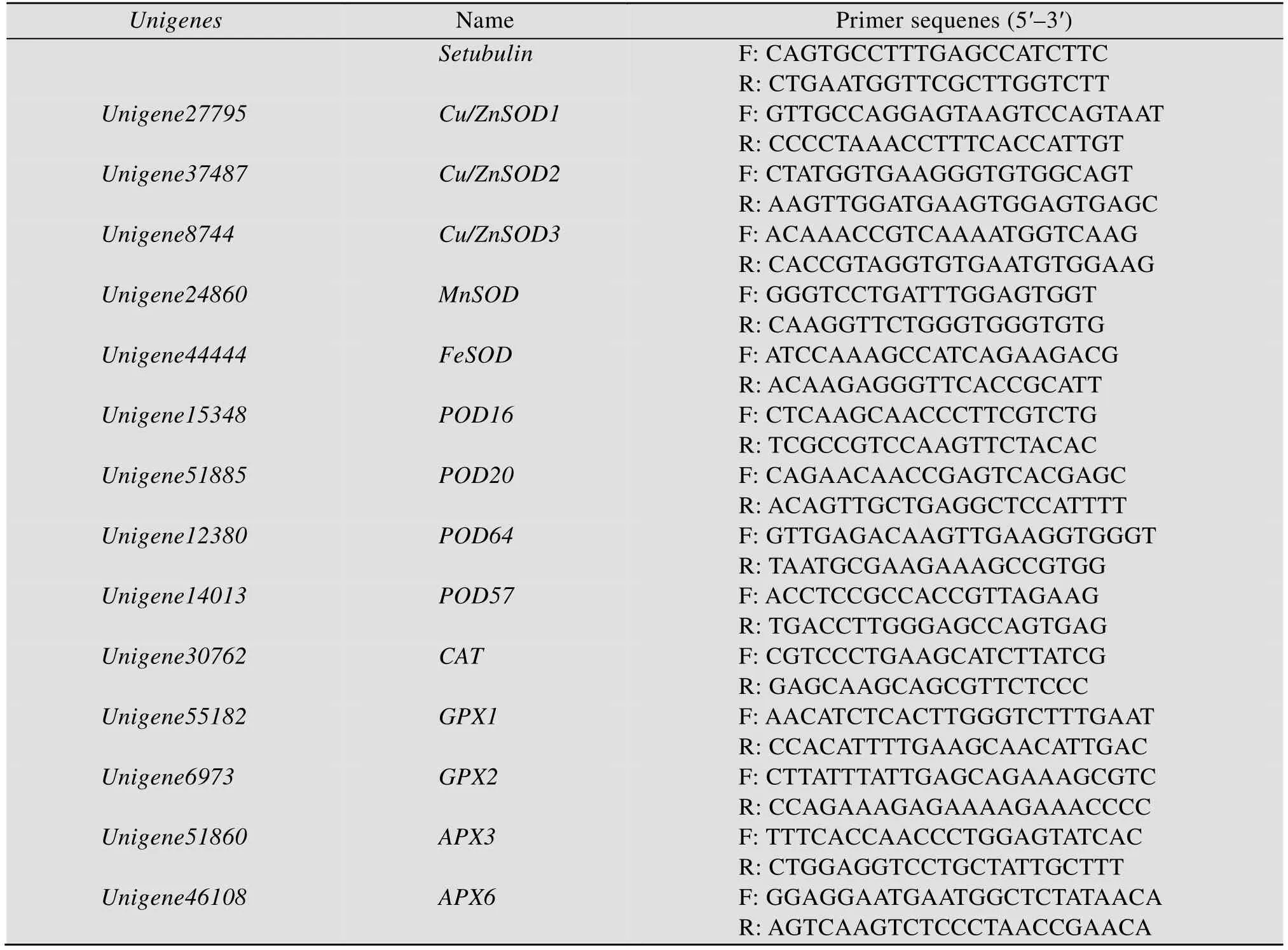
表1 RT-qPCR引物列表Table 1 The primers used in RT-qPCR
1.2.4离子含量的测定及转运系数计算
分别称取0.1 g根和地上部分样品,放入消煮管中,加入1 mL HNO3和0.5 mL 30% H2O2,盖上小漏斗,浸泡过夜。220 ℃消煮4 h至溶液变为白色透明,冷却定容至50 mL容量瓶中。采用电感耦合等离子体发射光谱仪 (ICP) 测定Na、K、Cd含量,采用电感耦合等离子体质谱仪 (ICP-MS)测定Pb和Li含量。每处理3个重复。
根据以下公式计算盐角草Cd、Pb和Li的转运系数 (Translocation factor,TF):
TF=植物地上部分的离子含量/植物根部离子含量。
1.3 数据处理
采用Graph Pad Prism 5进行作图,采用SPSS 20软件进行统计学分析和相关性分析。
2 结果与分析
2.1 Cd、Pb、Li处理对盐角草生长的影响
如图1A所示,分别用50 mmol/L Cd、50 mmol/L Pb和400 mmol/L Li处理30 d后,盐角草植株均全部死亡。在Cd胁迫下,低浓度Cd (1和5 mmol/L)时,盐角草的生长情况与对照相比无显著差异;Cd浓度为10 mmol/L时,盐角草株高与对照无显著差异,而植株鲜重和干重均显著降低,说明植株生长开始受到抑制;Cd浓度为20 mmol/L时,株高、鲜重和干重与对照相比均显著下降,分别降低23.64%、39.31%和43.22% (图1B)。
在Pb胁迫下,较低浓度Pb (≤10 mmol/L)对盐角草生长发育影响不大。而20 mmol/L Pb处理下,植株生长开始受到抑制,盐角草的株高、鲜重和干重均显著下降,分别降低25.34%、76.90%和 43.75% (图 1B)。
与Cd和Pb胁迫不同,20 mmol/L Li促进了盐角草生长,与对照相比,株高、鲜重和干重分别提高11.94%、59.35%和107.96%。之后,随着Li浓度的升高,盐角草的株高和鲜重分别在100 mmol/L Li和50 mmol/L Li时,与对照相比开始显著下降。在Li浓度为200 mmol/L时,株高、鲜重分别降低了 16.25%和 55.60%,显著低于对照;而干重和对照相比无明显差异 (图1B)。
由此可以看出,盐角草对Cd、Pb、Li的耐受范围分别为< 10 mmol/L Cd (约2 284 mg/kg)、<20 mmol/L Pb (约 6 625 mg/kg) 和< 50 mmol/L Li (约2 120 mg/kg)。因此,盐角草对Cd、Pb、Li的耐受性顺序为Li>Pb>Cd。
2.2 Cd、Pb、Li胁迫对盐角草 MDA含量的影响
MDA是植物细胞膜脂过氧化产物之一,能与细胞内各种成分发生反应,引起各种酶和膜的严重损伤,其含量高低可以反映膜脂过氧化作用强弱及质膜损坏程度[16]。由图2可知,在Cd、Pb、Li处理下,盐角草的MDA含量随着处理浓度的升高而升高,说明植株膜脂过氧化程度逐渐增强。在Cd 20 mmol/L、Pb 20 mmol/L和Li 50 mmol/L胁迫处理下,MDA含量达到最大值,分别为对照的3.47、17.50和7.32倍。

图1 不同浓度Cd、Pb、Li对盐角草生长的影响Fig. 1 Effects of different concentrations of Cd, Pb and Li on the growth of S. europaea. Seedlings of Salicornia europaea were treated with different concentrations of Cd, Pb and Li for 30 days, and phenotypes (A), plant height,shoot fresh weight and shoot dry weight (B) were shown. Scale bar=1 cm. Different lowercase letters in the same polygonal chart indicated that there were significant differences among different treatments under the same stress(P<0.05).
2.3 盐角草抗氧化物酶系统对Cd、Pb、Li胁迫的响应
植物体内酶促保护系统中的 SOD、POD、CAT、APX、GPX对清除植物体内产生的活性氧具有至关重要的作用。我们首先在转录水平研究了不同 Cd、Pb、Li胁迫处理下,盐角草中 5个SOD基因 (Cu/ZnSOD1、Cu/ZnSOD2、Cu/ZnSOD3、FeSOD和MnSOD)、4个POD基因 (POD16、POD20、POD57和POD64)、1个CAT基因、2个APX(APX3和APX6) 和2个GPX基因 (GPX1和GPX2) 的表达对不同浓度 Cd、Pb、Li胁迫的响应。如图3A所示,Cd胁迫下,除了APX3和APX6外,其他基因均在一个或多个处理浓度下呈现上调表达。其中POD20和POD57的表达随着处理浓度的增加逐渐增强,多数 SOD基因表达呈现先升高后降低的趋势,GPX1、GPX2和CAT在20 mmol/L时表达增强。在Pb胁迫下,除了MnSOD和POD64在20 mmol/L下表达下调外,其余基因在各处理浓度下均表现不同程度的上调表达 (图 3B)。Li胁迫处理下,所有基因在所有处理浓度下均表现显著上调表达 (图3C)。
为了进一步研究抗氧化物酶活性对Cd、Pb、Li胁迫的响应,我们对5个抗氧化物酶酶活分别进行测定。Cd胁迫下,与基因表达检测结果基本一致,SOD、POD、GPX酶活在不同浓度下均有不同程度的提高,APX酶活没有显著变化,而CAT酶活在高浓度Cd处理下显著降低 (图4A)。Pb胁迫下,CAT、POD、GPX酶活在一个或多个浓度处理下升高,APX没有显著变化,而SOD在高浓度下显著降低 (图 4B)。Li胁迫下,POD酶活随着处理浓度的升高而逐渐升高,CAT和GPX酶活也有所提高,SOD无显著变化,而APX酶活显著降低 (图4C)。这些结果表明不同的抗氧化物酶对不同离子胁迫具有不同的响应机制。
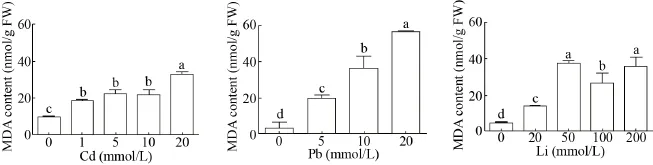
图2 不同浓度Cd、Pb、Li处理下盐角草MDA含量Fig. 2 MDA contents of S. europaea under different concentrations of Cd, Pb and Li. Different lowercase letters in the same polygonal chart indicated that there were significant differences among different treatments under the same stress (P<0.05).

图3 不同浓度Cd(A)、Pb(B)、Li(C) 处理下盐角草抗氧化物酶基因表达变化Fig. 3 Gene expressions of antioxidant enzymes in response to different concentrations of Cd(A), Pb(B) and Li(C)treatments in S. europaea.

图4 不同浓度Cd、Pb、Li处理下盐角草抗氧化物酶活性变化Fig. 4 Antioxidant enzyme activities of S. europaea under different concentrations of Cd, Pb and Li. Different lowercase letters in the same polygonal chart indicated that there were significant differences among different treatments under the same stress (P<0.05).
2.4 Cd、Pb、Li含量及转运特性
分别对不同浓度Cd、Pb、Li处理下盐角草根和地上部中Cd、Pb、Li含量进行测定。结果显示,盐角草根和地上部的Cd、Pb、Li含量均随处理浓度的增加而增加。20 mmol/L Cd、Pb、Li处理下,盐角草根中 Cd、Pb、Li含量分别达到 1 801、18 782和185 mg/kg,地上部分Cd、Pb、Li含量分别为626、838和1 218 mg/kg。200 mmol/L Li处理下,盐角草根和地上部分的Li含量分别达到1 828和5 733 mg/kg (图 5)。
值得注意的是,盐角草根中的 Cd、Pb含量显著高于地上部分,而在Li处理下,地上部分的Li含量显著高于根中。转运系数 (TF) 是反映植物不同部位间离子运移能力大小的指标,用来评价植物将离子从地下向地上的运输和富集能力。转运系数越大说明植物从地下部分向地上部分运移离子的能力越强[17]。如图5所示,Li的转运系数最高,为2.97-6.53,其中20 mmol/L时最高;其次 Cd的转运系数为 0.23-0.52,其中 Cd处理浓度为5 mmol/L时,TF最大;Pb的转运系数最低,为0.004-0.050。
2.5 Cd、Pb、Li处理对盐角草 Na和 K含量的影响
前期研究发现200-400 mmol/L的NaCl可以促进盐角草的生长,Na是盐角草生长必需的大量元素[10]。因此,我们进一步测定了不同浓度Cd、Pb、Li处理下盐角草根和地上部的Na和K含量。在对照和处理条件下,盐角草地上部的 Na含量远高于根中,这与前期报道一致[18]。不同浓度Cd、Pb、Li处理下,根中的Na含量与对照相比没有显著变化,而地上部的Na含量均随着处理浓度的升高而逐渐降低 (图6)。对于K含量,除了Cd胁迫处理下根中的K含量和Pb胁迫处理下地上部中的K含量相对于对照没有显著变化外,其他处理下根和地上部中的 K含量均随着胁迫浓度的升高呈现逐渐降低的趋势。进一步相关性分析表明,在地上部分,Cd、Li含量分别与Na含量呈显著负相关;在根中,Pb、Li分别与K呈显著负相关 (表2)。这
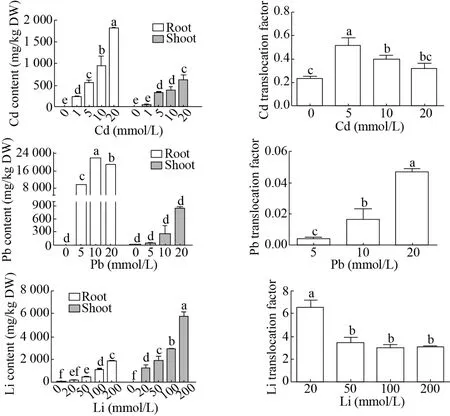
图5 盐角草根和地上部Cd、Pb、Li含量及转运系数Fig. 5 Cd, Pb, Li contents in roots and shoots and translocation factors of S. europaea. Different lowercase letters in the same polygonal chart indicated that there were significant differences among different treatments under the same stress (P<0.05).
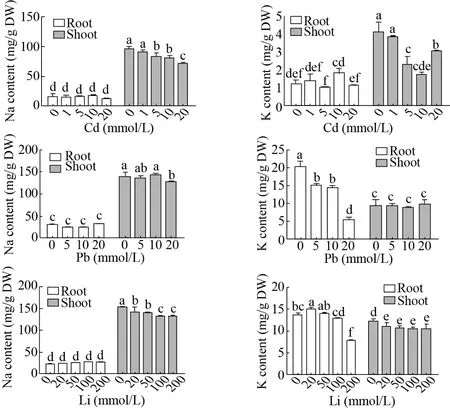
图6 不同浓度Cd、Pb、Li处理下盐角草根和地上部中Na和K含量Fig. 6 Na and K contents in roots and shoots of S. europaea under different concentrations of Cd, Pb and Li. Different lowercase letters in the same polygonal chart indicated that there were significant differences among different treatments under the same stress (P<0.05).

表2 根和地上部金属离子与Na、K含量的相关性分析Table 2 Correlation c oefficients b etween m etal elements and Na, K elements
3 讨论
作物的生长对重金属胁迫的响应因重金属的种类、胁迫浓度以及作用时间而各有差异[19-20]。本研究中,采用不同浓度Cd、Pb、Li处理盐角草,结果表明,盐角草对 Cd、Pb、Li的耐受顺序为Li>Pb>Cd,盐角草对 Cd最敏感。这与何洁等[21]的研究结果是一致的,其研究不同浓度 Zn(0-400 mg/kg) 和Cd (0-0.6 mg/kg) 对翅碱蓬幼苗生长的影响,结果表明,翅碱蓬对Zn的耐受阈值为10 mg/kg,而Cd浓度为0.1 mg/kg时,翅碱蓬的发芽率、苗高、苗重已经受到影响。这说明Cd对植物生长有普遍毒性作用,且产生毒性的浓度较低,即毒性较强。另外,我们发现在高浓度Cd处理下,盐角草对Cd的转运系数随Cd浓度的增加不断下降 (图5),这可能是相对于Pb、Li胁迫,盐角草对Cd胁迫最敏感的重要原因。
重金属离子可以通过干扰植物营养物质的正常吸收和体内再分配,造成植物的生物量降低[22]。前期研究发现200-400 mmol/L的NaCl可以促进盐角草的生长,Na是盐角草生长必需的大量元素[10]。本研究中我们发现,盐角草地上部分Cd、Li含量分别与Na含量呈显著负相关;而根中Pb、Li分别与K呈显著负相关 (表2)。因此,我们推断Cd、Pb、Li胁迫可能降低了植株对Na和K的吸收与转运,从而抑制了植株的生长。值得注意的是,低浓度的Li (≤20 mmol/L)对盐角草有促进生长的作用。这与Kalinowska等的研究报道是一致的。Kalinowska等[23]研究表明,2.5 mg/L低浓度Li可以使莴苣Lactuca sativa根和地上部分含有较高的相对含水量,并促进植株生长。该研究认为这可能是由于拟态效应,即亚致死剂量的潜在毒性物质[24]对植物生长有刺激作用,或是 Li离子对植物新陈代谢的一些其他未知效应。另外,有研究表明,Li能够替换Na、K以及Mg和Ca[7,25]。因此猜测,低浓度Li可以促进盐角草的生长,也可能是由于Li替换Na、K促进了植株的生长。
逆境胁迫对植物的损伤常常是由于产生过多的体内活性氧 (ROS),从而导致质膜受损,细胞功能丧失。盐角草在3种离子胁迫下,MDA水平均随着处理浓度的升高而升高 (图 2),说明细胞受高浓度离子毒害,膜脂过氧化程度增强。抗氧化物酶系统在清除活性氧、调控细胞内的氧化还原平衡、植物抵御逆境胁迫中发挥着重要作用。SOD可以将超氧化物歧化为基态氧和 H2O2,而H2O2的清除又可以在POD、CAT、APX、GPX等的协同作用下共同完成。本研究发现,在转录水平上,盐角草中编码SOD、POD、CAT、APX、GPX的相关基因在Cd、Pb、Li胁迫时均呈现上调表达,其中在Pb、Li胁迫时这种响应更明显(图3)。而在酶活层面,各抗氧化物酶对不同离子胁迫的响应有所不同 (图4)。盐角草在抵御外界Cd、Pb、Li胁迫时,各种处理浓度下均会启动POD酶活抵抗逆境,而在较高浓度下 (Cd≥10 mmol/L,Pb≥10 mmol/L和Li≥20 mmol/L)均会启动GPX发挥酶活性。说明盐角草中POD和GPX可能是多种逆境下普遍启动的抗氧化系统。此外,在Cd胁迫下 SOD也发挥一定作用,而在较低浓度Pb(5 mmol/L) 和Li (50 mmol/L) 胁迫下CAT酶活也发挥一定作用。张义贤和张丽萍[26]在研究不同浓度 Cd、Pb、Hg、Ni胁迫对大麦抗氧化物酶(SOD、POD和CAT) 的影响时,也发现不同重金属胁迫下,抗氧化物酶的酶活响应不一致。这说明植物在不同的胁迫处理下具有不同的抗氧化物酶响应机制,协同抵制重金属的氧化毒害。还有一些酶活在低浓度离子处理下,酶活与对照相比没有明显变化,而高浓度下酶活显著降低。比如Cd胁迫下CAT酶活的变化和Li胁迫下APX酶活的变化。这可能是由于细胞长时间地维持在较高的 O2–·浓度下,细胞内的活性物质包括酶受到损伤,致使CAT或APX酶活性下降[27]。
盐土重金属污染使得植物面临着重金属和盐分的“双重”胁迫,甜土植物在盐土环境中难以正常生长,无法用于修复盐土重金属污染[28]。因此,对盐土植物修复盐土重金属污染的研究逐渐引起人们的关注。相关研究表明,一些盐生植物具有超富集重金属的潜力[29]。转运系数 (TF) 是评价植物吸收积累重金属污染物的重要指标。转运系数大于 1是重金属超富集植物区别于普通植物的重要特征之一[22]。盐角草 Cd和 Pb的转运系数均小于1,不符合超富集植物的特征。然而,本研究中,在200 mmol/L NaCl条件下,Cd、Pb处理浓度为20 mmol/L时,盐角草地上部分Cd、Pb含量分别为626和838 mg/kg,达到了超富集植物地上部分 Cd含量>100 mg/kg的标准,略低于 Pb含量>1 000 mg/kg的标准。另外,盐角草具有较大的生物量,我们在山东东营盐碱地的多年种植记录显示,每年每hm2大约可收获5 000 kg地上部干物质。按本研究的结果推算,盐角草地上部可分别提取 3 130 g Cd/(hm2·y)和 4 190 g Pb/(hm2·y)。Cd的提取量略低于超富集植物天蓝遏蓝菜Thlaspi caerulescens地上部的 Cd提取量(4 160-8 320 g/(hm2·y))[30],而远高于芥菜Brassica juncea(60-80 g/hm2·y)[31]和烟草Nicotinana tabacum(500 g/hm2·y)[8]。Pb的提取量远远高于盐生植物互花米草Spartina alterniflora地上部的Pb提取量(364 g/hm2·y)[32]。此外,在 200 mmol/L NaCl条件下,盐角草可以耐受10 mmol/L Cd和20 mmol/L Pb,该耐受浓度不仅远高于国家土壤环境质量三级标准 (GB15618-1995[33],Cd 1 mg/kg,Pb 500 mg/kg),而且也高于碱蓬Suaeda salsa[34]、滨藜Atriplex triangularis[35]和海马齿Sesuvium portulacastrum[36]等盐生植物。因此,盐角草在Cd、Pb重度污染盐土修复中具有较大的应用潜力。
值得注意的是,本研究中我们首次发现盐角草对Li的转运系数为2.97-6.53,地上部的Li积累量达1 218-5 733 mg/kg DW (图5),具有富Li特性。罗布麻是研究较多的富锂植物,在400 mg/kg(约58 mmol/L) Li处理下,罗布麻的根茎叶干重均下降60%以上,茎叶Li含量2 500 mg/kg左右[37]。与罗布麻相比,盐角草对Li的耐受浓度高得多,即使在200 mmol/L Li胁迫下,盐角草的干重也未发生明显下降 (图1B),且地上部分Li浓度达到5 733 mg/kg DW。在植物修复技术应用中,一个受到关注的问题是富集重金属的植物材料的后续处置和利用问题,这些植物材料如果处置不当可导致二次污染。研究报道,在医药领域,锂盐可以用于精神治疗[6]。因此,在利用盐角草治理锂污染土壤的同时,其富锂的地上部分有可能化废为宝,用作提供人体特殊营养的原料,避免对生物链或环境造成二次污染。盐角草的这一特点进一步提升了其在锂污染修复中的应用价值。

