丙泊酚对高糖诱导大鼠原代成骨细胞氧化应激损伤的影响研究
冯大鹏,石 磊,祝勇刚,吕昌伟,蒋 鹏
高血糖可导致全身多系统组织、细胞病变及功能障碍,如心肌病、动脉粥样硬化、骨质疏松等[1-2]。当前,糖尿病所引起的骨质疏松、骨坏死等骨骼系统疾病的发病率日益增高,其后果不容忽视。这些疾病的病理学基础为高血糖条件下的细胞氧化应激反应增加,这个过程中大量生成的活性氧(ROS)直接导致细胞线粒体损伤,最终造成细胞功能紊乱以及细胞凋亡增加[3]。丙泊酚是临床常用麻醉药物,具有起效快、安全性高等特点。更为值得关注的是,丙泊酚还具有抗氧化应激的功能,并且在血管内皮细胞和心肌细胞中的作用已获得验证[4]。然而,目前关于丙泊酚在成骨细胞中的抗氧化应激特性尚未见报道。因此,本文拟研究丙泊酚对高糖诱导原代成骨细胞氧化应激损伤的影响,为高血糖所致骨骼系统相关疾病的预防与治疗提供新的思路。
1 材料与方法
1.1实验试剂与仪器 胎牛血清、α-MEM培养基均购于Hyclone公司;CCK-8检测试剂盒购于Dojindo Molecular Technologies公司;ROS检测试剂盒(批号:20170115)购自碧云天生物技术研究所;丙泊酚(批号:01708271)购自北京费森尤斯卡比医药有限公司;葡萄糖购于美国Sigma公司;0.25%胰酶购于北京索莱宝科技有限公司;新生SD仔鼠购于空军军医大学动物中心;EPICS XL流式细胞仪购自美国贝克曼库尔特有限公司;酶标仪购于美国Thermo公司。
1.2原代成骨细胞的提取与培养 取新生SD仔鼠,应用颅骨片组织培养法提取原代成骨细胞[5]。将SD仔鼠脱颈处死,用乙醇消毒3次,超净台内完整分离颅骨并去净周围软组织,用PBS液将颅骨片冲洗干净后剪成1 mm×1 mm大小,用0.25%胰酶消化10 min,用含10%胎牛血清的α-MEM培养基终止消化,将处理后小骨片转移至培养皿中均匀铺开,培养皿放置细胞孵箱培养24 h,更换培养液,隔天换液1次,显微镜下观察贴壁细胞生长80%~90%融合时,用0.25%胰酶消化传代。取第2代细胞进行实验。
1.3实验分组及处理 按照处理方法不同将原代成骨细胞培养分为高糖组、丙泊酚组和对照组。3组均用含10%胎牛血清的α-MEM培养基培养,高糖组的培养液加入25.5 mmol/L葡萄糖;丙泊酚组的培养液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚。
1.4CCK-8法测定细胞增殖活力 取原代成骨细胞接种至96孔培养板内,每孔接种2×103~3×103个细胞,培养第1、3天分别于每组培养细胞中取5个孔,每孔加入CCK-8液100 μl后于细胞培养箱中孵育4 h。然后取出培养板,置于酶标仪中,检测450 nm的OD值并读数,每组5个读数求平均值。
1.5细胞凋亡测定 取原代成骨细胞接种至6孔培养板内,每孔接种1×106个细胞,培养24 h消化收集各组内(每组重复3孔)培养细胞,用冰预冷的PBS重悬细胞3次以后,在细胞中添加Loading Buffer 500 μl,充分混合,添加PI和Annexin V-FITC染液并混匀,用EPICS XL流式细胞仪检测细胞凋亡率,每组3个计数求平均值和标准差。
1.6Western blot检测Caspase-3蛋白表达水平 取原代成骨细胞接种至6孔培养板内,每孔接种1×106个细胞,培养24 h后消化收集各组内(每组重复3孔)培养细胞到1.5 ml离心管中并用PBS液冲洗3遍,适量体积RIPA细胞裂解液提取总蛋白,并用BCA法对蛋白浓度进行测定。用10%的分离胶和5%的浓缩胶进行电泳。蛋白与4×Loading Buffer按照体积比4∶1混合以后置于100℃孵育5 min。将蛋白样品添加到上样孔内,Marker上样量为10 μl,接通电源(通常25 mA),上层胶电压为120 V,下层胶电压为160 V,大约90 min后可见蓝色线条移至玻璃板底端,提示电泳结束,关闭电源。准备6张7 cm×9 cm的滤纸和1张大小合适的PVDF膜,使用前先用甲醇活化PVDF膜。将分离胶小心剥离并盖在滤纸上,并把膜盖在胶上,去除气泡后在膜上面盖3张滤纸,去除气泡,将另一海绵垫盖上。200 mA恒流转膜1 h,然后将转好的膜取出并在室温条件下脱色摇床上用5%脱脂牛奶(0.5% TBST配制)封闭1 h。用TBST溶解的5%脱脂牛奶稀释一抗,稀释比例为1∶300,4℃条件下孵育过夜。用TBST在室温条件下脱色摇床上洗3次,每次5 min。用TBST稀释二抗3000倍,孵育30 min,用TBST在室温条件下脱色摇床上洗3次,每次5 min。将试剂ECLA、ECLB在离心管中以相同体积混合,PVDF膜蛋白面朝上并与上述混合液充分接触1~2 min,然后去尽残留液体,包好放入暗匣里进行曝光。用显影剂和定影剂进行显影及定影,调整曝光条件,扫描胶片,Alpha软件处理后系统分析各个条带的光密度值,以β-actin作为参照。
1.7ROS表达水平检测 按照之前分组方法处理细胞,培养24 h后消化收集各组内培养细胞,用试剂盒检测细胞中ROS含量,ROS表达水平用荧光强度表示。

2 结果
2.1SD仔鼠原代成骨细胞培养 按照颅骨片组织培养法提取SD仔鼠原代成骨细胞,连续培养3~5 d后可见原代成骨细胞从颅骨片边缘长出,形态呈长梭形。见图1。
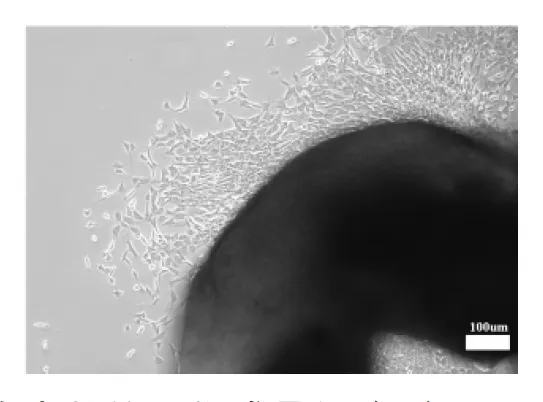
图1 颅骨边缘生长的原代成骨细胞(标尺:100 μm,阴影部分为颅骨片)
2.2细胞增殖活力检测 CCK-8法测定450 nm的OD值,检测细胞增殖活力。培养第1天,3组原代成骨细胞增殖活力比较差异无统计学意义(P>0.05)。培养第3天,对照组和丙泊酚组原代成骨细胞增殖活力明显优于高糖组(P<0.05)。见图2。
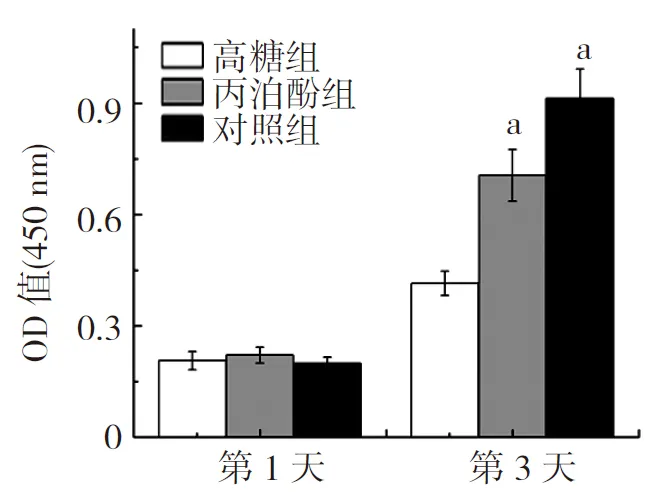
图2 3组原代成骨细胞增殖活力的OD值比较
高糖组培养液加入25.5 mmol/L葡萄糖,丙泊酚组培养液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚,对照组不做任何处理;与高糖组比较,aP<0.05
2.3细胞凋亡率比较 高糖组原代成骨细胞的凋亡率为(35.68±3.35)%、丙泊酚组为(19.03±2.27)%、对照组为(7.21±1.03)%。与对照组比较,高糖组原代成骨细胞的凋亡率明显升高(P<0.05)。与高糖组比较,丙泊酚组原代成骨细胞的凋亡率明显降低(P<0.05)。见图3。
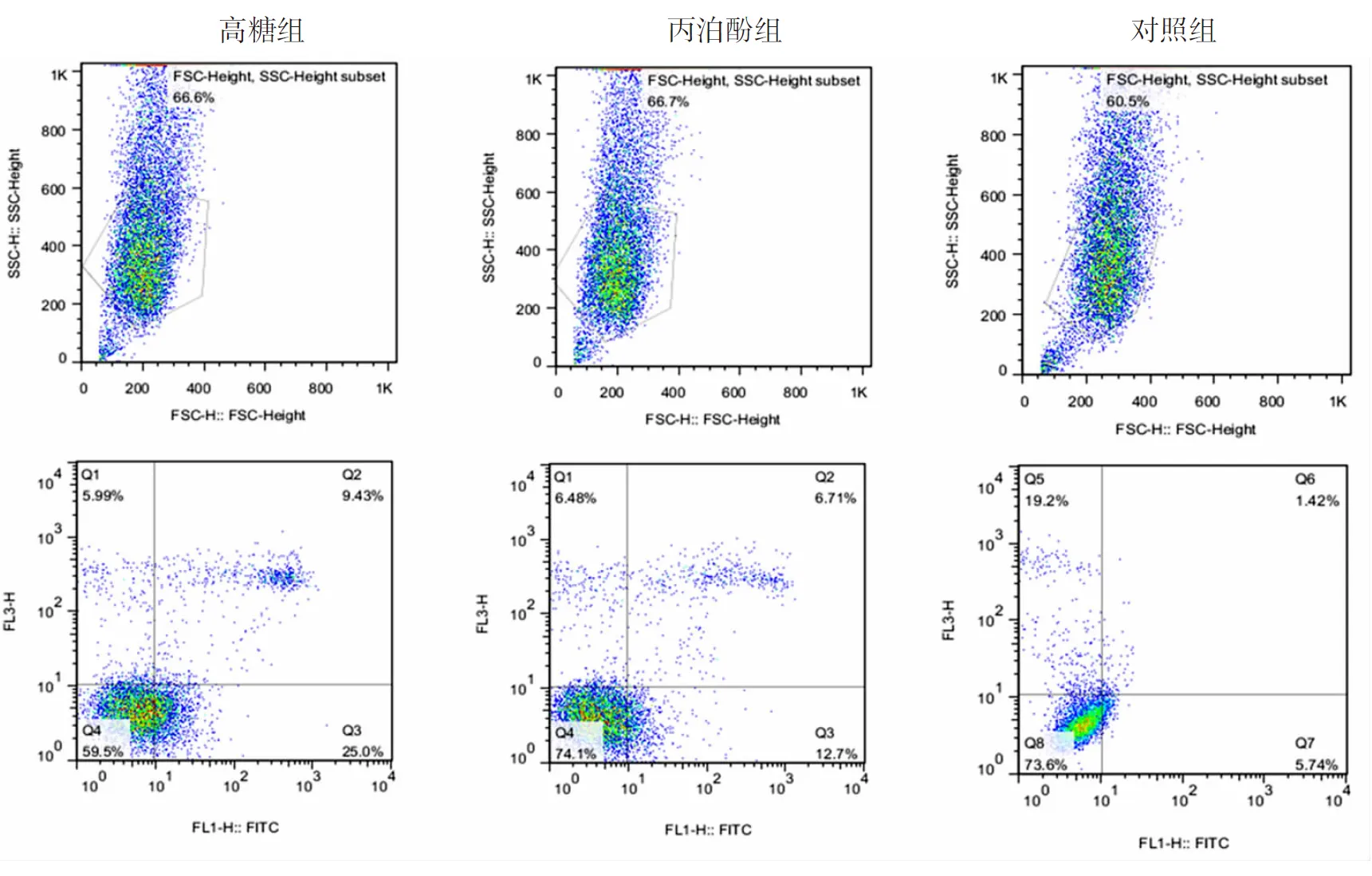
图3 3组原代成骨细胞凋亡率流式细胞分析图
高糖组培养液加入25.5 mmol/L葡萄糖,丙泊酚组培养液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚,对照组不做任何处理
2.4Caspase-3蛋白表达水平检测 高糖组原代成骨细胞Caspase-3蛋白表达水平为0.50±0.04、丙泊酚组为0.28±0.02、对照组为0.27±0.03。与对照组比较,高糖组原代成骨细胞Caspase-3蛋白表达水平明显升高(P<0.05)。与高糖组比较,丙泊酚组原代成骨细胞Caspase-3蛋白表达水平明显降低(P<0.05)。见图4。
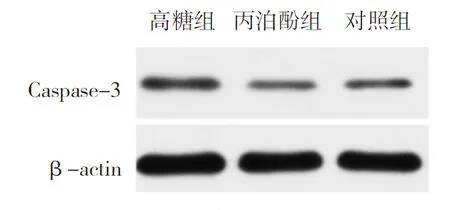
图4 3组原代成骨细胞Caspase-3蛋白表达水平
高糖组培养液加入25.5 mmol/L葡萄糖,丙泊酚组培养液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚,对照组不做任何处理
2.5ROS荧光强度检测 高糖组原代成骨细胞ROS荧光强度水平为463.25±45.37、丙泊酚组为219.18±23.56、对照组为107.53±14.67。与对照组比较,高糖组原代成骨细胞ROS荧光强度水平明显升高(P<0.05)。与高糖组比较,丙泊酚组原代成骨细胞ROS荧光强度水平明显降低(P<0.05)。
3 讨论
近年来随着对氧化应激研究的不断深入,学者们对其在疾病发生和发展过程中起的重要作用有了新的认识。氧化应激源于细胞自身的代偿性反应,细胞通过还原反应,将分子氧变成水而产生能量,此过程中局部会产生少量ROS[6]。ROS主要产自过氧化物酶体脂肪酸、线粒体电子传递链、巨噬细胞和细胞色素P450[7]。ROS在生理水平对细胞有益,且由于大部分细胞具有抗氧化和修复系统,故能耐受一定程度的氧化应激。而当机体内ROS水平持续上升并超过了细胞抗氧化系统的防御能力,则将导致细胞凋亡[8]。此外,ROS还可直接破坏DNA及维持细胞膜稳定的蛋白质和磷脂,诱导细胞凋亡[9-10]。ROS损伤细胞的机制复杂,但其主要是通过活化转录因子、促进细胞凋亡等多种途径来损伤细胞[11]。
氧化应激对于成骨细胞的增殖与分化具有重要意义。细胞内的ROS水平直接影响成骨细胞的存活以及功能[12]。当ROS在细胞内大量蓄积时,内质网蛋白会发生错误折叠,从而引起内质网应激,继而激活下游执行凋亡的因子Caspase-3,最终导致细胞凋亡[13]。而Caspase-3是细胞凋亡的关键分子,当Caspase-3蛋白表达增加时,将导致细胞凋亡[14]。
在临床上,大部分糖尿病患者都伴有骨量减少和骨密度降低,这与局部微循环条件较差相关,但其根源在于高血糖所诱发的氧化应激。糖尿病患者由于体内长期处于高血糖状态,易诱发机体细胞氧化应激,从而导致多器官功能障碍。在骨骼系统,糖尿病可致骨生成和吸收代谢紊乱,继而诱发骨量降低,最终引起骨质疏松及骨慢性感染和炎症等并发症。在口腔科,高血糖所致氧化应激反应可直接导致种植体周围骨丢失、种植体周围炎等[15]。有相关研究表明,高糖条件下,成骨细胞MC3T3-E1的增殖分化受到显著抑制,其机制在于MC3T3-E1成骨细胞系中线粒体膜电位相降低、Caspase-3活性增强、氧化应激水平上升,从而导致细胞凋亡显著增加[16]。成骨细胞是骨细胞的前体,对于骨形成具有极其重要的作用;成骨细胞的增殖与凋亡对于骨界面的愈合极为重要[17]。
丙泊酚是临床常用的静脉麻醉药物之一,研究发现其对心、脑、肾、肝脏等重要脏器具有一定的保护作用;此外,丙泊酚还在缺血再灌注、动脉粥样硬化等氧化应激性疾病中发挥了一定的抗氧化作用,从而能够减轻细胞的损伤以及减少凋亡[18-19]。另外还有文献研究表明,丙泊酚具有抑制肝癌、胃癌、食管癌、胰腺癌、结肠癌、肺癌等肿瘤细胞增殖并促进其凋亡的能力[20-26]。
本研究结果表明,高糖培养条件下,原代成骨细胞增殖减少,凋亡显著增加,细胞中ROS荧光强度水平明显升高,Caspase-3蛋白表达增高。提示高糖能够诱导原代成骨细胞氧化应激损伤和凋亡。而加入丙泊酚,能够明显促进高糖培养条件下原代成骨细胞增殖,抑制其凋亡,细胞中ROS荧光强度和Caspase-3蛋白表达水平也显著降低。该结果提示丙泊酚可通过降低氧化应激减少高糖对原代成骨细胞的损伤作用,对于高糖条件下机体骨形成具有一定的保护作用。另外,本研究中丙泊酚降低氧化应激的机制尚未完全明确,下一步将深入研究高血糖所引起的ROS相关机制以及丙泊酚在其中发挥的调节作用,从而为高血糖所致骨骼系统相关疾病的预防与治疗提供新的途径。
综上所述,高糖可以导致成骨细胞氧化应激损伤,增加细胞凋亡;丙泊酚可以减轻高糖所致成骨细胞的氧化应激,减少细胞凋亡,促进细胞增殖。

