转化生长因子β1诱导胃癌细胞AGS分泌VEGF-C的机制研究
(陆军军医大学第一附属医院消化内科,重庆 400038)
转化生长因子β1(transforming growth factor-β1,TGF-β1)是一种经典的抗炎免疫因子,可由上皮细胞、成纤维细胞及调节性T细胞等多种细胞分泌,在感染性疾病、自身免疫性疾病、特别是肿瘤的发生发展中起着重要作用[1-4]。有文献报道,TGF-β1在肿瘤细胞中的表达显著增加,并经自分泌的方式作用于肿瘤细胞,直接促进肿瘤的增殖、侵袭和转移,或者通过旁分泌的方式抑制抗肿瘤免疫细胞的功能,有利于肿瘤细胞的免疫逃逸[5-6]。据研究报道,肿瘤中TGF-β1的信号与淋巴管的密度以及促淋巴管生成标志物血管内皮生长因子C(vascular endothelial growth factor-C,VEGF-C)的表达密切相关,提示肿瘤细胞来源的TGF-β1很可能参与调控淋巴管的形成,进而导致肿瘤细胞的淋巴转移[7]。在胃癌微环境中,TGF-β1以及VEGF-C的水平均显著增加,然而,肿瘤来源的TGF-β1能否诱导胃癌细胞分泌VEGF-C以及相关的分子机制尚不清楚[8-9]。因此,本研究拟体外培养胃癌细胞系AGS并利用TGF-β1进行刺激,检测VEGF-C的分泌水平,进一步阐明其可能的调控机制。
1 材料与方法
1.1 材料
重组细胞因子TGF-β1购自加拿大Stem cell公司,TGF-βR抑制剂(SB-431542)、Smad3抑制剂(SIS3)、NF-κB抑制剂(BAY11-7082)、MEK1/2抑制剂(U0126)、p38/MAPK抑制剂(SB203580)和JNK抑制剂(SP600125)购自上海碧云天生物科技有限公司,APC标记的抗人TGF-β受体Ⅱ (TGF-β receptor Ⅱ,TGF-βRⅡ)染色抗体、同型对照染色抗体、细胞固定/裂解液、细胞通透/清洗液购自美国BD公司。VEGF-C酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自深圳达科为生物技术有限公司,F12培养基、胎牛血清、胰酶、4%多聚甲醛及PBS均购自美国Hyclone公司。人胃癌细胞系AGS细胞购自中国科学院。
1.2 细胞培养
AGS细胞用含10%胎牛血清的F12培养基置于37 ℃、5%的CO2培养箱中进行培养。培养的AGS细胞以2×106个/孔铺于6孔板中,然后加入0、10、100 ng/mL的TGF-β1进行培养,或预先加入浓度均为10 μmol/LTGF-βR抑制剂(SB-431542)、Smad3抑制剂(SIS3)、NF-κB抑制剂(BAY11-7082)、MEK1/2抑制剂(U0126)、p38/MAPK抑制剂(SB203580)和JNK抑制剂(SP600125)孵育1 h,然后清洗孔中的培养基,再加入新的培养基后利用TGF-β1刺激24 h,收集细胞培养上清液并冻存于-80 ℃,用ELISA检测上清液中的VEGF-C水平。细胞处理分组如下:未刺激组和TGF-β1刺激组用于比较TGF-β1对细胞分泌VEGF-C的影响;TGF-β1刺激下的TGF-βR抑制剂组用于分析TGF-β受体阻断后对TGF-β1诱导细胞分泌VEGF-C的影响;此外,均有TGF-β1刺激的DMSO组、Smad3抑制剂组、NF-κB抑制剂组、MEK1/2抑制剂组、p38/MAPK抑制剂组以及JNK抑制剂组用于比较不同信号通路阻断后对TGF-β1诱导细胞分泌VEGF-C的影响,其中DMSO组是其他信号抑制剂组的对照组。
1.3 流式细胞术
AGS细胞经TGF-β1刺激后使用胰酶消化,并用无菌PBS清洗2次,然后加入APC标记的抗人TGF-βRⅡ染色抗体及相应的同型对照染色抗体,避光染色30 min后用4%多聚甲醛固定15 min,随后用PBS清洗2次,流式细胞仪检测AGS细胞表达TGF-βRⅡ的情况。
1.4 VEGF-C检测
参照VEGF-C的ELISA检测试剂盒操作指南,检测不同处理组间AGS细胞培养上清液中的VEGF-C水平。
1.5 统计学处理

2 结果
2.1 TGF-β受体在AGS细胞的表达
TGF-β1的受体由细胞膜表面的TGF-βRⅡ以及胞内的TGF-βRⅠ组成。利用荧光标记的TGF-βRⅡ抗体进行流式细胞术检测,结果显示,与未染色的AGS细胞相比,同型对照抗体染色的AGS细胞未见峰值的右移,而经APC标记的TGF-βRⅡ阳性抗体染色的细胞峰值则明显右移,由此表明AGS细胞可高表达TGF-β1的受体TGF-βR(图1)。
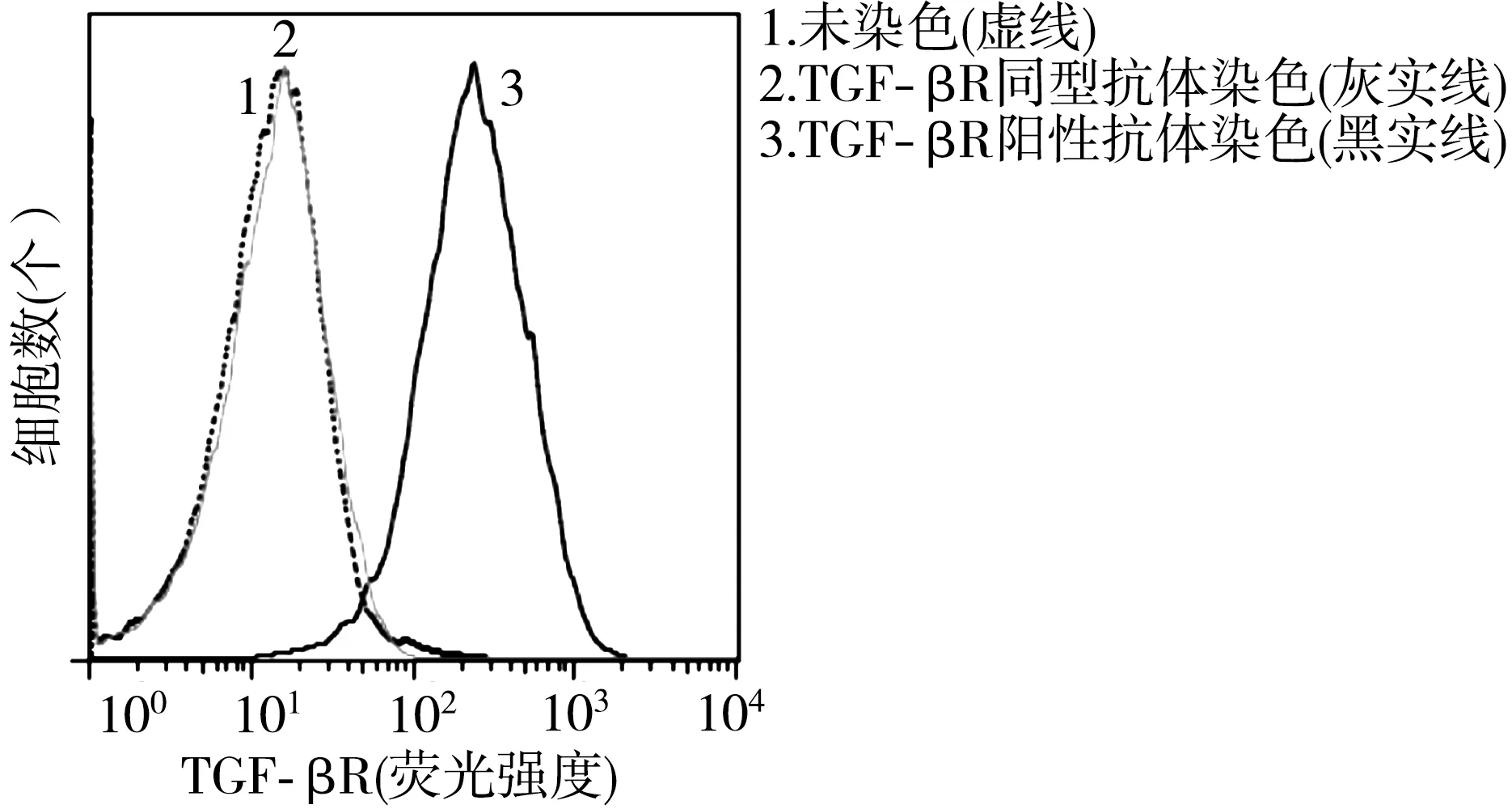
图1 流式细胞术染色检测TGF-β1受体在AGS细胞的表达水平
2.2 TGF-β1诱导AGS细胞分泌VEGF-C
体外培养的AGS细胞经TGF-β1刺激后,收集细胞培养的上清液进行分析。ELISA检测结果显示,TGF-β1刺激组细胞培养上清液中VEGF-C的含量显著高于未刺激组(P<0.05或P<0.01);AGS细胞经TGF-β1以0、1、10、100 ng/mL的剂量刺激24 h后,其上清液中VEGF-C水平分别为(34.4±10.4)pg/mL、(138.5±22.7)pg/mL、(421.3±28.2)pg/mL、(735.2±35.1)pg/mL,组间差异均具有统计学意义(P<0.05或P<0.01);此外,进一步利用10 ng/mL的TGF-β1刺激AGS细胞,并于12、24、48 h后分别检测VEGF-C的分泌水平,结果显示,随着TGF-β1刺激时间的延长,AGS细胞分泌的VEGF-C水平逐渐增加(图2),由此表明TGF-β1能够诱导AGS细胞分泌VEGF-C,并具有剂量和时间依赖性。

a: TGF-β1在不同浓度下(0、1、10、100 ng/mL)诱导AGS细胞分泌的VEGF-C水平;b: TGF-β1(10 ng/mL)在不同时间点诱导AGS细胞分泌的VEGF-C水平 *:P<0.05;#:P<0.01
图2 TGF-β1诱导AGS细胞分泌VEGF-C的水平比较
2.3 TGF-β1通过TGF-βR-Smad3信号诱导VEGF-C的分泌
鉴于TGF-β1可诱导AGS细胞分泌VEGF-C,本本研究进一步探讨其可能的分子调控机制,结果显示,在TGF-β1刺激24 h的前提下,AGS细胞分泌的VEGF-C水平为(438.3±25.1)pg/mL,但是当利用TGF-β受体的抑制剂SB-431542阻断TGF-β1与受体的结合后,VEGF-C水平仅为(49.4±16.3)pg/mL,二者差异具有显著统计学意义(P<0.01)。此外,利用Smad3抑制剂(SIS3)、NF-κB抑制剂(BAY11-7082)、MEK1/2抑制剂(U0126)、p38/MAPK抑制剂(SB203580)和JNK抑制剂(SP600125)预处理1 h,随后再利用TGF-β1进行刺激,结果显示,与TGF-β1刺激下的DMSO组相比,TGF-β1刺激下的Smad3抑制剂组中VEGF-C的水平显著下降,差异有极显著性统计学意义(P<0.01),见图3。在TGF-β1刺激下,NF-κB抑制剂组、MEK1/2抑制剂组、p38/MAPK抑制剂组及JNK抑制剂组中AGS细胞分泌的VEGF-C水平与DMSO组比较差异无统计学意义(P>0.05),提示TGF-β1通过TGF-β受体及下游Smad3信号途径诱导AGS细胞分泌VEGF-C。

a:TGF-βR抑制剂SB-431542对TGF-β1诱导AGS分泌VEGF-C的影响;b:不同信号通路抑制剂对TGF-β1诱导AGS分泌VEGF-C的影响 #:P<0.01
图3 不同信号抑制剂对TGF-β1诱导AGS细胞分泌VEGF-C的影响
3 讨论
胃癌作为最常见的恶性肿瘤之一,具有较高的发病率和致死率[10]。尽管手术切除、放疗、化疗以及靶向免疫治疗在早期胃癌患者中取得了较好的效果,但对晚期胃癌转移患者的疗效仍十分有限[11]。现有的研究证据显示,不健康饮食、细菌感染以及基因等是胃癌的致病因素,而肿瘤微环境中的免疫抑制,特别是调节性细胞因子介导的免疫应答则在胃癌的转移过程中发挥了关键作用[[12-14]。因此,深入阐明肿瘤微环境中促胃癌转移的免疫学机制可为疾病的治疗提供理论依据。
已有多个研究证实调节性细胞因子TGF-β1是肿瘤进展的关键因素之一。有文献报道,患者的肿瘤细胞及肿瘤相关的成纤维细胞高表达TGF-β1,并证实TGF-β1的表达水平与患者的疾病进展和不良预后呈显著正相关[15]。肿瘤微环境中TGF-β1的功能实现依赖于其相应的受体TGF-βR。早期研究证实,胃癌原代细胞可高表达TGF-βR,继而调控TGF-β1的下游级联信号[16];然而胃癌组织中的原代细胞常难以分离纯化及大规模体外培养,极大地限制了TGF-β1的生物学功能研究。为了探讨TGF-β1对胃癌细胞的影响,本研究首先分析了体外培养的胃癌细胞系AGS细胞是否表达其相应的受体。流式细胞术显示,经抗体染色的AGS细胞显示出强的荧光,表明大量的荧光标记抗体在AGS细胞表面结合,有效证实了AGS细胞高表达TGF-βR,并提示AGS细胞可作为体外研究TGF-β1功能的靶细胞。
TGF-β1结合受体后,可诱导肿瘤细胞分泌促转移相关的因子,从而增强肿瘤细胞的远端转移能力[17]。本研究发现,经TGF-β1刺激的AGS细胞可大量分泌促淋巴管生成因子VEGF-C;随着TGF-β1刺激剂量或者刺激时间的增加,其诱导AGS细胞分泌VEGF-C的水平也逐渐增加。当加入TGF-βR抑制剂阻断TGF-β1与其受体的相互作用后,AGS细胞分泌的VEGF-C水平明显下降,由此提示TGF-β1通过其受体调控了VEGF-C的体外分泌。据文献报道,TGF-β1刺激组细胞表达的VEGF-C mRNA水平显著高于未刺激组,而经TGF-βR受体抑制剂阻断后,TGF-β1诱导的VEGF-C mRNA水平则显著下降[18],由此提示TGF-β1很可能通过调控VEGF-C的转录水平,进而影响其在体外的分泌。
TGF-β1与TGF-βR结合后,需要激活下游的级联信号,才能诱导VEGF-C的有效分泌。目前,已有研究报道Smad3、NF-κB和MAPK等多条信号通路参与介导TGF-β1的生物学功能[19-20]。因此,本研究加入多个信号通路抑制剂,以期探讨TGF-β1诱导AGS细胞分泌VEGF-C的分子机制。结果发现在均有TGF-β1作用的条件下,预先加入Smad3抑制剂(SIS3)的AGS细胞培养上清液中VEGF-C水平显著低于加入DMSO的AGS细胞培养上清液中VEGF-C的水平,而NF-κB抑制剂BAY11-7082、MEK1/2抑制剂(U0126)、p38/MAPK抑制剂(SB203580)和JNK抑制剂(SP600125)处理的AGS细胞培养上清液中VEGF-C的水平与DMSO组中VEGF-C的水平相当,由此表明在体外培养的AGS细胞中,TGF-β1经TGF-βR-Smad3信号通路诱导VEGF-C的分泌。基于VEGF-C参与诱导新生淋巴管的形成并介导肿瘤细胞的淋巴转移,由此提示在胃癌微环境中,TGF-β1可能通过增加VEGF-C的分泌参与调控肿瘤淋巴管的形成,进而促进胃癌细胞的淋巴转移。
综上所述,本研究通过体外实验证实了TGF-β1可通过TGF-βR及其下游Smad3信号诱导胃癌细胞分泌VEGF-C,进而有助于胃癌研究的不断进展,是探讨TGF-β1在胃癌生物学作用中的有力补充,揭示了TGF-β1不仅能够直接促进胃癌细胞上皮间质化后的远端播散,而且还可以通过诱导胃癌细胞分泌促淋巴管生成因子VEGF-C,协助胃癌细胞的淋巴转移。因此,进一步通过体内研究阐明TGF-β1调控VEGF-C分泌的促瘤机制,将为临床胃癌患者靶向设计阻断TGF-β1及其下游信号的免疫治疗方案提供新的理论依据。

