以磨玻璃影为主要表现的肺部感染性病变影像学鉴别诊断
龙冰清,熊 曾,刘进康
(中南大学湘雅医院放射科,湖南 长沙 410008)
2019年12月以来,中国武汉暴发新型冠状病毒感染,并在全球蔓延。新型冠状病毒已被命名为SARS-CoV-2,所导致的疾病为COVID-19。SARS-CoV-2核酸检测阳性是COVID-19确诊的依据,但因核酸检测存在检测时间较长、假阴性、生物安全要求高等局限性,不能完全满足临床需求。放射影像学检查,尤其是计算机断层扫描(computerized tomography,CT)作为排查肺部感染快捷、简便的方法,不仅可以判断感染的有无,还可为病原体感染判断提供参考依据,具有独特的诊断优势。COVID-19的主要肺部CT表现为磨玻璃影(ground-glass opacity,GGO)、实变、铺路石征、线性影, 其中GGO占86%[1]。因此,掌握以肺部GGO为主要表现的感染性病变的影像诊断及鉴别诊断,对于COVID-19的早发现、早诊断、早治疗具有重要意义。本文就常见的以GGO为主要表现的肺部感染性病变进行总结。
1 GGO的定义及形成原因
GGO指在CT肺窗上表现为密度增高的病灶,其内支气管及血管纹理可显示,该病灶因看上去形似磨玻璃而得名[2]。肺密度由肺内气腔密度、固有肺组织密度、肺内血管外体液量及肺血容量构成。任何疾病导致肺密度生理因素发生改变将造成肺密度改变,如气腔密度、肺组织密度、肺内血管外体液量及血容量的改变,是肺密度改变的基本病理基础。GGO形成原因为[2-3]:(1)肺泡塌陷、肺泡容积减少致肺泡含气量减少;(2)液体或细胞等部分充填肺泡腔;(3)肺组织间质及肺泡壁增厚;(4)肺气肿、气道疾病或肺血栓栓塞所致肺血流灌注相对增加;(5)以上情况同时存在。肺部GGO可以为良性病变,如局灶性间质纤维化、炎症、感染和出血,也可以是肺腺癌及浸润前病变[4]。
2 GGO相关的感染性病变及其典型CT表现
以GGO为主要表现的感染性病变可以由病毒、细菌、支原体、寄生虫等引起,其中以病毒引起者最常见,故本文主要从病毒性肺炎和非病毒性肺炎两方面进行阐述。
2.1 病毒性肺炎
2.1.1 冠状病毒科 冠状病毒是引起感冒症状较常见的一种病毒,近二十年来,世界上出现了三种高传染性的冠状病毒,即SARS-CoV、MERS-CoV及SARS-CoV-2,此三种病毒主要引起肺炎和细支气管炎,严重者可出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),早期在CT上均以GGO为主要表现。
2.1.1.1 严重急性呼吸综合征(SARS) 2002年底,中国东南部的广东省开始出现不明原因肺炎,后被命名为SARS,于2003年在全球蔓延,引发成全球卫生紧急事件,感染数千人。SARS是由SARS-CoV引起的人畜共患病,SARS-CoV主要通过呼吸道和接触传播[5]。SARS的形成主要与病毒和细胞表面ACE受体结合有关[6]。潜伏2~10 d后,患者出现流感症状、呼吸困难、反复或持续发热,确诊依据SARS-CoV检测结果。SARS早期主要病理表现为急性肺泡损伤,可见肺泡出血和透明膜形成;晚期表现为弥漫性肺泡损伤和组织性肺泡渗出[7-8]。其胸片早期往往可以表现为正常,CT上病灶以肺下叶受累多见,尤其是后基底段,可见GGO改变,病变进展迅速,很快可进展成多灶性实变影[9],空洞、淋巴结肿大和胸腔积液不常见[10]。
2.1.1.2 中东呼吸综合征(MERS) 2012年在沙特阿拉伯首次发现MERS,MERS的病原体是MERS-CoV,为冠状病毒β属。MERS-CoV作用受体主要为二肽基肽酶4(DPP4,也称为CD26)受体,是一种多功能的细胞表面蛋白,广泛表达于肾、小肠、肝和前列腺的上皮细胞以及活化的白细胞上[6]。MERS临床表现主要为发热、咳嗽、呼吸困难,进展速度,较SARS更快,而且还可引起急性肾衰竭。组织病理学主要表现为坏死性肺炎,弥漫性肺泡损伤[11]。MERS-CoV肺炎在CT主要表现为胸膜下和基底段广泛的GGO和实变,空洞不常见[12]。
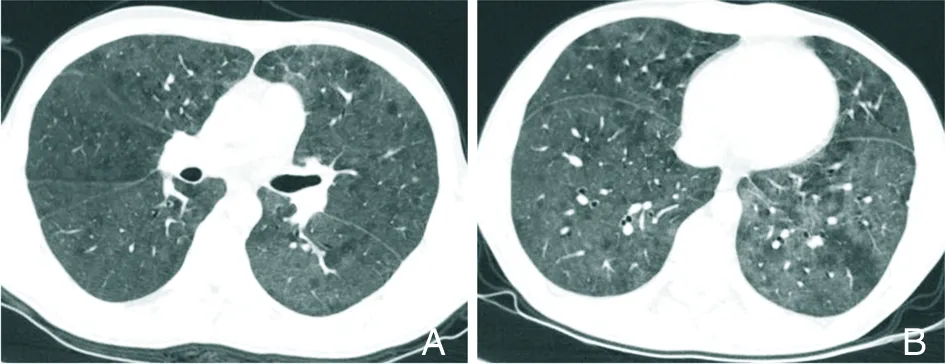
2.1.1.3 COVID-19 COVID-19的病原体为 SARS-CoV-2,属于冠状病毒β属,是已知的第7种能感染人的冠状病毒。潜伏期约1~14 d,平均3~7 d。主要表现为发热、咳嗽和肌痛或疲劳,主要并发症包括ARDS、RNA血症、急性心脏损伤和继发感染,并可存在无症状感染者[13]。COVID-19主要依据SARS-CoV-2核酸检测结果确诊。对COVID-19的病理研究较少,一例COVID-19患者组织学检查[14]显示,双肺出现弥漫性肺泡损伤和细胞纤维黏液样渗出物;右肺出现明显肺细胞脱屑和透明膜形成,左肺出现肺水肿和透明膜形成,显示ARDS的病理特征。COVID-19病理特征与SARS-CoV、MERS-CoV感染极为相似。COVID-19患者胸部CT表现呈动态演变过程[1,15-18]:病变早期主要为双肺单发或多发GGO,沿胸膜下及支气管血管束分布,以不规则形、扇形多见,通常不累及整个肺段,伴或不伴小叶间隔增厚(图1A~F);进展期病灶由单一病灶迅速由外周向中央扩展,病灶分布区域增多(图2A~F),可见GGO及实变影伴小叶间隔增厚,呈“铺路石”征,未受累的组织影像表现可正常;重症期病灶累及双肺,实变增多,可见“空气支气管”征伴条索灶,甚至可呈“白肺”改变。此外,胸腔积液及淋巴结肿大少见,绝大多数患者经过治疗,病灶范围缩小,密度减低,实变逐渐消失,部分残留条索灶。
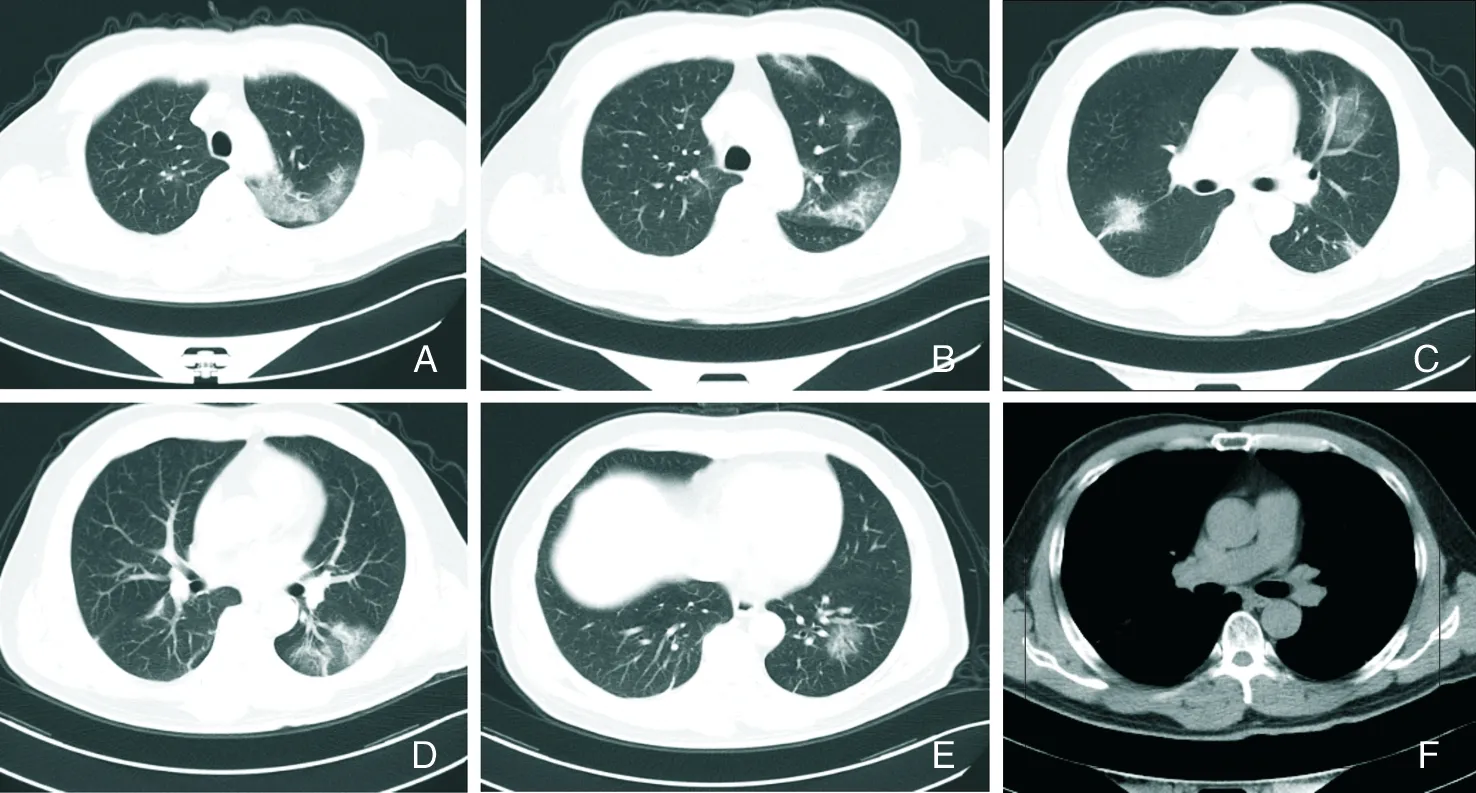
A~F:双肺胸膜下及沿支气管血管束可见多发GGO,呈扇形或不规则形,内可见血管增粗,伴小叶间隔增厚。
图1COVID-19患者早期胸部CT检查结果
Figure1Chest CT findings of patients with COVID-19 at early stage
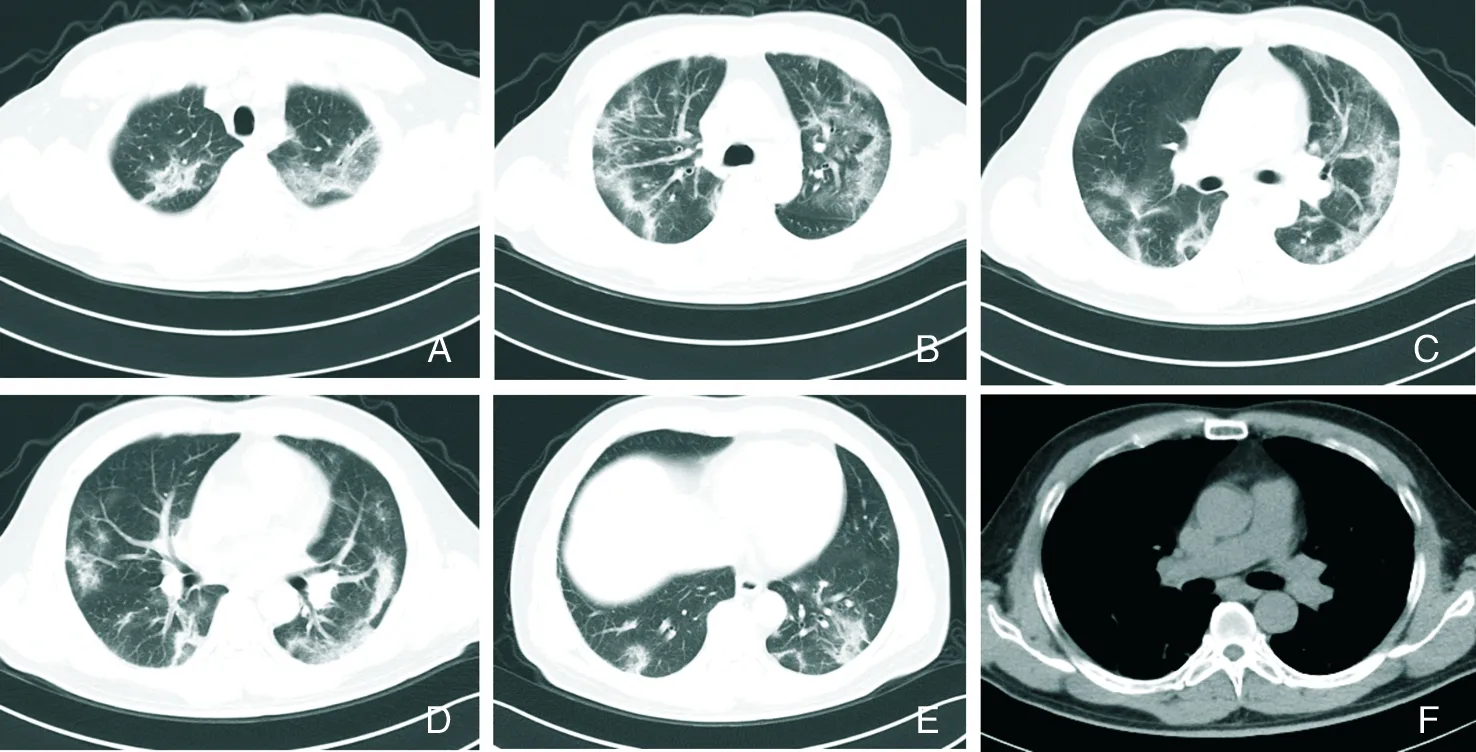
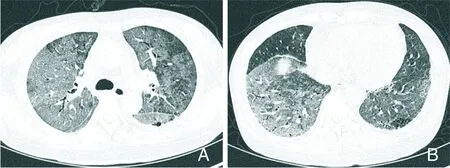
A~F:与图1为同一患者,3 d后复查CT,胸部CT显示,病变较3 d前明显进展,双肺GGO较前明显增大、增多,范围扩大,可见“铺路石”征,部分实变,内可见空气支气管征;纵隔淋巴结未见肿大,未见胸腔积液征,未受累肺组织密度正常。
图2COVID-19患者进展期胸部CT检查结果
Figure2Chest CT findings of patients with COVID-19 at progressive stage
冠状病毒科病毒感染具有相似的影像学特点[1],胸部CT演变过程具有相似的特点[19]:病变早期主要形态包括单发或多发边界模糊的类圆形GGO、小叶或小叶融合的GGO、小片状实变影周围可见GGO、大片状或肺段分布GGO,常沿胸膜下及支气管血管束分布,可见小叶间隔增厚,邻近支气管血管束增粗,实变影内可见空气支气管征;进展期病灶可由发病初期的单发、小片状病灶发展为大片状、多发或弥漫性病变,病变范围可由一个肺叶扩散到多个肺叶,由肺外周向中央扩展,磨玻璃密度影增高,转变为实变或GGO与实变影混合存在,病变处肺血管影进一步增多、增粗;重症期可快速进展为广泛或弥漫肺实变,以胸膜下及双下肺多见,甚至呈“白肺”,临床表现为ARDS;部分患者经治疗后病变可完全吸收。COVID-19与SARS的影像演变具有一定相似性,而MERS的影像变化往往较SARS的影像变化更迅速。
2.1.2 非冠状病毒科
2.1.2.1 腺病毒肺炎 人腺病毒是腺病毒科中无包膜双链DNA病毒。已知引起人类感染有7种物种(A~G),超过60种基因型[20]。腺病毒肺炎(Adenovirus pneumonia)主要表现包括发热、急性呼吸系统疾病、肠胃炎和结膜炎,好发于冬春季,在免疫缺陷患者和儿童中,可能导致呼吸衰竭、播散性感染、出血性膀胱炎、神经系统疾病,甚至死亡[20]。腺病毒可引起呼吸道上皮细胞溶解,并影响细支气管末端[21]。胸部CT表现为双肺弥漫或局限性GGO,伴或不伴实变[22](图3A~B)。
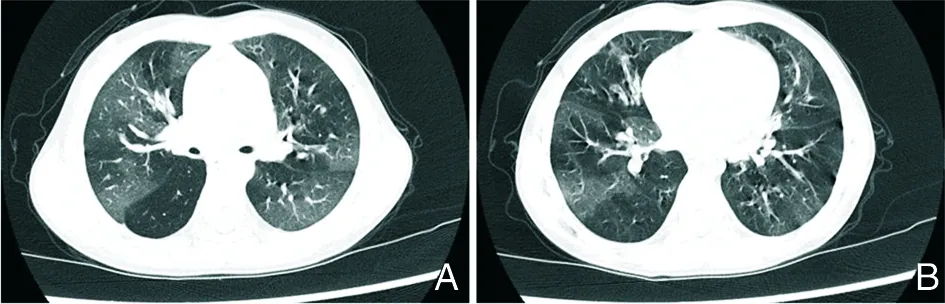
A~B:双肺弥漫性GGO,呈马赛克征,伴小气道炎症[23]。
图3腺病毒肺炎患者胸部CT检查结果
Figure3Chest CT findings of patients with adenovirus pneumonia
2.1.2.2 单纯疱疹病毒肺炎 单纯疱疹病毒(Herpes simplex virus,HSV)为有包膜、双链DNA病毒,属于人疱疹病毒α亚家族的成员,主要通过接触传播。HSV有2种类型,其中1型通常侵犯口腔黏膜,2型通常侵犯生殖器黏膜。在大多数情况下,疱疹病毒肺炎是由于病毒的内源性再激活所致[24]。
HSV在气道和肺泡中都具导致细胞病变的作用。胸部CT表现为弥漫性、多灶性GGO为主型,弥漫性、多灶性支气管周围实变影为主型,或者两者混合存在[25]。胸腔积液很常见。
2.1.2.3 水痘-带状疱疹病毒肺炎 水痘-带状疱疹病毒(Varicella-zoster virus,VZV)也是属于人疱疹病毒α亚家族的成员,人是水痘-带状疱疹病毒的唯一自然宿主,皮肤上皮细胞是主要靶细胞。VZV主要通过空气传播和接触传播。VZV常引起两种不同临床表现的疾病:原发性感染导致水痘,是一种普遍且极具传染性的急性感染,主要发生在学龄前和学龄儿童,其特征是全身性呈向心性分布水疱疹。像其他α-疱疹病毒一样,VZV在原发感染后在神经组织中潜伏,神经根潜伏的VZV重新激活会导致带状疱疹。带状疱疹是一种局部皮肤皮疹,伴有神经痛,最常见于老年人。VZV在儿童感染时常为自限性疾病,但在成年人感染时,往往会引起严重并发症,如水痘带状疱疹病毒肺炎。水痘-带状疱疹病毒肺炎主要组织学特征是弥漫性肺泡损伤。胸部高分辨率CT显示,双肺散在多发边界模糊的小叶中央结节,直径通常为5~10 mm,伴周围GGO浸润[26]。吸收后易遗留支气管扩张(图4A~C)。VZV与HSV同属于α疱疹病毒,影像表现上结节在VZV感染中更常见,“铺路石”征在HSV感染中更为常见[27]。
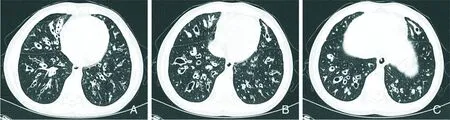
A~C:患者原有水痘-带状疱疹病毒肺炎合并感染,病灶吸收后,遗留多发支气管扩张,部分管壁增厚,管腔内充填黏液栓[23]。
图4水痘-带状疱疹病毒肺炎患者胸部高分辨率CT检查结果
Figure4Chest high-resolution CT findings of patients with varicella-zoster virus pneumonia
2.1.2.4 巨细胞病毒肺炎 巨细胞病毒(Cytomegalovirus,CMV)属于β疱疹病毒组的DNA病毒。CMV在人群中感染非常广泛,通常在免疫功能正常的患者中引起无症状感染或轻度流感样症状。在免疫功能异常时,因潜伏病毒的激活或输注CMV血清反应阳性的骨髓或血液制品,可引起危及患者生命的肺部感染[28]。宿主因素可以影响CMV感染的病理生理[29],在接受移植的患者中,病毒感染可引发T细胞介导免疫反应,从而导致严重的坏死性肺炎;在免疫缺陷严重的艾滋病(AIDS)患者中,因免疫反应缺乏,可以导致更严重的弥漫性的肺泡损伤。CMV常引起双肺广泛、弥漫性的间质性病变,肺间质病变以GGO、小叶间隔增厚等为主要表现(图5A~B),可伴气腔实变及小叶中央结节,局灶性病变少见,偶尔可出现胸腔积液[29]。如发生肺实变常提示合并真菌或细菌感染。
A~B:双肺弥漫性GGO,局部显示马赛克灌注[23]。
图5巨细胞病毒肺炎患者胸部CT检查结果
Figure5Chest CT findings of patients with cytomegalo-virus pneumonia
2.1.2.5 麻疹病毒肺炎 麻疹病毒属副黏病毒,人是唯一自然储存宿主。急性期患者为主要传染源,通过飞沫传播或密切接触传播。通常在皮疹发生前、后4 d具有传染性,潜伏期为10~14 d。麻疹病毒感染主要表现为发热伴咳嗽、鼻炎、结膜炎和皮肤斑丘疹,在皮疹前1~2 d口腔可见特征性黏膜白斑[30]。麻疹病毒感染会影响包括呼吸系统在内的多个系统,肺炎是最致命的并发症之一,常见于幼儿、20岁以上的成年人、孕妇以及免疫力低下或营养不良者,尤其是维生素A缺乏症的儿童[31]。麻疹肺炎可以是继发性感染引起的,也可能是麻疹病毒本身导致的麻疹巨细胞肺炎;在组织上,前者主要为化脓性炎症,后者主要为上皮细胞增生和弥漫性肺泡损伤。麻疹病毒肺炎CT主要表现为GGO(图6A~B)、小叶中央结节、小叶间隔增厚及呈肺叶或段分布的实变影,可见肺门淋巴结肿大和胸腔积液[29]。病灶吸收后易遗留支气管扩张。
A~B:双肺弥漫性GGO,边界模糊,右下肺胸膜下可见少许实变影[23]。
图6麻疹病毒肺炎患者胸部CT检查结果
Figure6Chest CT findings of patients with measles pneumonia
2.1.2.6 流感病毒肺炎 流感病毒属于正黏病毒科,主要包括人流感病毒和动物流感病毒。人流感病毒包括甲、乙、丙三型,是引起流行性感冒的病原体。患者是主要传染源,经呼吸道传播,一般潜伏期1~4 d。患者感染后出现寒战、发热、头痛、肌肉酸痛、咳嗽等非特异性症状。进入人体的病毒可感染呼吸道上皮细胞,使细胞产生空泡、变性,呼吸道黏液层的黏度降低,细胞表面受体暴露,有助于病毒的吸附,同时含病毒的液体可下行播散至下呼吸道,在短期内出现呼吸道细胞受损,流感病毒肺炎往往容易继发严重的肺部感染。其所致肺炎主要病理改变为弥漫性肺泡损伤[32]。影像上表现为斑片状、节段性、大片状GGO、实变影(图7A~C),合并感染后可出现大叶性实变、小脓肿和胸腔积液等。
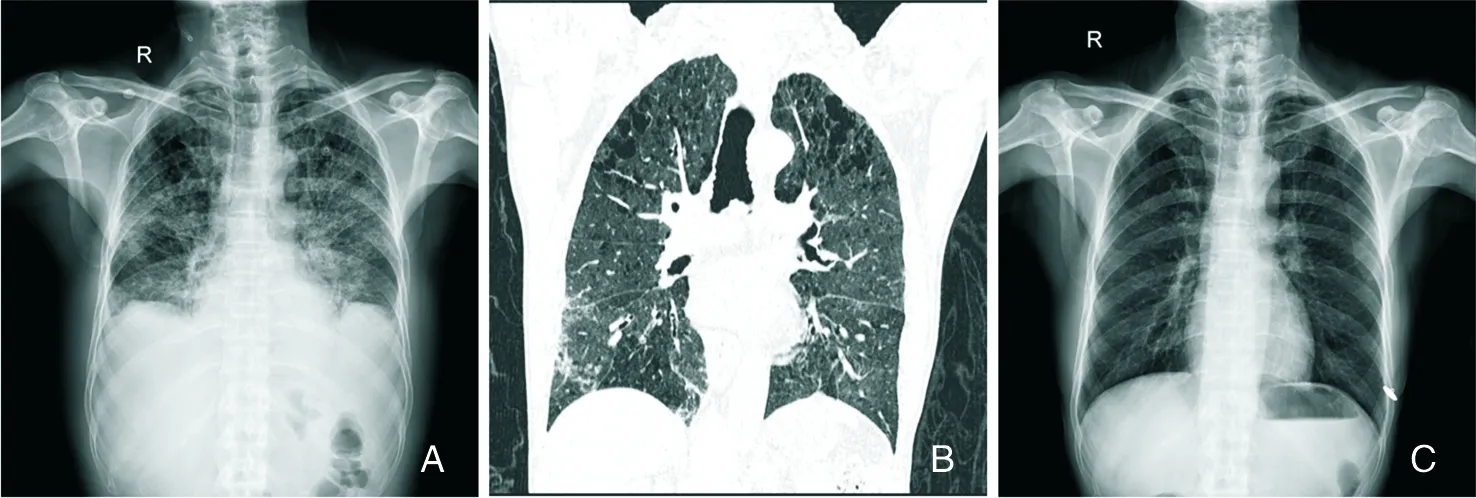
A:第一次胸部正位片显示,两肺透亮度不同程度减低,肺纹理模糊不清,大片GGO伴小片状实变密度增高影,边缘模糊不清,双侧弥漫性分布;B:7 d后复查胸部CT显示,支气管血管束呈条索、网格状影,边缘显示大片状GGO,右下肺胸膜下片状实变;C:14 d后复查胸部正位片显示,病变基本吸收[23]。
图7流感病毒肺炎患者胸部X线及CT检查结果
Figure7Chest x-ray and CT findings of patients with influenza virus pneumonia
2.1.2.7 呼吸道合胞病毒肺炎 呼吸道合胞病毒(respiratory syncytial virus,RSV)感染可发生在所有年龄段,导致细支气管炎、肺炎和哮喘。早产儿,幼儿和免疫功能低下的人感染容易导致严重的呼吸道合胞病毒肺炎,甚至死亡[33]。呼吸道合胞病毒肺炎的CT主要表现以气道为中心分布,可见小叶中心结节、GGO、气腔实变,伴有树芽征和细支气管壁增厚[34]。
2.2 其他病原体所致肺炎
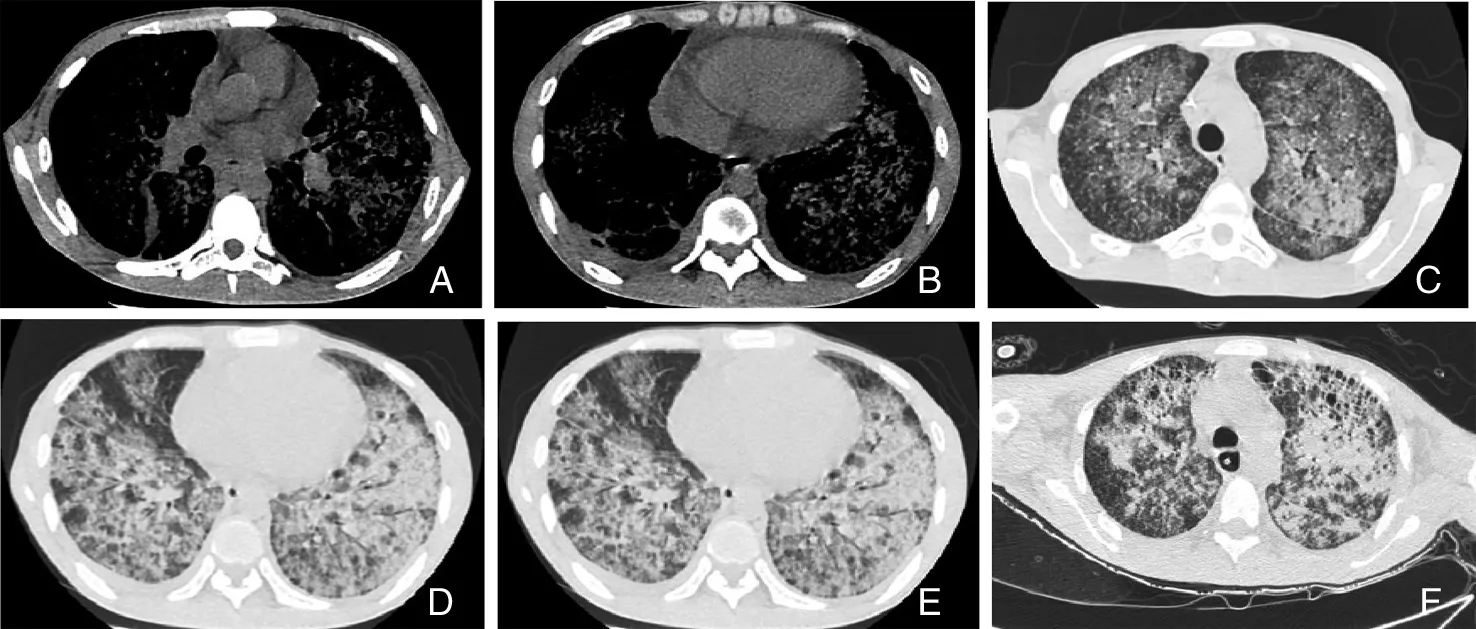
2.2.1 鲍曼不动杆菌肺炎 鲍曼不动杆菌是一种广泛分布于医院环境的条件致病菌,所致肺炎与住院时间长、接受机械通气以及严重基础疾病等因素相关[35]。鲍曼不动杆菌可引起全身感染,但最常见为肺部感染和血流感染[36]。最常见的3种影像学表现为弥漫GGO改变、肺实变、胸腔积液[37](图8A~D)。鲍曼不动杆菌肺炎合并其他病原体感染时,实变范围更大,胸腔积液发生率更高,可显示为脓肿及空洞。
2.2.2 克雷伯菌肺炎 克雷伯菌属属于革兰阴性需氧杆菌,存在于人类皮肤、喉部、胃肠道和泌尿道,是肠道中的正常菌群。克雷伯菌肺炎通常在患慢性肺病的老年患者或酗酒者中多见。临床上往往起病急,病情严重,典型痰液常呈黏稠脓性,带血,黏液样或胶冻状,灰绿色或砖红色,该病并发症发生率和病死率高[38]。病灶最常见于右上叶[39]。影像学上表现呈多样性(图9A~F),最常见表现为GGO(100%),其次为实变(91.3%)、网状影(85.0%)和支气管壁增厚(26.3%),以双肺、外周多见;并发其他病原体感染时,小叶中心结节、支气管壁增厚、支气管扩张、空洞、胸腔积液等CT表现发生率明显增高[38]。实变者可引起大叶性肺炎,伴有空气支气管征,受累肺叶由于凝胶样黏稠痰液充填引起叶间裂膨出,邻近肺叶显示压迫性节段性肺不张。克雷伯菌肺炎早期可形成肺脓肿,显示为多发小空洞,空洞大小一般不超过2 cm,多无气液平面,内壁光滑。
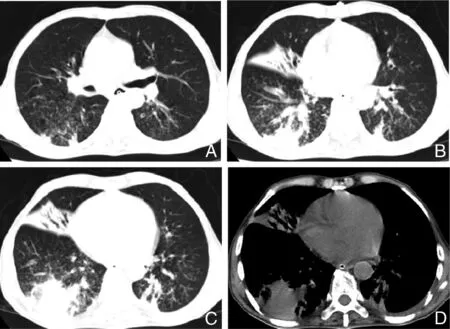
A~D:双肺支气管管壁增厚,边缘模糊,双肺GGO渗出影,右中肺、右下肺基底段及左下肺后基底段实变,未见脓肿形成,双侧少量胸腔积液[23]。
图8鲍曼不动杆菌肺炎患者胸部CT检查结果
Figure8Chest CT findings of patients withAcinetobacterbaumanniipneumonia
A~E:双肺多发片状GGO及实变,边界模糊,部分融合,右侧胸腔积液,部分进入斜裂,心包积液,隆突下(7组)淋巴结大;F:1周后复查病变较前进展,密度增高,实变形成,多发小脓肿形成[23]。
图9克雷伯菌肺炎患者胸部CT检查结果
Figure9Chest CT findings of patients withKlebsiellapneumonia
2.2.3 军团菌肺炎 军团菌属于革兰阴性需氧菌,广泛存在于水和土壤中,病原体(或军团菌)经供水系统、溶洞或雾化吸入进入细支气管和肺泡,造成肺部炎症。军团菌至少有50种属和70个血清型,最常见的人类致病菌为嗜肺军团菌。患者常感觉短暂不适,骤起高热,可高达40°C以上,常伴寒战和间歇干咳。军团菌肺炎的胸部CT表现复杂多样,可分为3种不同的模式[40]:肺叶实变,小叶实变合并GGO和纯GGO(图10A~D),实变常发生在免疫功能低下患者。最常见的影像学表现为呈肺叶或肺段分布实变与GGO,早期累及一侧肺,与急性肺炎链球菌肺炎类似,病变始于肺外周,迅速进展累及整个肺叶或呈多叶性肺炎,以下肺多见。部分患者可出现空洞或脓肿,空洞形成快、闭合慢。
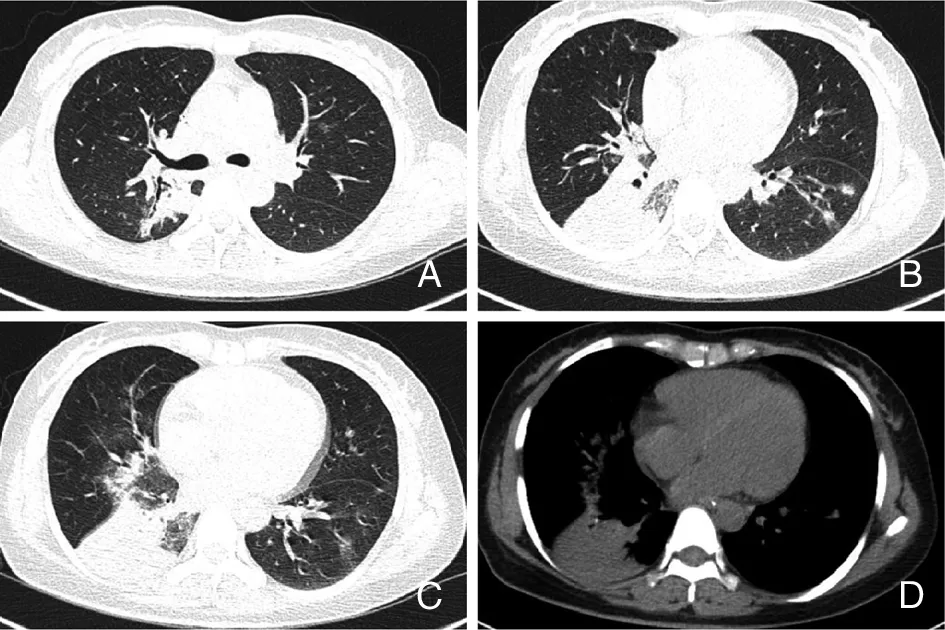
A~D:右下叶实变,病变累及右中叶,右中叶显示支气管血管束增粗,边缘模糊呈GGO,沿支气管血管束分布的渗出影,左下叶基底段小片状渗出灶,双肺病灶内未见脓肿及空洞,未见胸腔积液[23]。
图10军团菌肺炎患者胸部CT检查结果
Figure10Chest CT findings of patients withLegionellapneumonia
2.2.4 支原体肺炎 肺炎支原体感染是社区获得性肺炎的最常见病因之一,多见于学龄前及学龄期儿童,起病缓慢,症状轻重不一,最常见的症状有发热、刺激性干嗽、肌肉酸痛、胃肠道症状等非特异性表现。肺炎支原体感染以隐匿感染或轻症感染多见,症状严重程度随着病原体负荷的增加而增加,发病与气候变化密切相关,尤其在夏季,随着气温及湿度的增高,发病率明显上升;有支气管哮喘及慢性阻塞性肺疾病(COPD)病史是支原体肺炎的危险因素。支原体肺炎病理影像特征为[41]:(1)以单核细胞浸润为特征的支气管周围炎和血管周围炎,在CT上表现为支气管血管束增粗,此表现最常见;(2)小气道细胞性支气管炎伴管腔渗出物或肉芽组织,CT表现为小叶中心结节;(3)肺泡腔内的中性粒细胞和渗出物,在放射学上表现为气腔实变或GGO。支原体感染常导致肺间质炎症(图11A~B),CT可见沿支气管血管束分布为主的气腔实变及GGO,呈自肺门向肺野外围伸展的大片扇形阴影,部分患者可出现胸腔积液、肺气肿、肺不张等继发改变,重症患者可出现混合感染。症状与体征不平行,影像学和体征表现也不平行,影像学表现明显而体征轻,是本病特征之一。
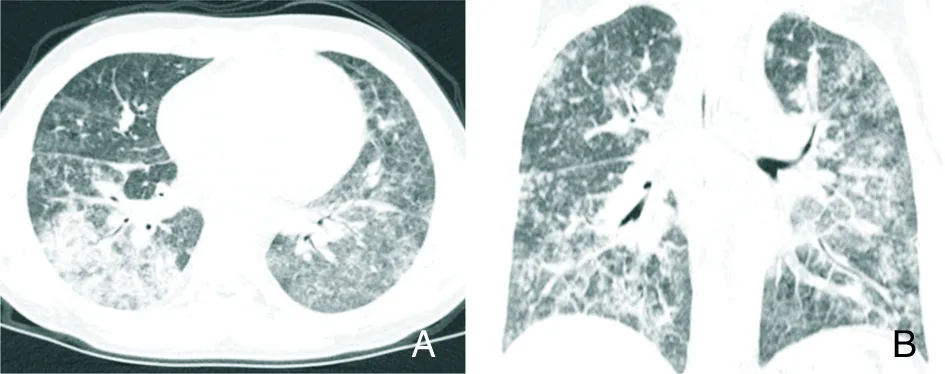
A~B:支气管血管束增粗,双肺多发GGO,部分实变,显示小叶中心结节,部分呈“树芽征”改变,伴小叶间隔增厚[23]。
图11支原体肺炎患者胸部CT检查结果
Figure11Chest CT findings of patients withMycoplasmapneumonia
2.2.5 卡氏肺孢子菌肺炎 卡氏肺孢子菌肺炎(Pneumocystis carinii pneumonia,PCP),主要引起肺间质性浆细胞性肺炎,在AIDS或其他免疫低下患者中多见。主要影像表现包括GGO、实变、结节、囊肿和网格样改变,最常见的影像表现是广泛的斑片状或地图样分布GGO(图12A~D),多见于肺尖和中央区,结节和空洞病变不常见[42]。
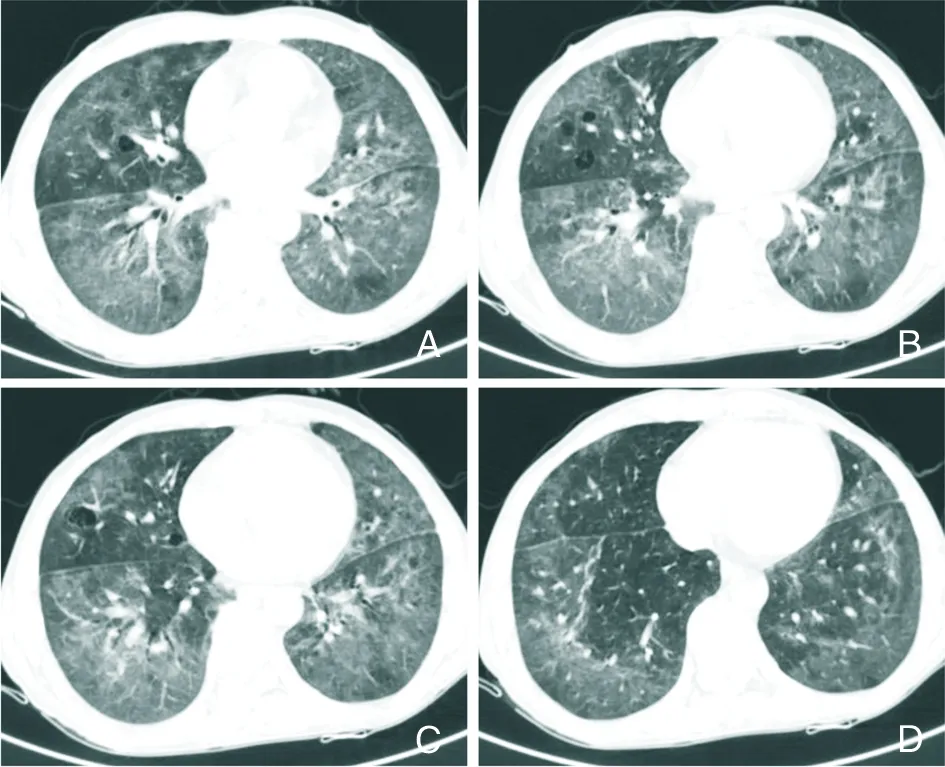
A~D:肺部GGO伴多发小囊肿。
Figure12Chest CT findings of patients withPneumocystiscariniipneumonia
3 小结
在COVID-19疫情期间,在胸部CT上表现为GGO的新型冠状病毒肺炎,需与其他表现为GGO的肺部感染性病变鉴别,尽管仅靠影像学无法实现明确的诊断,但是CT的特征和演变模式与感染病原体有关,如病毒性肺炎中同属于冠状病毒科的SARS-CoV、MERS-CoV与SARS-CoV-2,同属于疱疹病毒科的HSV、VZV、CMV,他们的影像学演变模式具有一定的相似性,同时结合临床特征,有助于对不同疾病进行早期诊断。

