提高氨基酸在猪生长中利用效率的研究
■Paul J. Moughan
(新西兰梅西大学里德学院,Private Bag 11-222, Palmerston North 4412,新西兰)
在过去的几十年中,商业条件下饲养的猪只在生长率和饲料转化率方面取得了相当大的进步,然而,如果人们考究机体蛋白质沉积的基本的潜在效率,那么其效率改善就不那么明显了。例如,Millet等(2017)计算了饲养在当代生产体系中生长猪对日粮蛋白质的利用率(N 沉积/N 摄入×100%),只有45%,而Dourmad 等(1999)的报道更低,只有35%。这意味着饲料中每摄入100 个单位的蛋白质,60 个单位的蛋白质被排出体外进入环境中,只有40 个单位在体内沉积,利用率相当低,对猪生产效益和环境污染两方面均产生负面影响,这在高密度养猪区域尤为明显。
造成利用率低下的部分原因可能是与日粮中的氨基酸不平衡有关(相比与第一限制性氨基酸,日粮中的必需和非必需氨基酸过多),考虑到猪日粮通常是利用线性规划进行配制的,可能在经济上更加合理。那么关于第一限制性氨基酸(通常为赖氨酸)的利用率问题,如何消除氨基酸不平衡带来的影响呢?生长猪赖氨酸(第一限制性氨基酸)利用率的预测值为40%~60%(Moughan,2018),这个预测值是高估了,通常超过50%的摄入赖氨酸不能用于机体蛋白质沉积。此外,赖氨酸的利用率在个体、日粮、性别和品种间差异较大,这些差异表明日粮氨基酸利用率的改善涉及的范围很广。
类似这样的数据更加突出了深入理解生长过程中导致机体氨基酸损失的基本生理和代谢过程的重要性。图1 展示的是导致机体蛋白质和脂肪沉积的代谢转化图。
生长动物利用摄入氨基酸(AAs)过程的基本框架(全身的体蛋白沉积利用率)为:粪便中排出的未吸收氨基酸;体被氨基酸损失;肠道内源性氨基酸损失;机体蛋白质转化;非蛋白含氮复合物的合成(如作为血清素前体的色氨酸);氨基酸不可逆变化(如组氨酸甲基化、赖氨酸甲基化、羟基化);尿中氨基酸损失;已吸收氨基酸不可避免代谢分解;添加的氨基酸超过机体蛋白质合成最大速率需要量时的分解代谢;氨基酸的优先分解代谢。
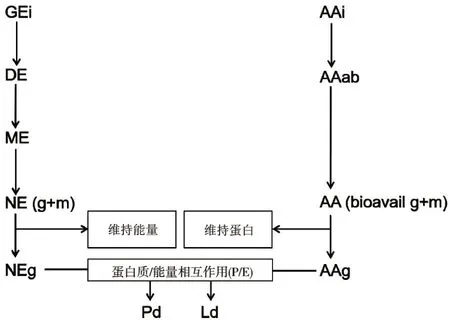
图1 日粮能量及第一限制性氨基酸在生长动物中的分配
从日粮氨基酸损失的来源上看,对于生长猪而言,与用于合成“其它”成分中的氨基酸损失、不可逆修饰中的损伤以及以游离氨基酸、小肽和痕量蛋白形式直接在尿液中损失的氨基酸量相比,由皮肤和毛发所造成的氨基酸损失(体被损失)从数量上看是非常小的。有人觉得其余过程的相对数量也很重要,因此表1 中给出了根据电脑模拟代谢所得的猪在生长过程中赖氨酸损失的预测值。无论饲养水平如何,因未被消化以及对结构完整性造成伤害的氨基酸损失在很大程度上导致了氨基酸利用率低下,肠道内源性氨基酸损失以及第一限制性氨基酸的氧化损失(主要的不可避免的分解代谢)也是造成氨基酸利用率低下的原因。氨基酸用于动物能量补充(优先代谢)或以超过营养需要的高剂量日粮氨基酸在尿中的脱氨和排泄从数值上看很有意义,但它取决于动物品种和饲喂水平。根据图1讨论氨基酸转化和日粮能量分配。
1 摄入总能(GEi)到摄入净能(NEi)
动物日粮能量的摄入和利用对氨基酸的利用率有重要影响。日粮中蛋白质和能量存在相互作用(P/E相互作用,见图1),因为蛋白质的合成是一个消耗能量的过程,同时氨基酸又是能量来源。最简单的日粮能量水平称为总能(GE),该数值是指食物或食物成分在弹式量热器中燃烧时所释放的能量。各种能量损失会发生在消化(DE)、代谢(ME)以及生长维持过程(NE)中(Van Milgen 等,2018)。然而,正如图2所示,从GE到NE 的过程中,能量利用越来越依赖于动物(除日粮外)。总能(GE)主要与日粮的化学组成(高能键的种类和数量)有关,与动物无关,而净能(NE)不仅与日粮属性有关,还受动物特性的严重影响。以酪蛋白为例,仅含有1 g氨基酸的酪蛋白可能完全沉积为体蛋白,在这种情况下,酪蛋白的NE与GE相等(5.5 kcal/g)。或者,如果日粮非蛋白能量有限或作为蛋白摄入的酪蛋白量大于机体最大蛋白质沉积量,那么酪蛋白中的氨基酸将会被完全氧化以提供能量,效率约为50%,那么酪氨酸此时的NE就只有2.8 kcal/g。这个简单的例子说明NE虽然更接近代谢过程中日粮的“可利用”能量,但可受动物特性和代谢状态的严重影响。动物每日的NE供给相比于每日可利用氨基酸的供给是决定动物是否需要分解氨基酸以作为能量(ATP)供给(氨基酸的优先分解代谢)的一个重要指标。
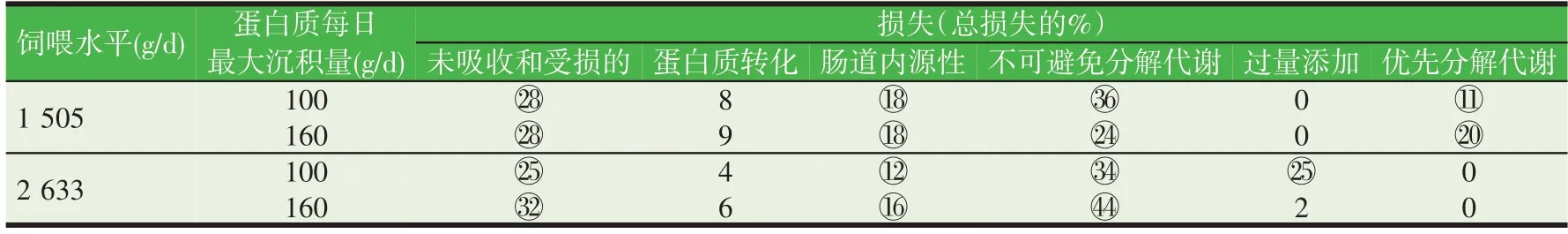
表1 两种商业日粮水平和两个最大蛋白质沉积率(Pdmax,基因型)下50 kg活体重生长猪的日粮赖氨酸损失率
确定NE较机械但更普遍且更准确的方法是模拟各种能量物质的肠道摄入(如葡萄糖、甘油、脂肪酸、氨基酸、挥发性脂肪酸),及模拟这些物质在不同条件下和不同品种猪中的分解代谢——用以提供ATP(Birkett等,2001a;Birkett等,2001b;Van Milgen,2002;van Milgen等,2003;Coles等,2013)。不同营养物质以不同的生化效率进行分解代谢,且不同的生化利用率也与营养物质的代谢产物有关。
前肠段(嘴到回肠)所吸收营养物质的NE∶DE比值与后肠段相比存在显著差异(Coles等,2010)。预测ATP 消耗和获取的方法(利用猪生长模拟模型)考虑了经验DE、ME和NE系统中动物相关因素的影响。
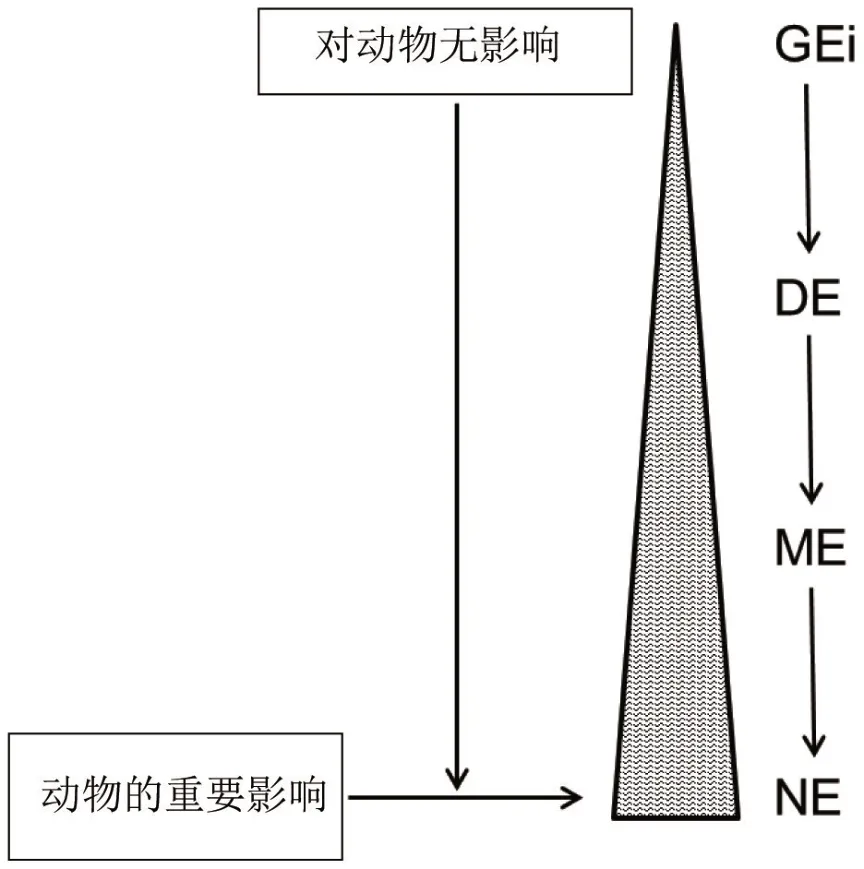
图2 动物相关因素对总能(GE)到净能(NE)过程中“可用”能量的渐进式影响(Moughan,2018b)
2 摄入的第一限制性氨基酸(AAi)到被吸收的第一限制性氨基酸(AAab)
消化道中未消化氨基酸的损失量相当大,特别是消化性能差的饲料,导致了摄入的第一限制性氨基酸利用率低。饲料原料的认真选择、饲料生产工艺的优化以及外源酶的使用均能改善蛋白质消化率。目前确定猪营养中氨基酸消化率的常规做法是通过收集回肠食糜而非粪便。粪便中氨基酸消化率在预测肠道中氨基酸摄入时具有一定的误导性(Fuller 等,2005;Hendriks 等,2012),真 回 肠 氨 基 酸 消 化 率(Moughan 等,2013)是确定氨基酸吸收的准确方法(Moughan,2003),且有公认的方法用于确定回肠内源氨基酸成分,“标准消化率”取代了以前的“真消化率”这个概念(Stein 等,2007)。在蛋白质消化率的传统测定中忽略了消化过程中生物活性肽的产生,在消化过程中产生的存在于消化腔中的日粮肽种类很多,相对含量较少,但其具有重要的生理学效力,这些肽通常不能被消化,但可被少量吸收(Miner-Williams 等,2014),可与消化道中的黏膜细胞作用,潜在地影响生理学功能(Rutherfurd-Markwick 等,2005)。一些研究人员(Teschemacher, 2003)认为食物消化过程中产生的复杂的生物活性肽是动物调节系统的核心部分,如果真是这样的话,那么动物采食蛋白质种类和数量的日常变化都会干扰其控制过程。这个难题的答案可能是(Moughan等, 2014):含有蛋白质和小肽的日粮组分可引起大量内源性(机体来源)蛋白质涌入胃肠道管腔中,而这些内源性蛋白质可自身消化并释放潜在的生物活性肽(Dave等,2016a;Dave等,2016b)。
此外还需要考虑的是消化系数可以表示消化过程中从日粮中吸收的氨基酸总量,但没有提供关于氨基酸吸收动力学的任何信息。各种类型氨基酸到达蛋白质合成位点的时间非常重要,因为蛋白质合成是一个“全或无”的过程。同样重要的是氨基酸到达蛋白质合成位点时间和非蛋白质能量来源的同步性(Van der Borne等,2007)。养分吸收动力学可潜在影响蛋白质和能量的相互作用(P/E),从而影响到蛋白质的合成效率。
3 被吸收的氨基酸(AAab)到用于生长+维持的氨基酸,适合蛋白质合成的氨基酸吸收量,该合成蛋白质用于生长和维持需要
在饲料原料加工的情况下,一些氨基酸可能会与其它成分发生反应,比如使氨基酸结构发生改变,这对赖氨酸尤其重要,对其它氨基酸如蛋氨酸、半胱氨酸和色氨酸(Rutherfurd等,2012)也有重要的实际意义。对于受损的赖氨酸而言,标准化回肠赖氨酸消化率用于评估赖氨酸摄入依然是合适的方法,但传统的化学分析法则不合适。另外,日粮蛋白质在酸解前需要与合适的试剂(如邻甲基异脲)进行反应以保证赖氨酸分子(成为活性赖氨酸)不被破坏从而能被检测出,同时确保活性赖氨酸的回肠消化率(Moughan 等,1996;Moughan,2005)。蛋白质在制备猪配合料过程中经常发生氨基酸结构变化的情况,并且传统检测的回肠赖氨酸消化率与活性赖氨酸(常被称为可利用赖氨酸,因为这是代表适合进行蛋白质合成的赖氨酸结构状态)真回肠消化率间的差异可能相当大,见表2。
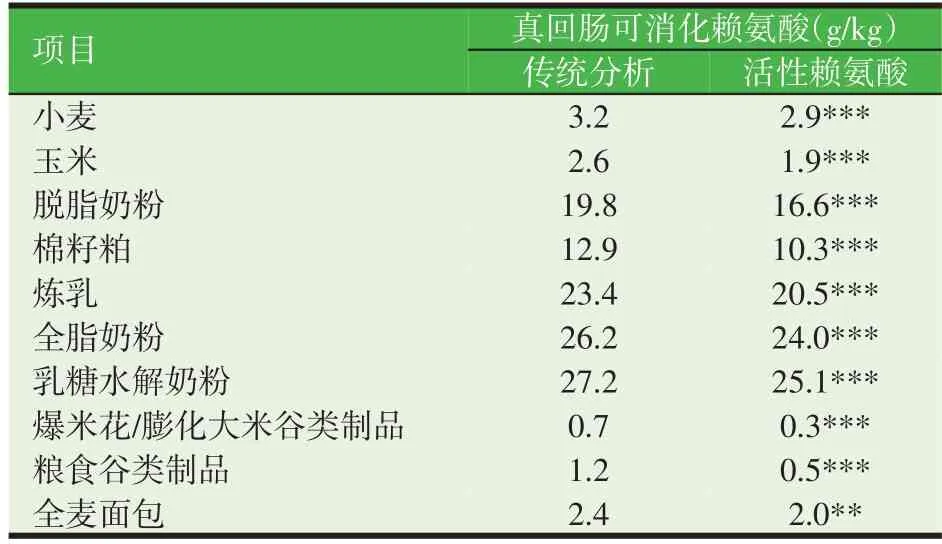
表2 一些加工后饲料中平均真回肠可消化赖氨酸和真回肠可消化活性赖氨酸的比较
4 氨基酸(生长+维持)到用于生长氨基酸(AAg)
被吸收且结构未发生变化的氨基酸用以满足蛋白质维持等需要,而剩余氨基酸可用于生产过程中的新蛋白质合成。用于生长的氨基酸与第一限制性氨基酸的供给有关,那些超过第一限制性氨基酸量过量添加的氨基酸会被分解并在尿中排出。正如前文所讨论的,在生长维持中导致氨基酸在数量上损失最大的两个代谢过程是肠道内源性氨基酸损失和吸收氨基酸不可避免的分解代谢,之所以不可避免是因为在氨基酸的吸收和转运到蛋白质合成位点的过程中存在氨基酸分解代谢,并非能量需要的原因,而是分解代谢酶总是保持一定的活性。以机体肠道内源性氨基酸和菌体非日粮氨基酸形式损失的氨基酸具有数量显著性。相当一部分自身蛋白质在上消化道中不能被消化并进入结肠,且大部分的蛋白质在此可被常驻微生物群所分解。除了肠道的这种内源性蛋白质,大量的黏液细胞和上皮细胞可直接进入小肠且大部分也被微生物群分解。对于生长猪的肠道内源性氨基酸损失也有研究,损失与饲料中干物质采食呈线性相关,并受如日粮蛋白质含量、日粮纤维含量和抗营养因子(如凝集素、单宁)含量等因素影响。肠道内源性氨基酸损失反映了动物在蛋白质和能量代谢过程中的高代谢成本。
对于不同日粮成分(单独和一起)对肠道内源性氨基酸损失影响的定量性研究非常迫切,此外还需要开展如何通过遗传选择、日粮处理或利用益生元、益生菌或特定酶以促进消化过程中粘蛋白和菌体降解等方式以减少内源性氨基酸损失的工作。
对生长动物不可避免的分解代谢已有大量的研究,但对其因果机制仍然知之甚少。被机体吸收的第一限制性氨基酸因不可避免分解代谢造成的损失估计在25%~40%,已发表的文章称生长猪中赖氨酸由于不可避免分解代谢造成的损失估计为15%~30%。不可避免的分解代谢似乎受相对于最大蛋白质合成需要量的氨基酸摄入量影响,且因氨基酸不同而不同。特别是蛋氨酸和色氨酸,似乎比赖氨酸损失更多。氨基酸不可避免分解代谢的一部分无疑与肠上皮细胞“首过”代谢有关(Stoll等,1999),也与后吸收状态的代谢有关。与此相关的以下几方面尚待进一步了解和研究:氨基酸不可避免的分解代谢、被吸收后的氨基酸利用效率较低的主因、影响氨基酸氧化分解程度的遗传和营养因素。
5 用于生长氨基酸(AAg)到蛋白质沉积(Pd)
没被氧化的氨基酸首先不可避免地用于满足氨基酸维持需要,其余的则用于机体蛋白质合成。它将以第一限制性氨基酸需要量的最低比例存在于血浆中(维持需要后),且其浓度将和NE 一起限制机体新蛋白合成。蛋白质合成是个“全或无”的过程,某个时间点血浆中的氨基酸浓度将决定蛋白质的合成量。生长期间沉积的净蛋白量取决于蛋白质转化过程中蛋白质的合成量和降解量。净蛋白质沉积可通过提高蛋白质的合成率,降低蛋白质的降解量,或者两种同时进行。蛋白质合成的最大速率与伴随的蛋白质降解率之间的差异将决定每日体蛋白沉积的最大速率(Pdmax,Kielanowski,1969;Whittemore,1993)。吸收的平衡蛋白质量高于体蛋白质沉积的最大速率(Pdmax)所需量时,则氮会通过尿液流失。Pdmax通常是猪生长的重要制约因素,是遗传选择中的主要指标,它随猪的品种和品系的不同变化非常大,从<100 g/d的低值到现代选择>200 g/d的高值,其变化被认为与从出生到成熟的年龄或体重呈曲线模型关系(Emmans等,1999),但其在体重为20~90 kg 时通常处于恒定。在最佳繁殖中心条件下获得的Pdmax 在生长猪的实际情况中(可能存在类似于亚临床疾病以及温度等限制生长的因素)可能不适用,因此,“可操作性Pdmax”的概念被提出(Moughan等,1995)。
6 蛋白质/能量(P/E)相互作用
一般而言,如果到达蛋白质合成位点用于生长的吸收平衡蛋白质(AAg)的量低于Pdmax的量,AAg则会转化为蛋白质沉积(Pd)。但如果NE限制了所有体成分(蛋白质、必需脂质、糖原等)的合成,那么这一情况将不会发生,因此NE和AAg直接可能存在相互作用。氨基酸除了作为蛋白质结构单位的主要作用外,还可提供ATP(Munro,1964)。当氨基酸用于产生能量时(因为非氨基化合物供能有限),其分解代谢为氨基酸的优先分解代谢,而不是氨基酸的不可避免分解代谢,仔细进行日粮配制可避免氨基酸的优先分解代谢。当氨基酸的优先分解代谢发挥作用时,Pd依赖于能量(NE或ME),当能量需求得到满足时,Pd 依赖于AAg(Black 等,1986)。氨基酸的优先分解代谢在很大程度上反映了在蛋白质沉积过程中需要伴随有少量的脂质沉积,且其受性别等因素的影响,并且很可能受遗传控制。
7 结束语
猪日粮蛋白质的潜在利用率是相当低的,此外,可观察到不同动物个体间存在差异,这意味着通过遗传选择和日粮控制方式改善蛋白质利用率都有很大的空间。动物科学领域的进步最有可能通过应用科研资源来理解驱动氨基酸利用代谢过程的潜在因果机制而取得。揭开“因果关系”才能洞悉氨基酸代谢过程应该如何被调控才能提高其利用效率,这需要我们共同努力以提高对日粮蛋白质利用率的理解。只有根据生长发育的整体框架有计划地进行,这方面的研究进展才有可能最大化,进而取得突破性的进步。

