G蛋白偶联受体35在胃癌中的表达及其与预后的相关性
徐婷娟,沈国栋,程民,吴新春,胡世莲
[中国科学技术大学附属第一医院(安徽省立医院)老年医学研究所,肿瘤免疫与营养治疗安徽省重点实验室,合肥 230001]
胃癌是最常见的恶性肿瘤之一,具有较高的发病率及死亡率[1]。全球癌症状况最新数据显示2012年新增胃癌患者951 600例,因胃癌及其相关原因导致的死亡高达723 100人次[2-3]。近年来虽然内镜及治疗策略如手术切除和化疗取得了改进,然而胃癌在全球的平均五年生存期仍仅维持在40%[4]。因此,探寻胃癌新的分子标志物对于提高胃癌诊断的准确性、提供胃癌治疗的新靶点以及判断患者预后有着重要意义[5]。
G蛋白偶联受体(GPCR)是一个超级膜蛋白受体家族,目前有30%~40%的药物是将GPCR作为靶标[6]。1998年,G蛋白偶联受体35(GPR35)首次被发现在大鼠小肠中表达[7],随后的研究显示GPR35在胃肠道、中枢神经系统、心血管系统、肺脏、肝脏、脾脏等多种组织中均有表达[8-10]。由于在相当长时间里没有发现其内源性配体,GPR35一直被认为是孤儿受体。近年来随着内源性和合成配体的发现,GPR35在多种疾病中的潜在作用愈发显现[11-15]。有研究[16]报道,GPR35参与了小鼠胚胎成纤维细胞的转化,并且在胃癌组织中的表达上调,显著高于癌旁组织。GPR35及其配体趋化因子17相互作用后能促进乳腺癌细胞的增殖和迁移[17]。
鉴于GPR35在肿瘤进展中的作用,本文基于TCGA数据库、Oncomine数据库以及Kaplan-Meier Plotter数据库,挖掘分析GPR35在胃癌中的表达情况及其与患者预后的相关性,为深入研究GPR35在胃癌发生发展中的作用奠定基础,以期为胃癌提供新的治疗靶点。
1 材料与方法
1.1 TCGA数据库分析GPR35在胃癌组织中基因组水平的改变 采用cBioportal分析工具(http://www.cbioportal.org/)对肿瘤基因图谱(The Cancer Genome Atlas,TCGA,http://cancergenome.nih.gov/)数据库中GPR35基因改变频率进行分析。筛选条件如下:(1)在Select Studies中选择Stomach Adenocarcinoma;(2)在Select Genomic Profiles中选择Mutations和Copy number alteration;(3)输入目的基因GPR35;(4)Submit Query。
1.2 Oncomine数据库分析GPR35在胃癌组织中mRNA水平的改变 运用Oncomine数据库(http://www.oncomine.org/)分析GPR35 mRNA水平在不同病理类型的胃癌与正常胃黏膜表达的差异性。筛选条件如下:(1)输入目的基因GPR35;(2)在Primary Filters,Analysis Type中选择Cancer vs.Normal Analysis,在Cancer Type中选择Gastric Cancer;(3)在Dataset Filters,Data Type中选择mRNA;(4)在datasets选择Over-expression:Fold Change;(5)选择展示图形为箱式图。
1.3 Kaplan-Meier Plotter数据库分析 GPR35 mRNA表达水平与胃癌患者生存期的关系 利用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)的胃癌数据集进行在线生存分析。筛选条件如下:(1)选择gastric cancer数据库;(2)输入目的基因GPR35;(3)Survival选择OS;(4)Draw Kaplan-Meier plot。
1.4 统计学处理 应用SPSS 20.0软件包对胃癌组织中GPR35表达与临床病理特征的关系进行统计分析。观测数据中的计数资料,采用χ2检验。计量资料中,正态资料行t检验,偏态资料行秩检验。生存分析方法为Kaplan-Meier乘积限法,组间比较为Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 GPR35在胃癌中表达水平改变的分析
2.1.1 GPR35在胃癌组织中基因组水平改变的分析 采用cBioportal分析工具对TCGA数据库中GPR35的基因改变频率进行分析。结果发现:在胃癌中,GPR35的改变形式主要表现为缺失。在TCGA,Provisional数据集中(共393例胃癌患者),GPR35有3.30%的改变,其中有1.27%的突变(5/393)及2.03%的缺失(8/393);在TCGA,PanCancer Atlas数据集中(共434例胃癌患者),GPR35有2.99%的改变,其中有1.15%的突变(5/434)及1.84%(8/434)的缺失。
2.1.2 GPR35在胃癌组织中mRNA水平改变的分析 根据胃癌的发病机制和组织结构的不同,Lauren分型将胃癌分为肠型和弥漫型。本研究分析了Oncomine数据库中GPR35 mRNA水平在不同病理类型的胃癌与正常胃黏膜表达的差异性。结果发现(见图1),在DErrico数据集中,GPR35在肠型胃癌(26例)中的表达较正常胃黏膜(31例)升高1.446倍(P=0.003),在弥漫型胃癌(6例)的较正常胃黏膜(31例)升高1.468倍(P=0.028),在混合型胃癌(4例)较正常胃黏膜(31例)降低1.001倍(P=0.501);在Cho数据集中,GPR35在肠型胃癌(20例)中的表达较正常胃黏膜(19例)升高2.477倍(P=2.67×10-4),在弥漫型胃癌(6例)较正常胃黏膜(19例)升高2.015倍(P=8.91×10-4),在混合型胃癌(10例)较正常胃黏膜(19例)升高2.324倍(P=6.70×10-4)。

图1 应用Oncomine数据库分析GPR35在胃癌组织中mRNA水平的改变:A为DErrico胃癌数据集,B为Cho胃癌数据集
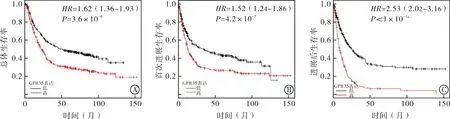
图2 Kaplan-Meier Plotter数据库分析不同时期GPR35与胃癌患者预后的相关性

表1 胃癌组织中GPR35的表达与患者临床病理特征的关系
2.2 胃癌组织中GPR35的表达水平与患者临床病理参数之间的关系 分析GPR35在胃癌组织中的表达水平与患者临床病理参数之间的关系(表1),结果显示,GPR35的表达与肿瘤的分化程度(χ2=25.060,P<0.001)、分期(χ2=7.039,P=0.008)、淋巴结转移(χ2=14.927,P<0.001)和远处转移(χ2=28.615,P<0.001)以及HER2表达与否(χ2=153.840,P<0.001)显著相关,而与患者性别、肿瘤浸润深度、lauren分型和治疗策略均无显著相关性(P>0.05)。
2.3 GPR35 mRNA表达水平与胃癌患者预后的关系 为了进一步明确GPR35 mRNA表达水平与胃癌患者预后之间的关系,通过Kaplan-Meier Plotter数据库分析发现:与GPR35低表达的胃癌患者相比,GPR35高表达的胃癌患者总生存期[HR=1.62 (1.36~1.93),P=3.6×10-8],首次进展[HR=1.52 (1.24~1.86),P=4.2×10-5]及进展后生存期[HR=2.53(2.02~3.16),P<1×10-16]均缩短,患者预后差(图2)。
3 讨论
众所周知,恶性肿瘤的远处转移是占肿瘤相关死亡90%以上的最致命的特点。同样,侵袭转移是胃癌最重要的特征[18]。胃癌的高复发率和高转移率所导致的远处器官或组织转移,患者往往预后不良,生存率低。胃癌常见的转移途径分为四大类:淋巴结转移、腹膜转移、血道转移和种植转移。其中淋巴结转移、腹膜转移是胃癌转移最常见形式。接近50%的胃癌转移是腹膜转移,胃癌腹膜转移患者生活质量较差且生存期短,通常中位生存期仅为3~4个月,即使切除原发肿瘤也仅能将中位生存期提高到9~10个月。尽管越来越多的证据显示化疗可提高转移性胃癌患者的生存期,但其预后仍然很差,中位总生存期约1年[19]。临床工作中对胃癌术前术后转移倾向的判断仍然存在很大的困难,因此,深入研究胃癌转移途径的关键分子尤为重要,对提高患者术后生存质量和生存率具有重要意义。
本研究发现Oncomine数据库中GPR35 mRNA在不同分型(肠型、弥漫型和混合型)胃癌中的表达显著高于正常胃黏膜,这与Okumura等[16]发现GPR35在胃癌组织中的表达显著高于癌旁组织的结果是一致的。但是在DErrico数据集中混合型胃癌组织的GPR35 mRNA表达较正常胃黏膜降低,差异无统计学意义(P=0.501),这可能与其临床样本量较小有关。本组进一步分析了GPR35在胃癌组织中的表达水平与患者临床病理之间的关系,发现GPR35的表达与肿瘤的分化程度、分期、淋巴结转移和远处转移显著相关,即恶性程度越高的患者GPR35的表达越高。尤为重要的是,本研究显示GPR35的表达与预后生存期之间具有显著的相关性,高表达GPR35的患者预后较差,提示,GPR35在胃癌中有可能作为临床预后判定指标。
本研究存在一定的不足之处。TCGA、Oncomine和Kaplan-Meier Plotter数据库提供的均为mRNA水平的数据,不能完全真实地代表GPR35在蛋白水平表达的实际情况,故在后续的研究中应结合免疫组织化学和Western blot技术在蛋白表达水平上分析验证GPR35在胃癌侵袭转移中的作用及相关机制,以期为胃癌治疗提供新的靶标。

