山楂黄酮对BRL-3A肝细胞DNA损伤的修复作用及其机制
张营霞 王京龙 马 晶 卓丽玲 康美玲 田忠景 丁诚实*
(1 枣庄学院食品与制药工程学院 山东枣庄277160 2 枣庄学院生命科学学院 山东枣庄277160)
山楂(Crataegus pinnatifida Bunge),蔷薇科山楂属,又名山里红,山里果、酸枣、山里红果、酸里红、红果。在我国山东、河南、安徽、山西、江苏、浙江、吉林、陕西等多个省份均有分布。核果类水果,果肉薄,核质硬,味微酸涩。果可生吃或制作成糕点,亦可入药,具有降血压、降血脂、强心、抗心律不齐等作用,同时也是健脾开胃、消食化滞、活血化痰的良药[1-3]。到目前为止,在山楂中发现并分离得到的物质主要有黄酮类、纤维素、鞣制、黄烷及其聚合物类、有机酸类、甾体和三萜等,其中以黄酮类为其主要活性成分[4-6]。
最新研究表明,DNA 损伤(断裂或突变)能够使细胞包括干细胞发生染色体重排,从而永久性地改变它们的DNA 序列,导致永久性的遗传损伤,其结果为细胞死亡或癌变,而酒精是诱发细胞DNA 发生损伤的重要因素[7-8]。肝细胞是易受酒精损伤的细胞,酒精性肝病(alcoholic liver disease,ALD)是由于长期大量饮酒导致的肝细胞受损疾病,是导致肝硬化的最主要病因,也是十大常见死因之一[9]。近年来,国内外对酒精性肝病的研究越来越深入,已发现中草药活性成分黄酮具有较强的抗菌、消炎、抗肿瘤等多种药理作用,能保护肝细胞,减轻肝细胞的损伤,提高肝细胞的活性功能,而黄酮对酒精诱发细胞DNA 损伤的影响及其机制研究较少[10-12]。
本文采用不同浓度的山楂黄酮作用乙醇损伤的BRL-3A 肝细胞,MTT 法检测山楂黄酮对乙醇损伤肝细胞存活的影响;单细胞凝胶电泳分析细胞DNA 的损伤程度并计算尾距;试剂盒检测细胞内超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-Px)等生理生化指标;实时定量PCR 检测基因SOD 的表达变化。本研究为山楂黄酮的医药学应用和肝病防治提供了一定的理论基础。
1 材料与方法
1.1 材料与试剂
大鼠肝细胞BRL-3A,扬州大学生命科学学院惠赠。
主要试剂:山楂黄酮(自提并纯化,纯度>95%);DMEM 培养基、胎牛血清,美国Gibco 公司;胰蛋白酶,美国Hyclone 公司;PBS,碧云天生物科技;DMSO,北京索莱宝科技;噻唑蓝,Amresco公司;SOD、MDA、GSH-Px 检测试剂盒,南京建成生物工程;RevertAid First strain cDNA Synthesis kit (#K1622),美国Fermantas 公司;SYBR Green I,美国Applied Biosystems 公司;细胞培养瓶、96孔板,美国Corning 公司;其它试剂均为国产分析纯。
1.2 仪器与设备
荧光倒置显微镜,日本Olympus 公司;3-30K高速冷冻离心机,德国Sigma 公司;LC 480II 实时荧光定量PCR 系统,瑞士Roche 公司;371 型CO2培养箱、NanoDrop One 微量核酸蛋白定量仪、Multiskan Go 智能酶标仪,美国Thermo 公司;超净工作台,苏州净化。
1.3 试验方法
1.3.1 山楂黄酮对BRL-3A 细胞存活率的影响取冻存的BRL-3A 肝细胞迅速放入37 ℃水浴中解冻,1 000 r/min,离心5 min,弃上清,以含10%胎牛血清的DMEM 培养液悬浮细胞,计数并调整细胞密度至1×105个/mL,将细胞悬液接种到细胞培养瓶中,培养条件为37 ℃、5% CO2。当细胞生长至80%汇合后,用胰蛋白酶消化细胞,离心后,用含血清的DMEM 培养液悬浮细胞,并调整细胞密度至5×104个/mL,作为单细胞悬液,备用。取制备好的单细胞悬液,接种到96 孔板,贴壁培养24 h 后,每孔加入不同浓度的山楂黄酮储液,使其终质量浓度分别为0.1,1,10 和100 mg/mL,并设不添加山楂黄酮的空白对照组,以及只添加DMEM培养液(不含细胞)的调零孔。每组设6 个重复,37 ℃、5% CO2条件下培养24 h,后用MTT 法检测各孔在波长490 nm 处的吸光值A,计算细胞存活率。细胞存活率计算方法如下:细胞存活率=(A处理组/A对照组)×100%[13-15]。
1.3.2 乙醇对BRL-3A 细胞存活率的影响 取步骤1.3.1 节中制备好的细胞悬液,接种于96 孔板,每孔加入不同浓度的乙醇储液,使其终浓度分别为25,50,75 和100 mmol/L,并设不添加乙醇的空白对照组,以及只添加DMEM 培养液(不含细胞)的调零孔。每组设6 个重复,37 ℃、5% CO2条件下培养12 h,后用MTT 法检测各孔在波长490 nm 处的吸光值A,计算细胞存活率,选择细胞存活率约为50%的乙醇浓度作为试验浓度。
1.3.3 山楂黄酮对乙醇损伤BRL-3A 细胞存活率的影响 取备用的细胞悬液,接种于96 孔板,贴壁培养24 h 后,各试验组分别加入不同浓度的山楂总黄酮储液,使其终质量浓度分别为0.2,0.4,0.6,0.8 和1.0 mg/mL,培养24 h 后,再加入终浓度为100 mmol/L 的乙醇,继续培养12 h,后用MTT法检测细胞存活率,探讨山楂黄酮对乙醇损伤BRL-3A 细胞增殖的影响。同时设置损伤模型对照组(只添加乙醇)和正常组(不添加乙醇和山楂黄酮)。
1.3.4 山楂黄酮对乙醇损伤BRL-3A 细胞SOD活性、MDA 含量和GSH-Px 活性的影响 试验方法同1.3.3 节,培养结束后,取细胞裂解,试剂盒检测SOD 活性、MDA 含量和GSH-Px 活性。
1.3.5 单细胞凝胶电泳 试验方法同1.3.3 节,收集细胞。100 μL 1% 正常熔点琼脂糖(normal melting poin agarose,NMA)铺在磨砂载玻片上,用盖玻片将胶压平,避免气泡形成,琼脂糖在低温下凝固,然后移去盖玻片。将10 μL 细胞(1×105/mL)与90 μL 1%低熔点琼脂糖混匀。将混合物铺在NMA 上,盖上盖玻片,避免气泡的产生,同样低温下使其固化,然后移去盖玻片。将铺好胶的磨砂载玻片放在预冷的裂解液中,4 ℃避光裂解2 h。将裂解后的载玻片从裂解液中取出,用预冷的去离子水泡3 次,每次5 min。电泳电压为25 V,电流为300 mA,时间为30 min。电泳结束,从电泳槽中取出载玻片,用预冷的中和液泡3 次,每次5 min。0.5 mg/L 碘化丙啶染色后,用荧光显微镜观察DNA,并利用图像彗星试验软件工程分析软件(CASP 1.2.3,Wroclaw,Poland)[16-18]。
1.3.6 逆转录实时定量聚合酶链式反应(qPCR)检测基因表达 试验方法同1.3.3 节,培养结束后收集细胞。提取总RNA,未山楂黄酮处理组作为对照。微量核酸蛋白定量仪检测RNA 的纯化与含量,然后逆转录成cDNA。SYBR Green I qPCR 绝对定量检测SOD 基因,β-actin 作为内参基因。SOD 基因的引物为AAGGCCTGCATGGATTCCA和TTGGCCCACCGTGTTTTCT,β-actin 基因的引物为GCTCGTCGTCGACAACGGCTC 和CAAACATGATCTGGGTCATCTTCTC。
1.4 统计学方法
采用SPSS 统计学软件进行成组数据T 检验,P<0.05 为统计学有显著性差异。
2 结果与分析
2.1 山楂黄酮对BRL-3A 细胞增殖的影响
试验结果显示,山楂黄酮质量浓度在0~1 mg/mL 范围内对肝细胞活性没有显著影响(P>0.05),当山楂黄酮质量浓度达到10 mg/mL 及以上时,细胞活性明显下降,呈现显著性差异(P<0.05)。故本研究的试验设计中山楂黄酮的质量浓度设定在0~1 mg/mL 范围内(图1)。
2.2 乙醇对BRL-3A 细胞增殖的影响
试验结果显示,随着乙醇浓度的增加,各处理组的细胞存活率均与对照组存在显著性差异(P<0.05)。当乙醇浓度为100 mmol/L 时,肝细胞存活率为47.3%,符合试验设计的要求,因此,本研究后续的试验中采用该浓度作为试验浓度(图2)。
2.3 山楂黄酮对乙醇损伤BRL-3A 细胞存活率的影响
试验结果显示,与对照组相比,乙醇模型组的细胞存活率极显著降低,肝细胞损伤模型造模成功。与模型组相比,0.2 mg/mL 山楂黄酮能够显著提高损伤肝细胞的存活率,0.4 mg/mL 和0.8 mg/mL 山楂黄酮能够极显著提高损伤肝细胞的存活率(图3)。
2.4 山楂黄酮对肝细胞DNA 损伤的影响
荧光显微镜下,DNA 被碘化丙啶染成橙红色,正常细胞的DNA 呈圆形亮斑,电泳后无拖尾现象 (图4a)。乙醇损伤细胞的DNA 呈彗星状,DNA 损伤越大,彗星的尾巴就会越长(图4b)。0.2,0.4 和0.8 mg/mL 山楂黄酮能够改善乙醇对肝细胞DNA 的损伤,彗星的尾巴变短,且山楂黄酮浓度越大,改善作用越明显(图4c、4d、4e)。
计算细胞的Olive 尾距,随着山楂黄酮浓度的增大,乙醇损伤肝细胞的尾距呈下降趋势。当山楂黄酮浓度达到0.8 mg/mL,损伤细胞的尾距下降到15±3.1(μm)。进一步说明山楂黄酮对乙醇损伤肝细胞的修复作用,且该作用具备量效关系(图5)。

图1 山楂黄酮对BRL-3A 细胞存活率的影响(x±s,n=6)Fig.1 Effects of different concentrations of hawthorn flavonoids on the survival rates of BRL-3A cells

图2 乙醇对BRL-3A 细胞存活率的影响(x±s,n=6)Fig.2 Effects of ethanol on the survival rates of BRL-3A cells

图3 不同浓度山楂黄酮对乙醇损伤BRL-3A 细胞存活率的影响(x±s,n=6)Fig.3 Effects of different concentrations of hawthorn flavonoids on the survival rates of ethanol-injuried BRL-3A cells

图4 山楂黄酮对乙醇诱导BRL-3A 细胞DNA 损伤的影响Fig.4 Effects of different concentrations of hawthorn flavonoids on the DNA damage of ethanol-injuried BRL-3A cells

图5 山楂黄酮对乙醇诱导BRL-3A 细胞Olive尾距的影响Fig.5 Effects of different concentrations of hawthorn flavonoids on the Olive tail moment of ethanol-injuried BRL-3A cells
2.5 山楂黄酮对乙醇损伤BRL-3A 肝细胞SOD活性、MDA 含量和GSH-Px 活性的影响
与正常对照组相比,乙醇能够显著降低BRL-3A 肝细胞内的SOD 和GSH-Px 活性,提高了脂质氧化产物MDA 的含量。与乙醇损伤组相比,0.2,0.4 和0.8 mg/mL 山楂黄酮均能够显著改善损伤细胞的抗氧化指标,0.2 mg/mL 山楂黄酮能够显著提高肝细胞内的SOD 和GSH-Px 活性、降低MDA的含量,0.4,0.8 mg/mL 山楂黄酮能够极显著提高SOD 和GSH-Px 活性、降低MDA 含量。
2.6 山楂黄酮对乙醇损伤BRL-3A 细胞SOD基因mRNA 表达的影响
与正常对照组相比,100 mmol/L 乙醇能够极显著地降低细胞内SOD 基因的mRNA 表达。与乙醇损伤组相比,0.2,0.4 和0.8 mg/mL 山楂黄酮均能够显著上调肝细胞SOD 基因的表达,且具有量效依赖关系(图6)。
3 讨论
DNA 损伤在肿瘤、衰老、炎症、糖尿病和神经退行性疾病等病理生理过程中起着重要作用。氧化应激和脂质过氧化反应和糖基化等细胞过程诱导形成高活性的内源性醛,与DNA 直接反应,形成醛衍生的DNA 加合物,导致DNA 损伤。在持续的条件影响下,醛衍生的DNA 加合物诱发的未修复的DNA 损伤引起细胞稳态失控,从而易于疾病表型的形成和积累。一些高活性醛如4-羟基壬烯醛、丙二醛、丙烯醛、巴豆醛和甲基乙二醛水平升高,与细胞死亡、突变、癌变有关。研究人员给小鼠喂食稀释的酒精(乙醇),动物身体代谢酒精时产生有害的化学物乙醛,乙醛能够让造血干细胞中的DNA 遭受断裂和损伤[7-8]。

表1 不同浓度山楂黄酮对乙醇损伤BRL-3A 细胞SOD 活性、MDA 含量和GSH-Px 活性的影响Table 1 Effects of different concentrations of hawthorn flavonoids on SOD activity,MDA content and GSH PX activity of ethanol-injuried BRL-3A cells
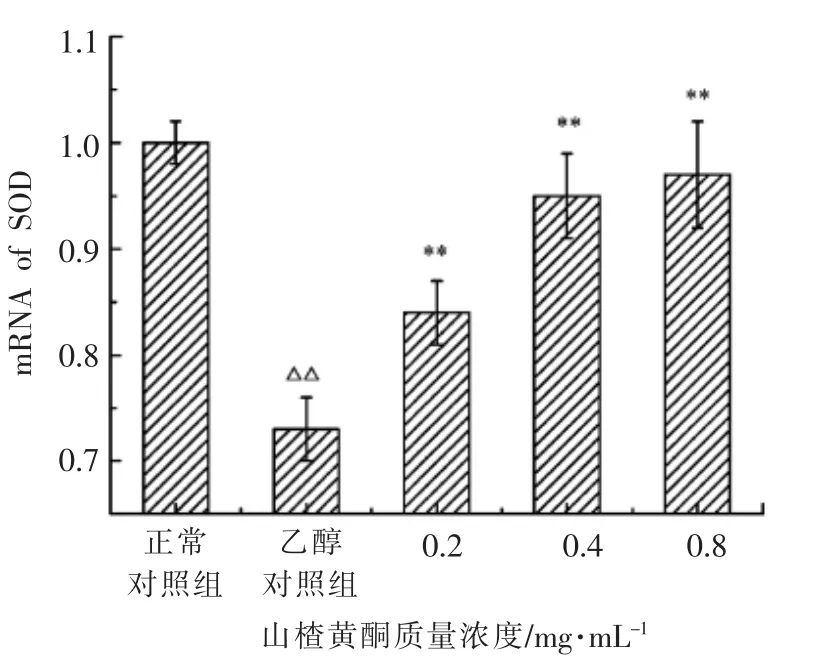
图6 山楂黄酮对乙醇损伤BRL-3A 细胞SOD 基因mRNA 表达的影响Fig.6 Effects of different concentrations of hawthorn flavonoids on the mRNA expression of SOD in ethanol-injuried BRL-3A cells
通过在培养液中添加乙醇,来损伤肝细胞,制备肝细胞损伤模型。其损伤机理是酒精在肝内代谢产生毒性物质乙醛,同时产生多种活性氧自由基,这些自由基可攻击肝细胞膜中多不饱和脂肪酸,引起脂质过氧化反应,产生大量脂质过氧化产物,造成肝细胞的广泛损伤,使乙醇表现为肝毒性[19-20]。本研究中,100 mg/mL 的乙醇抑制了肝细胞BRL-3A 的存活率,损伤了细胞的DNA,使得细胞内的SOD 活性、GSH-Px 活性显著降低,MDA含量升高,不同浓度的山楂黄酮能够缓解这种抑制和损伤作用。研究中发现,山楂黄酮能够通过抗氧化改善这种乙醇引起的DNA 损伤,这种改善作用与SOD 基因的上调表达密切相关。
黄酮作为山楂中的有效成分,提取得率可达5.4%[21-22]。小鼠酒精肝损伤体内试验中,有学者发现山楂黄酮能够减轻酒精对肝脏的损伤,降低TNF-α 水平,减少细胞凋亡[23]。本研究发现体外试验中,山楂黄酮具有修复乙醇诱发的DNA 损伤作用。随着山楂黄酮对肝损伤治疗的深入研究,山楂的综合开发利用将得到进一步发展。

