西妥昔单抗联合FOLFOXIRI方案治疗不可切除结直肠癌肝转移的临床效果
卢锐敏 刘涛 王心吉 李建国 梁瑶 罗立杰

[摘要] 目的 探討西妥昔单抗联合FOLFOXIRI方案治疗不可切除结直肠癌肝转移的临床效果。 方法 选择2013年1月~2016年5月广州中医药大学第二附属医院收治的不可切除结直肠癌肝转移患者105例,按照随机数字表法将其分为对照组(52例)和观察组(53例)。对照组给予FOLFOXIRI方案治疗,观察组给予西妥昔单抗联合FOLFOXIRI方案治疗,14 d为1个化疗周期,两组均连续治疗4个化疗周期。治疗后进行临床疗效评价。比较两组患者治疗前后的病灶数目、病灶大小及外周血CD4+、CD8+水平、CD4+/CD8+和血清糖抗原19-9(CA19-9)、癌胚抗原(CEA)水平。计算并比较两组患者治疗后6个月、1年及3年的生存率。 结果 观察组有效率明显高于对照组,差异有统计学意义(P < 0.05)。两组患者治疗后的病灶数目和病灶大小均明显小于治疗前,且观察组明显小于对照组,差异均有统计学意义(均P < 0.05)。治疗后两组患者外周血CD4+、CD8+水平及CD4+/CD8+均明显高于治疗前,且观察组明显高于对照组,差异均有统计学意义(均P < 0.05)。治疗后两组患者血清CA19-9和CEA水平均明显低于治疗前,且观察组明显低于对照组,差异均有统计学意义(均P < 0.05)。两组患者治疗后6个月的生存率比较,差异无统计学意义(P > 0.05);观察组治疗后1年和3年的生存率均明显高于对照组,差异均有统计学意义(均P < 0.05)。 结论 西妥昔单抗联合FOLFOXIRI方案治疗不可切除结直肠癌肝转移的临床效果显著,能够改善机体免疫功能,降低血清CA19-9和CEA水平,延长患者生存时间。
[关键词] 不可切除结直肠癌肝转移;西妥昔单抗;FOLFOXIRI方案;疗效
[中图分类号] R735 [文献标识码] A [文章编号] 1673-7210(2020)02(b)-0095-05
Clinical effect of Cetuximab combined with FOLFOXIRI regimen in the treatment of liver metastasis of unresectable colorectal cancer
LU Ruimin1,2 LIU Tao2 WANG Xinji2 LI Jianguo2 LIANG Yao3 LUO Lijie1
1.Department of Gastrointestinal Surgery, the Second Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangdong Province, Guangzhou 510120, China; 2.Department of Anus and Intestine Surgery, University of Chinese Academy of Sciences Shenzhen Hospital (Guangming), Guangdong Province, Shenzhen 518107, China; 3.Department of Clinical Pharmacy, University of Chinese Academy of Sciences Shenzhen Hospital (Guangming), Guangdong Province, Shenzhen 518107, China
[Abstract] Objective To investigate the clinical effect of Cetuximab combined with FOLFOXIRI regimen in the treatment of liver metastasis of unresectable colorectal cancer. Methods From January 2013 to May 2016, 105 patients with liver metastasis of unresectable colorectal cancer admitted to the Second Affiliated Hospital of Guangzhou University of Chinese Medicine were divided into the control group (52 cases) and the observation group (53 cases) according to the random number table method. The control group was treated with FOLFOXIRI regimen, while the observation group was treated with Cetuximab combined with FOLFOXIRI regimen. 14 days were one chemotherapy cycle. Both groups were given continuous treatment for 4 chemotherapy cycles. The clinical effect was evaluated after treatment. The number and size of lesions and the levels of peripheral blood CD4+, CD8+, CD4+/CD8+, serum glycoantigen 19-9 (CA19-9) and carcinoembryonic antigen (CEA) of patients in two groups were compared between before and after treatment. Survival rates of patients at 6 months, 1 year, and 3 years after treatment were calculated and compared between the two groups. Results The effective rate of the observation group was significantly higher than that of the control group, and the difference was statistically significant (P < 0.05). The number and size of lesions of patients in both groups after treatment were significantly smaller than before treatment, and those in the observation group were significantly smaller than those in the control group, with statistically significant differences (all P < 0.05). The levels of CD4+, CD8+ and CD4+/CD8+ in peripheral blood of patients in the two groups after treatment were significantly higher than those before treatment, and those in the observation group were significantly higher than those in the control group, with statistically significant differences (all P < 0.05). Serum CA19-9 and CEA levels of patients in both groups after treatment were significantly lower than those before treatment, and those in the observation group were significantly lower than those in the control group, with statistically significant differences (all P < 0.05). There was no significant difference in survival rate of patients between the two groups at 6 months after treatment (P > 0.05). The 1 year and 3 year survival rates in the observation group after treatment were significantly higher than those in the control group, with statistically significant differences (all P < 0.05). Conclusion Cetuximab combined with FOLFOXIRI regimen has a significant clinical effect in the treatment of liver metastasis of unresectable colorectal cancer, which can improve the immune function of the body, reduce serum CA19-9 and CEA levels, and prolong the survival time of patients.
[Key words] Unresectable colorectal cancer with liver metastasis; Cetuximab; FOLFOXIRI regimen; Curative effect
结直肠癌是一种临床常见的消化道恶性肿瘤,在我国的发病率居于恶性肿瘤第三位,且近年来的发病率越来越高,严重威胁着人们的身体健康[1]。结直肠癌在发病初期并无明显的临床症状,在临床确诊时往往已处于病理晚期,发生了远处转移[2]。结直肠癌最常见的远处转移器官是肝脏,有25%左右的结直肠癌患者在确诊时就伴有肝转移,而其中80%~90%的患者的肝转移灶不可切除,初始可切除的患者中有20%的患者术后还会发生肝转移[3]。对于能够接受手术切除的患者完整切除肝内转移灶能够获得较长的生存期,然而对不可切除结直肠癌肝转移的患者,手术切除治疗的预后较差,在临床上多给予全身性的化疗来延缓病情的进展[4]。FOLFOXIRI方案是由亚叶酸钙、奥沙利铂、氟尿嘧啶三种药物联合应用的化疗方案,对肿瘤细胞有较好的杀伤作用,疗效较好,然而部分患者在治疗后不良反应较多,导致患者对该方案不耐受[5]。西妥昔单抗是一种人鼠嵌合型的单克隆抗体,通过作用于肿瘤细胞过度表达的表皮生长因子来阻断表皮生长因子信号通路的传导,从而抑制肿瘤细胞的增殖和诱导肿瘤细胞的凋亡,发挥抗肿瘤的作用[6]。
1 资料与方法
1.1 一般资料
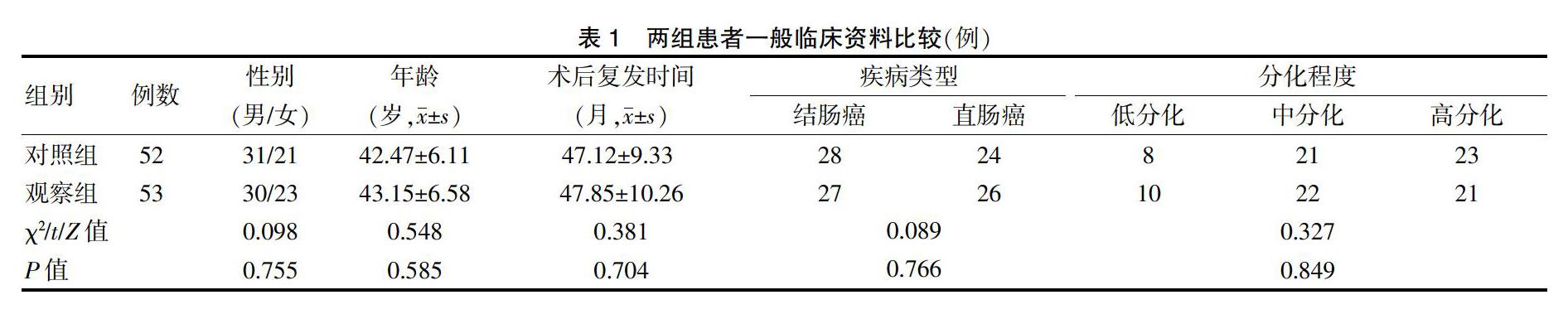
将2013年1月~2016年5月广州中医药大学第二附属医院(以下简称“我院”)收治的105例结直肠癌肝转移患者作为研究对象。纳入标准:①诊断标准符合《结直肠癌肝转移诊断和综合治疗指南(2010)》[7]中相关规定;②术后复查时检测确诊为转移性肝癌;③能耐受常规化疗者;④预计生存期>1年;⑤知情同意者。排除标准:①伴有慢性乙型肝炎、慢性阻塞性肺疾病等患者;②对化疗药物、造影剂等过敏患者;③心肝肾功能不全患者;④妊娠或哺乳期妇女;⑤精神异常、老年性痴呆患者;⑥转移性肝癌发生破裂与出血。所有患者根据随机数字表法分为对照组和观察组,对照组52例,观察组53例。两组患者一般临床资料比较,差异无统计学意义(P > 0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准实施。
1.2 治疗方法
对照组给予FOLFOXIRI方案治疗,具体为:亚叶酸钙(江苏恒瑞医药股份有限公司,规格100 mg/支,生产批号:20121108),静脉输注2 h,剂量为200 mg/m2,第1天给药;奥沙利铂(杭州赛诺菲安万特民生制药有限公司,规格50 mg/支,生产批号:20120507),静脉输注2 h,剂量为85 mg/m2,第1天给药;氟尿嘧啶(西安海欣制药有限公司,规格250 mg/支,生产批号:20120611),持续静脉输注44 h,剂量为2400 mg/m2,第1天给药;伊立替康(江苏恒瑞医药股份有限公司,规格100 mg/支,生产批号:20120604),静脉输注90 min,剂量为150 mg/m2,第8天给药;14 d为1个化疗周期。观察组在对照组治疗的基础上给予西妥昔单抗(德国默克公司,规格100 mg/支,生产批号:20121011)治疗,具体为:第1天给药500 mg/m2,静脉滴注60 min以上,每2周给药1次。两组均治疗4个化疗周期。
1.3 临床疗效
临床疗效主要分为4个等级,具体为:①完全缓解(CR):病灶完全消失,且维持4周及以上;②部分缓解(PR):肿瘤体积缩小≥50%,且维持4周及以上,无新的病灶出现;③疾病稳定(SD):肿瘤体积缩小 <50%或肿瘤体积增大<25%;无新的病灶出现;④疾病进展(PD):肿瘤体积增大≥25%或有新的病灶出现[8]。有效=CR+PR。
1.4 检测指标
①采用影像学检测,比较两组患者治疗前后的病灶数目和病灶大小。②由同一名医师于清晨采集所有患者的静脉血10 mL,患者需在空腹状态下,取其中5 mL离心,设置离心机参数为离心半径13.5 cm、离心转速2000 r/min,离心15 min来获得血清,放置于2~8℃冰箱中保存备用;剩余的5 mL加至内壁涂有肝素的离心管中,放置于2~8℃冰箱中保存备用。检测两组患者治疗前后的外周血T淋巴细胞亚群水平,包括CD4+和CD8+,并计算CD4+/CD8+,检测采用购自美国BD公司的BDAccuriC6流式细胞仪。检测两组患者治疗前后血清糖抗原19-9(CA19-9)和癌胚抗原(CEA)水平,检测均采用购自深圳市科润达生物工程有限公司的双抗夹心酶联免疫吸附试验(ELISA)试剂盒,批号为120815、121022。③计算并比较两组患者治疗后6个月、1年及3年的生存率。
1.5 统计学方法
采用SPSS 19.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,采用t检验,计数资料采用百分率表示,采用χ2检验,等级资料采用轶和检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 兩组患者临床疗效比较
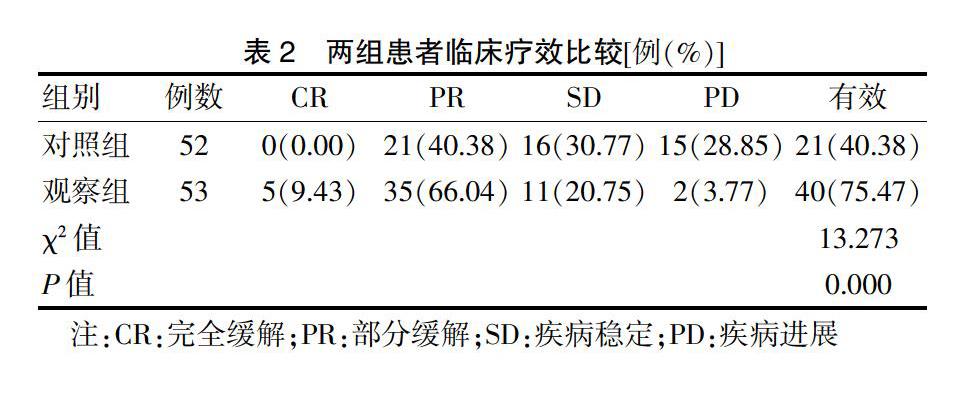
观察组有效率明显高于对照组,差异有统计学意义(P < 0.05)。见表2。
2.2 两组患者治疗前后病灶数目和病灶大小比较
两组患者治疗后病灶数目和病灶大小均明显小于治疗前,且观察组明显小于对照组,差异有统计学意义(P < 0.05)。见表3。
2.3 两组患者治疗前后外周血T淋巴细胞亚群水平比较
两组患者治疗后的外周血CD4+、CD8+水平及CD4+/CD8+均明显高于治疗前,且观察组明显高于对照组,差异有统计学意义(P < 0.05)。见表4。
2.4 两组治疗前后血清CA19-9和CEA水平比较
两组治疗后的血清CA19-9和CEA水平均明显低于治疗前,且观察组明显低于对照组,差异有统计学意义(P < 0.05)。见表5。
2.5 两组患者治疗后生存率比较
两组患者治疗后6个月的生存率比较,差異无统计学意义(P > 0.05);观察组治疗后1年和3年的生存率均明显高于对照组,差异有统计学意义(P < 0.05)。见表6。
3 讨论
FOLFOXIRI方案为三种化疗药物联合治疗的方案,其中的氟尿嘧啶能够通过抑制胸腺嘧啶核苷酸合成酶来阻断脱氧尿嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸,从而抑制肿瘤细胞DNA的合成,还能够通过阻断尿嘧啶和乳清酸进入RNA的过程来抑制RNA的合成,从而抑制肿瘤细胞的增殖;亚叶酸钙和氟尿嘧啶联合应用能够促进胸苷合成酶和氟尿嘧啶脱氧核苷酸的结合,提高氟尿嘧啶的效果;奥沙利铂为细胞非特异性抗肿瘤药物,通过与DNA内的鸟嘌呤共价结合来形成链内交键和链间交联,从而对肿瘤细胞DNA造成损伤,破坏DNA的复制过程,引发肿瘤细胞凋亡;三种药物联合应用具有较好的抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡的作用[9]。然而随着化疗的进程,化疗药物的记录和次数逐渐增加,患者对化疗的耐受性越来越差,导致临床疗效变差[10]。西妥昔单抗是一种重组的IgG1单克隆抗体,能够特异性结合表皮生长因子受体(EGFR)的胞外激酶,从而抑制EGFR与其他配体的有效结合,阻断EGFR的信号传导通路,发挥抑制肿瘤细胞增生,诱导肿瘤细胞凋亡的作用[11-12]。
本研究结果显示,观察组有效率明显高于对照组,观察组治疗后病灶数目和病灶大小均明显小于对照组,观察组治疗后1、3年生存率均明显高于对照组,差异有统计学意义(P < 0.05)。有文献报道[9],FOLFOXIRI方案辅助化疗用于治疗晚期结直肠癌,在患者可耐受的范围内能够延长患者的生存期,并且不良反应的发生在可控的范围内。西妥昔单抗为人/鼠嵌合型EGFR单克隆抗体,属于分子靶向药物,已有文献报道在中晚期结直肠癌的治疗中有较好的效果[13-14]。本研究结果显示,观察组治疗外周血CD4+、CD8+水平均明显高于对照组差异有统计学意义(P < 0.05)。提示西妥昔单抗联合FOLFOXIRI方案能够提高不可切除结直肠癌肝转移患者的机体免疫功能。研究提示,恶性肿瘤的发生发展与机体免疫功能的降低有紧密联系,因此通过检测T淋巴细胞亚群水平的变化能够用于判断患者的预后[15-17]。西妥昔单抗特异性抑制内皮细胞生长因子受体,从而能够保护T淋巴细胞亚群水平,有助于患者免疫功能的改善[18]。另外本研究结果显示,观察组治疗后的血清CA19-9和CEA水平均明显低于对照组,差异有统计学意义(P < 0.05)。CA19-9是一种存在于细胞膜上的黏蛋白形式的脂质,其血清水平随结直肠癌的发展逐渐升高[19-21]。CEA是一种广谱的非特异性肿瘤标志物,能够用于结直肠癌、乳腺癌、胰腺癌、肺癌等多种恶性肿瘤的诊断和预后评价[22]。西妥昔单抗联合FOLFOXIRI方案对不可切除结直肠癌肝转移患者的癌细胞有较强的杀伤和抑制作用,因此能够明显降低血清CA19-9、CEA水平。
综上所述,西妥昔单抗联合FOLFOXIRI方案治疗不可切除结直肠癌肝转移的临床效果显著,能够改善机体免疫功能,降低血清CA19-9和CEA水平,延长患者生存时间。
[参考文献]
[1] 苏晓宇,韩树堂.早期结直肠癌内镜治疗术后中药治疗的辨治规律研究[J].国际中医中药杂志,2018,40(4):323-326.
[2] 乔大伟,李玉芳,李胜男,等.结直肠癌肝转移动物模型研究进展[J].实验动物科学,2019,36(3):86-90.
[3] 惠鹏,刘连新,梁英健.结直肠癌肝转移的分子机制研究进展[J].中国普外基础与临床杂志,2019,26(6):758-763.
[4] 徐国辉,徐宗全,周峥,等.TACE联合贝伐珠单抗治疗不可切除结直肠癌肝转移的临床研究[J].实用癌症杂志,2015,30(10):1493-1496,1500.
[5] 孙晴,李德川.奥沙利铂或伊立替康联合5-氟尿嘧啶和亚叶酸钙用于不可切除的结直肠癌肝转移术前化疗的比较[J].实用肿瘤杂志,2012,27(4):424-428.
[6] 尹小五,夏秀梅,鲁斌.西妥昔单抗联合伊立替康治疗转移性结直肠癌的临床观察[J].中国现代医生,2019,57(4):28-30.
[7] 中华医学会外科学分会胃肠外科学组.结直肠癌肝转移诊断和综合治疗指南(2010)[J].中华胃肠外科杂志,2010, 13(6):457-470.
[8] 靳剑,王相.XELOX化疗联合中药治疗梗阻性结直肠癌的疗效分析[J].国际中医中药杂志,2016,38(6):523-526.
[9] 李书有,黄广优,张珍妮,等.阿帕替尼联合FOLFOXIRI方案治疗不可切除结直肠癌肝转移患者的疗效与安全性观察[J].结直肠肛门外科,2019,25(2):164-167.
[10] 蔡延庆,谢春荣,许宏伟.mFOLFOX-6与FOLFIRI方案治疗转移性结直肠癌的临床疗效比较[J].慢性病学杂志,2019,20(2):222-224.
[11] 朱方,张全安,郑勤,等.西妥昔单抗联合mFOLFOX6一线治疗k-ras野生型结直肠癌肝转移临床疗效观察[J].中华临床医师杂志:电子版,2013,7(19):8593-8596.
[12] 王芳,陈随才,曹娜娅,等.伊立替康联合西妥昔单抗对晚期结直肠癌肝转移患者肝功能和组织学的影响[J].中国肿瘤临床与康复,2016,23(9):1047-1050.
[13] 王晓.射频消融术辅助肝动脉化疗栓塞与西妥昔单抗治疗结直肠癌肝转移临床观察[J].结直肠肛门外科,2018, 24(S2):157-158.
[14] 李东玲,周京旭,朱茗祺,等.西妥昔单抗和贝伐珠单抗治疗晚期结直肠癌的有效性和安全性比较[J].现代生物医学进展,2019,19(8):1482-1485.
[15] 周昕,高明娟,陈正权,等.结直肠癌患者术后感染的病原学特点及免疫功能的变化[J].中华医院感染学杂志,2019,29(10):1531-1534.
[16] 郭玉华.晚期结直肠癌患者接受FOLFOX方案治疗对免疫功能的影响[J].中国社区医师,2018,34(36):23,25.
[17] 张志国,李文文,杨凡等.SOX联合贝伐单抗和mFOLFOX6联合贝伐单抗方案治疗转移性结直肠癌患者疗效和安全性比较[J].医学综述,2018,24(2):389-393.
[18] 刘浩聪,雷雨,唐诗,等.西妥昔单抗治疗晚期结直肠癌(mCRC)耐药后复用治疗有效1例报道[J].现代肿瘤医学,2019,27(16):2946-2949.
[19] 林雪丹,邵建力,杨天兴.糖类抗原19-9对Ⅳ期结直肠癌预后的预测价值[J].中国卫生检验杂志,2019,29(10):1199-1203.
[20] 黄胜波.结直肠癌患者术前TNM分期与肿瘤指标的关联性分析[J].中国医药科学,2019,9(18):218-220,241.
[21] 李金娜,张颖,王颖等.不可切除转移性结直肠癌维持治疗的研究进展[J].医学综述,2019,25(7):1322-1326.
[22] 郭庆伟,徐志诚,崔永欣.结直肠癌术前不同CEA水平对患者预后及复发转移的影响[J].实用癌症杂志,2019, 34(4):561-563.
(收稿日期:2019-08-09 本文编辑:顾家毓)

