草鱼头磷脂制备工艺优化及抗氧化性能分析
,2,3,*,2,3,2,3,2,3,2,3
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.湖北省农产品加工与转化重点实验室,湖北武汉 430023;3.大宗粮油精深加工省部共建教育部重点实验室,湖北武汉 430023)
磷脂是生命的重要物质和细胞膜的组成成分之一,具有调节机体代谢,降血脂,预防血栓等生理活性功能[1-2]。从结构来看,磷脂属两亲结构,磷脂中的磷脂酰胆碱(Phosphatidylcholine,PC)和磷脂酰乙醇胺(Phosphatidylethanilamine,PE)将细胞膜上的过氧化脂质运送出细胞膜,防止细胞膜表面积累较多的脂质过氧化产物,避免细胞膜的损伤,从而实现磷脂的抗氧化作用[3-5]。
草鱼(Ctenopharyngodonidellus)是我国具有本土特色且大量养殖的一种常见鱼类,养殖周期短,食用口感好,受到水产养殖行业和市场的喜爱,草鱼加工产品主要有鱼肉的冷冻制品、生鲜调味品、鱼糜以及干腌制品4种类型,但鱼头一般作为副产物没有很好的加工利用途径[6]。国内有研究者对草鱼肌肉中磷脂进行了提取优化和分析测定,并对草鱼各部位脂质进行系统性的分析研究,但基于草鱼头来源磷脂的制备工艺优化并分析其抗氧化性能的课题鲜见报道[7]。目前磷脂的制备方法主要为溶剂萃取法[8-10]、柱层析法[11]、CO2超临界萃取法[12]和膜分离法[13]等。
本研究以草鱼加工副产物中的鱼头为原料,基于成本和工业化生产可行性考虑,选择溶剂法来提取草鱼头磷脂,并检测草鱼头磷脂的体外抗氧化性能,其可为磷脂在水产品加工副产物领域的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜活草鱼 产地武汉,购买于武汉市常青花园武商量贩店,每条重量(1000±100) g;大豆磷脂(纯度≥65%) 美国Sigma公司;氯仿、正己烷、甲醇 色谱纯,天津市科密欧化学试剂有限公司;BF3-甲醇 上海Aladdin公司;GF254薄层色谱硅胶板、GF254柱层析硅胶(100~200目) 青岛海洋化工厂;所有分离用有机溶剂 均为国产分析纯。
RE-52CS旋转蒸发器、YH-500隔膜真空泵 上海亚荣生化仪器厂;HH-2数显恒温水浴锅 上海维诚仪器有限公司;CP214电子分析天平 奥豪斯国际贸易(上海)有限公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司。
1.2 实验方法
1.2.1 草鱼头磷脂提取工艺流程 鲜活草鱼→宰杀→鱼头→破壁机破碎→真空冷冻干燥→粉碎后过200目筛→加乙醇混匀后于水浴锅静置提取→抽滤→取滤液于0.08 MPa真空,80 ℃条件下旋转蒸发去除溶剂→磷脂
1.2.1.1 乙醇浓度对草鱼头磷脂得率及纯度的影响 取粉碎后的草鱼头粉25 g左右,设置乙醇浓度为50%、60%、70%、80%、90%、100%,固定条件为:料液比1∶10 g/mL,55 ℃条件下提取1.5 h,抽滤后旋蒸除去乙醇,用磷脂纯度来确定最优乙醇浓度。
1.2.1.2 料液比对草鱼头磷脂得率及纯度的影响 取粉碎后的草鱼头粉25 g左右,设置料液比为1∶4、1∶6、1∶8、1∶10、1∶12 g/mL,固定条件为:乙醇浓度70%,55 ℃条件下提取时间1.5 h,抽滤后旋蒸除去乙醇,用磷脂纯度来确定最优料液比。
1.2.1.3 提取温度对草鱼头磷脂提取率及纯度的影响 取粉碎后的草鱼头粉25 g左右,设置提取温度为25、35、45、55、65、75 ℃,固定条件为:乙醇浓度70%,料液比1∶8 g/mL,提取时间1.5 h,抽滤后旋蒸除去乙醇,用磷脂纯度来确定最优提取温度。
1.2.1.4 提取时间对草鱼头磷脂提取率及纯度的影响 取粉碎后的草鱼头粉25 g左右,设置提取时间为1.5、3.0、4.5、6.0、7.5、9.0 h,固定条件为:乙醇浓度70%,料液比1∶8 g/mL,提取温度55 ℃,抽滤后旋蒸除去乙醇,用磷脂纯度来确定最优提取时间。
1.2.2 正交试验设计 分别考察乙醇浓度、料液比、提取温度、提取时间四个单因素对草鱼头磷脂得率及纯度的影响。根据单因素实验结果,每个因素选取3个较佳水平,按照L9(34)进行正交试验,以磷脂纯度为考核指标来优化草鱼头磷脂制备工艺,见表1[14]。
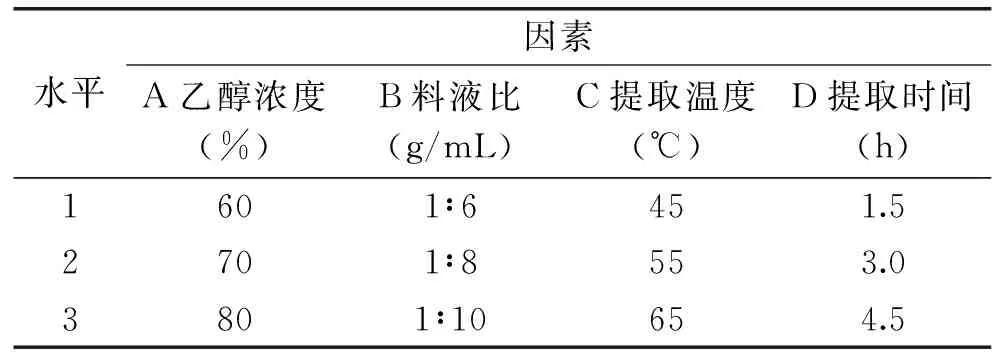
表1 正交实验因素与水平表Table 1 Factors and levels of orthogonal test
1.2.3 磷脂纯度检测 磷脂产物中所含纯磷脂的质量检测参考SN/T 3851-2014[15]。

1.2.4 草鱼头磷脂的纯化 准确称取0.2 g最优工艺条件下乙醇提取的草鱼头磷脂进行硅胶柱分离,先后用220 mL氯仿、120 mL丙酮、220 mL甲醇洗脱,收集甲醇洗脱液后旋蒸去除甲醇,即为纯化后磷脂。纯化后的磷脂-20 ℃条件下保存,用于磷脂脂肪酸组成分析。
1.2.5 草鱼头磷脂薄层色谱分析 将上述所纯化的磷脂加入氯仿溶解,配制成100 mg/mL的溶液进行薄层色谱分离,展开剂为氯仿∶甲醇∶水=65∶25∶4 (V/V/V),采用Ditmmer-Leser试剂作为显色剂,显色后扫描薄层结果,采用比移值Rf=溶质移动的距离/溶液移动的距离,并使用Scion Image软件处理图像后分析不同磷脂种类的含量。
1.2.6 草鱼头磷脂的脂肪酸组成分析
1.2.6.1 脂肪酸甲酯化 称取草鱼头磷脂50 mg于10 mL容量瓶中,加入2 mL 0.5 mol/L的NaOH/甲醇溶液,在65 ℃皂化30 min,后加入2 mL的BF3-甲醇(1∶3,V/V)溶液,加热反应3 min后,冷却至室温,加入2 mL正己烷进行萃取,摇匀后静置分层,取上层有机相,离心备用。
1.2.6.2 GC条件 色谱柱:HP-FFAP石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:140 ℃保持1 min,以5 ℃/min升至190 ℃,再以3 ℃/min升至220 ℃,保持10 min;载气(He)流速1.0 mL/min,压力88 kPa,进样量1 μL;分流比10∶1。
1.2.6.3 MS条件 电子轰击离子源;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;扫描周期3.21次/s;质量扫描范围m/z 10~460。
1.2.6.4 GC-MS数据分析 用气相色谱-质谱进行全离子扫描分析。用化学工作站数据处理系统和标准质谱图库NIST11进行解析,确认草鱼头磷脂中各种脂肪酸的化学结构。根据化合物色谱峰响应,利用面积归一化法计算各脂肪酸组分的相对百分含量。
1.2.7 外抗氧化能力测定
1.2.7.1 羟自由基(·OH)清除能力测定 参照文献[16],将脂质样品配成5、10、15、20、25 mg/mL的五种样品溶液,进行羟自由基(·OH)清除能力测定。与样品同浓度的大豆卵磷脂重复上述步骤,并与草鱼头磷脂比较。
1.2.7.2 还原力的测定 参照文献[17],样品用蒸馏水超声溶解,配制成10、20、30、40、50 mg/mL的五种样品溶液,进行还原力测定。与样品同浓度的大豆卵磷脂重复上述步骤,并与草鱼头磷脂比较。
1.3 数据处理
试验数据经整理后,采用SPSS Statistics 19对数据进行显著性方差分析,多重比较采用最小显著法,差异显著水平为α=0.05,试验数据使用平均值±标准差来表示。
2 结果与分析
2.1 乙醇浓度对磷脂得率及纯度的影响
为了保证提取得到的草鱼头磷脂的品质,在工艺优化时以磷脂的纯度作为主要检测指标,同时测定得率作为参考。从图1可以看到,提取的草鱼头磷脂纯度随着乙醇浓度的升高先增大后减小,而磷脂得率呈现与之相反的先下降后升高的趋势,当乙醇浓度为70%时,磷脂纯度最高,达64.34%,确定为最佳乙醇浓度,此时得率为4.74%。当乙醇浓度在50%时,提取液水含量较高,I/O值(无机性值/有机性值)偏无机性方向,水溶性杂质提取较多,故其中磷脂纯度较低;随着乙醇浓度升高,提取液的无机性逐渐减弱,有机性升高,逐渐接近磷脂的I/O值,提取得到的磷脂纯度升高,水溶性成分明显减少,磷脂得率降低;当乙醇浓度进一步升高时,提取液极性开始下降,I/O值偏向有机性质,作为极性脂的磷脂的溶解度降低[18],而同时提取到的非极性脂质的增加,导致磷脂得率上升但纯度下降。陈文娟等[19]发现使用乙醇溶液提取大黄鱼鱼卵时提取物中磷脂含量(纯度)随着乙醇含量的增大逐渐增大,当乙醇含量为95%时,磷脂纯度为24%,提取率最大,直到使用乙醇浓度100%,磷脂纯度提取率开始下降,与本研究结果类似,只是最优的乙醇浓度偏高,这可能与原料不同有关,包括其中的磷脂含量、磷脂结合状态等因素都会对提取工艺产生影响,故确定最佳乙醇浓度为70%。
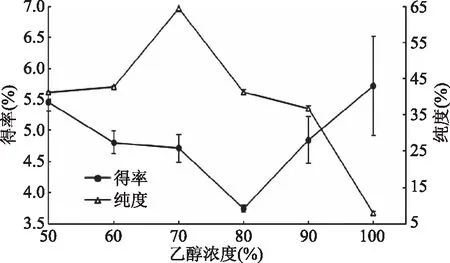
图1 乙醇浓度对磷脂得率及纯度的影响Fig.1 Effects of ethanol concentrationon yield and purity of phospholipids
2.2 料液比范围的确定
图2结果表明,随着料液比中提取液的比例增加,提取的草鱼头磷脂纯度先升高后下降,在料液比1∶8和1∶10 g/mL时达到最高,两者都在65%附近,差别不明显;而磷脂得率呈现先明显降低再上升的变化,料液比在1∶8和1∶10 g/mL时,提取率偏低,都在3.4%附近,区别不显著。在指标相同的情况下,更低的料液比可以降低成本,故确定1∶8 g/mL为最佳料液比。

图2 料液比对磷脂得率及纯度的影响Fig.2 Effect of material to liquid ratioon yield and purity of phospholipids
料液比1∶4 g/mL时提取液的量偏少,草鱼头粉末吸收了乙醇溶液的水分会导致乙醇浓度增加,从而导致提取的磷脂纯度不高但提取率偏高(参见2.1中乙醇浓度高的情况),随着提取液的比例增加,草鱼头粉末对乙醇溶液的影响逐渐减小,磷脂提取的纯度增加,得率保持稳定,磷脂在乙醇溶液中浓度适宜,达到提取的动态平衡,但当提取液比例进一步增大时,平衡被打破,过多的乙醇溶液会在提取磷脂后继续溶解中性脂,从而导致纯度下降而得率上升。
2.3 提取温度对磷脂得率及纯度的影响
从图3可以看到,草鱼头磷脂纯度随着提取温度的升高先上升后下降,当提取温度为55 ℃时,磷脂纯度最高,达76.75%。而磷脂得率随着提取温度的升高,在2.5%~3.5%附近呈现波动变化,当提取温度为55 ℃时,磷脂产物得率2.65%,确定55 ℃为最佳提取温度。提取温度的升高可加快溶质的传质速率,对于极性磷脂的选择性更强,因此可以获得较高纯度的磷脂;但随着温度逐渐升高,乙醇挥发加快,导致提取液中乙醇浓度降低,因而磷脂纯度又开始下降(参见2.1)。过高的温度还会使磷脂氧化降解,影响磷脂的品质[20]。因此提取温度不宜过高。得率的波动变化,推测与提取的磷脂中混有的中性脂比例有关。
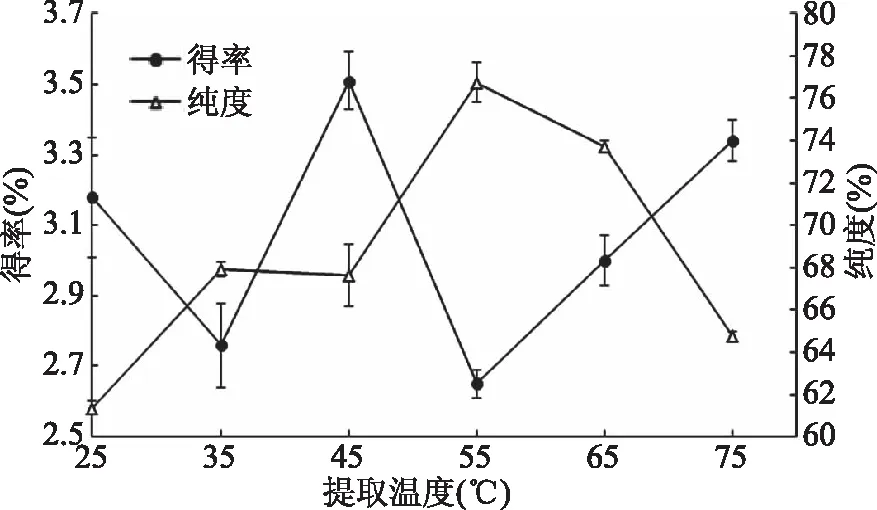
图3 提取温度对磷脂得率及纯度的影响Fig.3 Effect of temperature on yieldand purity of phospholipids
2.4 提取时间对磷脂得率及纯度的影响
分析图4中的结果可以看到,草鱼头磷脂纯度在提取时间从1.5 h增加到3 h时略有上升,达到最高值,之后再延长提取时间,纯度连续下降。磷脂提取率随着提取时间的增加,在1.88%~3.15%之间呈现波动,在提取时间为4.5 h时,得率达到最高,但3 h时得率已经达到3%,与之相差不大。确定3 h为最佳提取时间。草鱼头粉末所含的磷脂的被乙醇溶液充分提取出来需要一定时间,适当的提取时间有利于得到纯度和得率都较高的磷脂,但是过长的提取时间会由于偏高的提取温度(55 ℃)引起乙醇挥发从而降低乙醇浓度,使提取的磷脂纯度下降,同时非磷脂成分的增加导致得率降低后又上升。

图4 提取时间对磷脂得率及纯度的影响Fig.4 Effect of time on yield and purity of phospholipids
2.5 草鱼头磷脂制备正交试验结果
从表2可知,影响草鱼头磷脂制备的主次因素为A>B>C>D,即乙醇浓度>料液比>提取温度>提取时间。从表3可知,通过进一步的方差分析表明,乙醇浓度对草鱼头磷脂的提取影响非常显著,提取时间对草鱼头磷脂的提取影响显著,而料液比和提取温度对草鱼头磷脂的提取影响不显著。
2.6 验证试验结果
优方案为A3B2C2D2(乙醇浓度80%,料液比1∶8 g/mL,提取温度55 ℃,提取时间3 h)。经验证,按照A3B2C2D2条件提取的脂质样品中磷脂纯度为79.52%±1.48%,略低于正交试验A3B1C3D2的纯度(84.20%±0.65%),最终确定A3B1C3D2为最优工艺条件,此时磷脂得率为3.03%±0.06%。综上所述,根据正交试验结果,确认最佳工艺条件为:乙醇浓度80%,料液比1∶6 g/mL,提取温度65 ℃,提取时间3 h。

表2 正交试验方案和结果Table 2 Program and results of orthogonal test
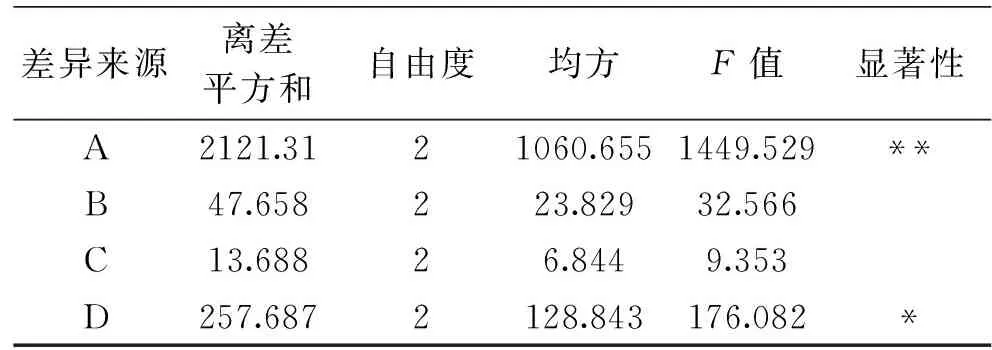
表3 草鱼头磷脂提取方差分析Table 3 Analysis of variance of extraction ofgrass carp head phospholipids
注:“*”表示影响显著,P<0.05;“**”表示影响极显著,P<0.01。
2.7 最优条件磷脂薄层色谱分析

表4 磷脂各组分的比移值Table 4 Transfer values and composition of phospholipids component
注:不同字母表示具有显著性差异,P<0.05。
草鱼头磷脂薄层分析结果见图5和表4。从结果中可看到,草鱼头磷脂主要含有磷脂酰胆碱(Phosphatidylcholine,PC)、磷脂酰乙醇胺(Phosphatidylethanilamine,PE)、鞘磷脂(Sphingomyelin,SM)和溶血磷脂酰胆碱(Lysophosphatidylcholine,LPC)四种磷脂,PC在鱼头磷脂中含量最高,达60%,PE其次,达20%。

图5 磷脂的薄层色谱图Fig.5 Thin layer chromatography of phospholipid
PC是人体生长发育所需的重要磷脂,是人体获得胆碱及生长代谢的物质来源[21]。PE是神经细胞膜的重要构成,能显著改善大脑发育及功能[22]。Judde等[23]发现大豆卵磷脂的抗氧化能力与磷脂中的PC和PE的含量有关。SM对于抑制癌症具有潜在的作用效果,其代谢产物神经酰胺和鞘氨醇维持体内细胞的正常生长[24]。
2.8 最优条件磷脂的脂肪酸组成
草鱼头磷脂脂肪酸组成见表5。草鱼头磷脂中的脂肪酸组成以PUFA为主,含量达到52.09%±0.59%。草鱼头磷脂中EPA含量占10.34%±0.03%,DHA含量占17.83%±0.48%。作为n-3系列PUFA,DHA和EPA具有独特的生理活性。DHA是人体必需的多不饱和脂肪酸,对人体视网膜的发育起着关键作用。EPA对视网膜和大脑的结构膜起重要作用,并可预防心脑血管疾病的发生[25]。

表5 草鱼头磷脂脂肪酸组成Table 5 Fatty acid composition ofphospholipids from grass carp head
结合有DHA和EPA的磷脂在拥有磷脂和PUFA各自的生理功能外,更容易被人体接受并消化吸收效果更佳,而当它们作为单独脂肪酸或者甘油酯等形式时,其结构更加稳定,不易被人体吸收[26]。
2.9 体外抗氧化能力测定
2.9.1 ·OH清除能力测定 ·OH是人体内最活泼的自由基之一,能够氧化细胞膜上的不饱和脂肪酸,其氧化产物能够与蛋白质等生物大分子反应,引起细胞膜损伤[27]。由图6可知,草鱼头磷脂和大豆卵磷脂对·OH都有清除能力,且·OH清除率随着浓度的增加而增长。在检测的磷脂浓度范围内,草鱼头磷脂·OH清除率全都显著高于大豆卵磷脂(P<0.05),两者的·OH清除率在浓度为25 mg/mL时达最大值,分别为94.4%、84.2%。Saito等[28]发现,PC和PE的极性头部侧链具有清除氢过氧化物的活性氨基。Cortie等[29]研究发现,磷脂中SFA和MUFA的含量越高,其磷脂的氧化稳定性越好。草鱼头磷脂中PC和PE含量比大豆磷脂含量高,草鱼头磷脂比大豆磷脂结合了更多的SFA和MUFA,因此,草鱼头磷脂比大豆磷脂清除自由基的活性更好[30]。

图6 磷脂对·OH清除能力Fig.6 ·OH scavenging ability of phospholipids
2.9.2 还原力的测定 还原力是衡量物质抗氧化能力的指标之一[31]。由图7可知,吸光度随着磷脂浓度的增加而增大,即还原力随磷脂浓度增加而增强。在10~50 mg/mL范围内,草鱼头磷脂的还原力显著高于大豆卵磷脂(P<0.05),大豆磷脂和草鱼头磷脂都具有PC和PE,二者在还原力之间的差异可能是草鱼头磷脂中PC和PE含量比大豆磷脂含量高所导致,还可能与草鱼头SFA的含量高有关[28-29]。

图7 磷脂的还原能力Fig.7 Reducing capacity of phospholipids
3 结论
通过单因素正交试验确定乙醇提取冷冻干燥草鱼头粉磷脂的最优工艺方案为:乙醇浓度80%,料液比1∶6,提取温度65 ℃,提取时间3 h,在此条件下,磷脂纯度84.20%±0.65%,磷脂得率为3.03%±0.06%。草鱼头磷脂以PC为主,脂肪酸组成以PUFA为主,特别是含有一定量的DHA和EPA。体外抗氧化能力测定中,草鱼头磷脂的·OH清除能力和还原力都优于大豆磷脂。通过本文中醇提法制备的草鱼头磷脂营养价值较高,具有一定开发前景,或可将其应用在磷脂补充剂、抗衰老保健品等方面。

