嗜热酸性生淀粉α-淀粉酶Gt-amy的C末端 结构域功能及生淀粉结合位点分析
曾 静,郭建军,涂熠坤,袁 林,
(1.江西省科学院微生物研究所,江西 南昌 330096;2.南京工业大学化学与分子工程学院,江苏 南京 211800)
生淀粉α-淀粉酶是指能对不经过蒸煮糊化的生淀粉颗粒表现出强水解活性的α-淀粉酶[1-4]。生淀粉α-淀粉酶可以在低于糊化温度条件下直接作用于未经蒸煮糊化的生淀粉颗粒,在淀粉液化过程中能够省去生淀粉糊化步骤,有利于节约能源和简化工艺,因此生淀粉α-淀粉酶在酿造、食品、造纸、纺织等领域具有巨大的应用潜力。
生淀粉α-淀粉酶往往是多结构域蛋白质,除催化结构域,还包含一个不具有催化功能的淀粉结合结构域(starch binding domain,SBD),这是它能够直接水解未经糊化处理的生淀粉颗粒的关键[5-8]。SBD属于碳水化合物结合分子(carbohydrate-binding modules,CBM)[9-12]。 SBD作为生淀粉酶的天然部分主要可使淀粉酶分子可以在溶液中与不溶性底物(淀粉颗粒)结合,将底物运送到催化结构域的活性位点以及使淀粉颗粒表面破裂。SBD通常位于酶的N-末端或C-末端,微生物来源的生淀粉α-淀粉酶的SBD结构域一般位于其分子结构的C末端。SBD的蛋白质序列一般由90~130 个氨基酸残基组成,通常在与催化结构域分离的情况下仍能发挥功能。SBD与生淀粉的结合主要依靠芳香族氨基酸(特别是Trp)与葡萄糖环的堆积作用。
来源于嗜热菌Geobacillus thermoleovorans的嗜热酸性α-淀粉酶Gt-amy属于生淀粉α-淀粉酶,具有优良的高温活性和热稳定性,并且不依赖于Ca2+,可在淀粉液化工艺条件下有效酶解玉米淀粉[13]。因此Gt-amy在淀粉液化工艺具有巨大的应用潜力。Gt-amy的模拟分子结构显示其由结构域A、B和C三个结构域组成。利用NCBI网站的保守结构域数据库(Conserved Domain Database,CDD)对Gt-amy的保守结构域进行分析,结果显示结构域C中C-末端结构域(C-terminal domain,CTD,Lys470~Phe549)属于未知功能结构域[14]。 Gt-amy CTD由β片层结构组成,这符合B型CBM的结构 特征[15]。但是CTD的氨基酸序列与其他已知的CBM无序列相似性,因此无法通过序列分析推断其功能。本研究通过对Gt-amy CTD进行缺失突变确定其在Gt-amy结合和降解生淀粉中的作用。在此基础上,对CTD中色氨酸残基Trp进行定点突变,通过比较CTD与突变体的生淀粉结合能力,确定CTD中参与生淀粉结合的氨基酸残基。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli)JM109、枯草芽孢杆菌(Bacillus subtilis)WB600、枯草芽孢杆菌表达载体pSTOP1622、Gt-amy表达载体pSTOP1622-gtamyhds均由本实验室保存;K O D-P l u s-n e o D N A 聚合酶 日本Toyobo公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega BioTek公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker 美国Fermentase公司;Chelating SepharoseTMFast Flow 美国GE Healthcare公司;Bradford法蛋白浓度测定试剂盒、木糖、咪唑 生工生物工程(上海)股份有限公司;玉米淀粉 美国Sigma公司;试剂均为国产分析纯。
1.2 仪器与设备
Mastercycler gradient聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Eppendorf公司;SCIENTZ-IID超声波细胞破碎仪 宁波新芝生物科技股份有限公司;TY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC紫外-可见分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 生物信息学分析
以来源于Bacillus stearothermophilus的α-淀粉酶BstA(PDB ID:1hvxA)的蛋白质分子结构为模板[16],采用Swiss-Model(http://swissmodel.expasy.org)模建Gt-amy(Ala35~Phe516)的蛋白质分子结构[17]。采用NCBI的在线软件BLASTP和CDD对蛋白序列进行相似性分析和结构域预测(https://www.ncbi.nlm.nih.gov/cdd)。从CAZy(Carbohydrate-Active Enzyme)数据库(http://www.cazy.org/Carbohydrate-Binding-Modules.html)中搜索获得已知生淀粉酶的SBD序列[18]。采用ClustalX 2.0.8软件对CTD及SBD序列进行序列比对,并采用MEGA 5.2建立系统进化树。
1.3.2 重组质粒pSTOP1622-gtamy-Th和pSTOP1622-ctdh的构建及鉴定
以重组质粒pSTOP1622-gtamyhds为模板,采用引物P1和P2进行PCR扩增(表1),获得编码催化结构域的基因gtamy-Th。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,68 ℃延伸1 min,35 个循环;68 ℃延伸10 min。扩增产物经Bgl II和Sph I双酶切,连接至经相同酶切处理的载体pSTOP1622,构建重组质粒pSTOP1622-gtamy-Th。以重组质粒pSTOP1622-gtamyhds为模板,采用引物P3和P4进行PCR扩增(表1),获得编码CTD的基因ctdh。重组质粒pSTOP1622-ctdh的构建方法同上。采用限制性内切酶Bgl II和Sph I共同处理重组质粒鉴定是否有外源基因的插入。

表 1 用于构建重组质粒的引物Table 1 Sequences of primers used for the construction of recombinant plasmids
1.3.3 CTD相关定点突变体的构建及鉴定
根据QuikChange®点突变试剂盒的原理,结合 α-淀粉酶Gt-amy基因gtamy和拟突变的氨基酸位点设计引物W471A-F、W471A-R、W501A-F、W501A-R、W514A-F、W514A-R、W526A-F、W526A-R、W533A-F、W533A-R、W540A-F、W540A-R、W548A-F、W548A-R(表1),构建CTD相关定点突变体W471A、W501A、W514A、W526A、W533A、W540A、W548A、W501A/W514A。以定点突变体W501A/W514A的构建为例,以重组质粒pSTOP1622-ctdh为模板,采用引物W501A-F和W501A-R,进行PCR扩增得到包含载体序列和基因序列的线性片段。PCR扩增条件与1.3.2节中PCR扩增条件相同。扩增产物经Dpn I酶处理后,转化大肠杆菌JM109,将转化子涂布于卡那霉素抗性平板,筛选转化子,经测序鉴定是否为突变基因W501A。在此基础上,以pSTOP1622-ctdhW501A为模板,采用引物W514A-F和W514A-R,进行PCR扩增,重复以上实验步骤,获得重组质粒pSTOP1622-ctdhW501A/W514A。将重组质粒送至生工生物工程(上海)股份有限公司进行测序,并与对应基因序列进行比对确认。
1.3.4 重组蛋白质的诱导表达和纯化
将重组质粒分别转化枯草芽孢杆菌WB600,获得重组枯草芽孢杆菌并进行诱导表达。枯草芽孢杆菌WB600感受态细胞的制备和转化采用改进的Spizizen法[19]进行。重组蛋白质的诱导表达和纯化参照文献[20]进行。
利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)检测重组蛋白质,并采用Bradford法测定重组蛋白质含量[21]。
1.3.5 α-淀粉酶活力测定
将10 μL酶液与490 μL含1 g/100 mL可溶性淀粉的50 mmol/L 2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)缓冲液(pH 5.0)混合,于80 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[22]测定反应体系中还原糖量。酶活力定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为1 个酶活力单位(U)。
1.3.6 α-淀粉酶的动力学常数测定
用50 mmol/L MES缓冲液(pH 5.0)配制不同质量分数可溶性淀粉溶液或玉米淀粉溶液(0.1%、0.2%、0.5%、1%、1.5%、2%、3%、4%、5%),分别向可溶性淀粉溶液或玉米淀粉溶液中加入等量的酶液,按照1.3.5节方法测定酶活力。根据双倒数作图法,以底物浓度的倒数为横坐标,以酶比活力的倒数为纵坐标作图,直线的斜率为Km/Vmax,截距为1/Vmax,计算以可溶性淀粉或玉米淀粉为底物时的米氏常数Km、反应常数kcat。
1.3.7 重组蛋白质对玉米淀粉结合率及降解率的测定
用0.5 mL 50 mmol/L MES缓冲液(pH 5.0)配制玉米淀粉溶液(其中玉米淀粉质量分别为0、25、50、75、100、125、150 mg),分别向玉米淀粉溶液中加入50 μL 60 μmol/L的重组蛋白质,混合体系在20 ℃恒温振荡培养箱孵育3 h,振荡速率为180 r/min。待孵育结束后,将反应液于12 000×g离心10 min,分别收获沉淀和上清液,然后采用Bradford法测定上清液中重组蛋白质的质量浓度。结合率计算如式(1)所示:
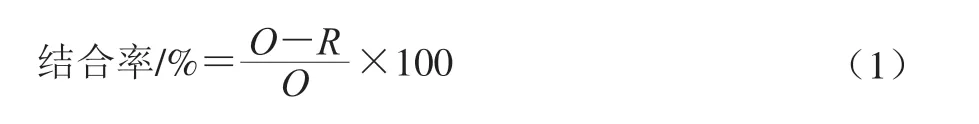
式中:R为上清液中重组蛋白质质量;O为初始重组蛋白质质量。
取30 g/100 mL玉米淀粉的50 mmol/L MES缓冲液(pH 5.0)与0.1 U/mg(以淀粉质量计)的酶液混合,于60 ℃反应3 h后,用DNS法测定上清液中还原糖量。玉米淀粉降解率如式(2)所示:

1.3.8 CTD对玉米淀粉结合能力的测定
取30 g/100 mL生玉米淀粉的50 mmol/L MES(pH 5.0)缓冲液与30 μg的CTD混合,混合体系在20 ℃的恒温振荡培养箱孵育3 h,振荡速率为180 r/min。孵育结束后,12 000×g离心10 min,获得沉淀和上清液,用于SDS-PAGE检测。
1.3.9 玉米淀粉的扫描电镜观察
取5 g/100 mL玉米淀粉的50 mmol/L MES(pH 5.0)缓冲液与0.1 U/mg(以淀粉质量计)的酶液混合,于60 ℃反应3 h后,12 000×g离心10 min,获得沉淀。用无水乙醇洗涤沉淀3 次后,将沉淀置于玻璃器皿中自然风干。使用离子溅射仪Ion Sputter E-1010于5.0 kV和20 mA的条件下处理淀粉颗粒喷40 s,使淀粉颗粒表面镀Pt,然后采用VEGA3-TESCAN扫描电镜观察和拍照。
1.4 数据处理
生淀粉α-淀粉酶的酶学性质研究中,每个实验做3 个平行。运用软件SigmaPlot 12.5对实验数据进行统计分析并作图,数据均以±s表示。
2 结果与分析
2.1 Gt-amy的结构域和序列分析
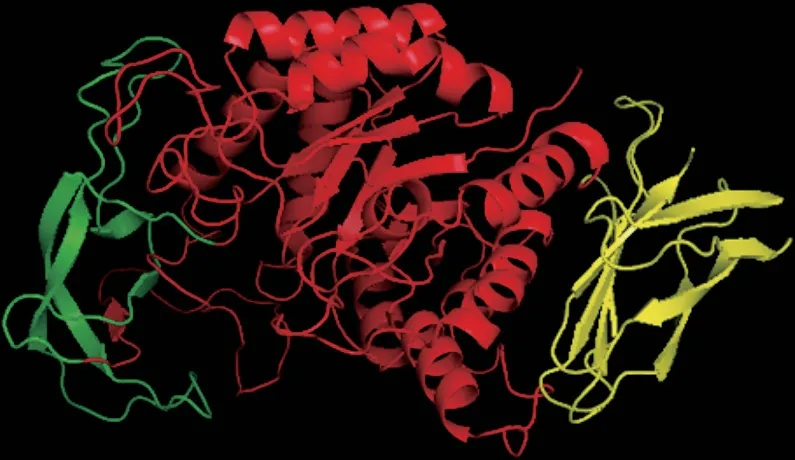
图 1 Gt-amy的三级结构显示图Fig. 1 Tertiary structure of Gt-amy
如图1所示,Gt-amy的三级结构由3 个结构域组成,即结构域A(Ala35~Asp139和Asp241~Tyr430)、结 构 域B ( H i s 1 4 0 ~A s n 2 4 0 ) 和 结 构 域C(Gly431~Phe549)。采用NCBI的在线软件CDD对 Gt-amy的蛋白质序列进行相似性分析和结构域预测,结果显示Gt-amy中不存在可能的SBD。同时保守结构域搜索结果显示Gt-amy的CTD(Lys470~Phe549)为未知功能结构域(domain of unknown function,DUF1939,CDD286264)。由图1可以看出,CTD由β片层结构组成,CTD的结构特点与B型CBM的结构特点相符。但是CTD与来源于不同CBM家族(CBM20、CBM25、CBM26、CBM41、CBM48、CBM69)的SBD序列以及一些α-淀粉酶结构域C的系统进化关系(图2)显示,CTD与来源于Bacillus licheniformis的α-淀粉酶BLA结构域C的进化关系最近,CTD与其他SBD序列的进化关系较远。并且CTD与SBD的序列比对结果显示CTD与已知的SBD无明显序列相似性(结果未显示)。以上结果表明,CTD不属于典型的SBD,由结构域和序列分析无法预测CTD的功能。因此,本研究通过对Gt-amy CTD进行缺失突变,并比较Gt-amy与CTD缺失突变体Gt-amy-T对生淀粉的结合能力和降解能力确定CTD的功能。
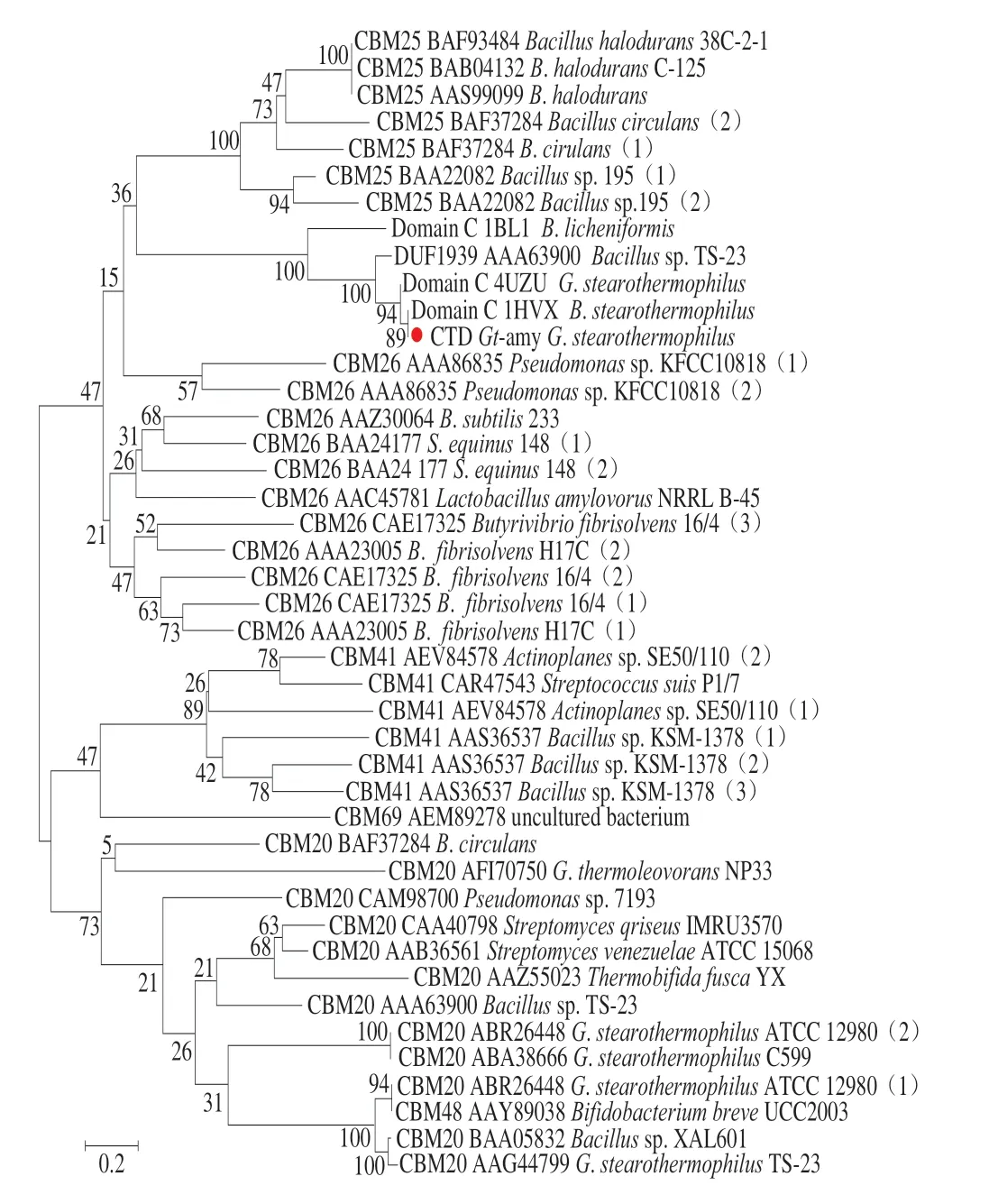
图 2 CTD的系统进化分析Fig. 2 Phylogenetic analysis of the CTD of Gt-amy
2.2 重组蛋白质Gt-amy、Gt-amy-T及CTD的表达与纯化

图 3 重组蛋白质结构模式图及SDS-PAGE图Fig. 3 Schematic representation and SDS-PAGE analysis of the recombinant proteins
重组蛋白质的表达与纯化结果如图3所示。目的蛋白质Gt-amy、Gt-amy-T以及CTD均得到成功表达,且主要位于细胞可溶成分中。采用Ni2+亲和层析柱对重组细胞可溶成分中的目的蛋白质进行纯化,得到纯化后的重组蛋白质Gt-amy、Gt-amy-T以及CTD。Gt-amy、Gt-amy-T和CTD的表观分子质量分别约为56、47、9 kDa,三者的大小均与理论值相符。
2.3 重组蛋白质Gt-amy、Gt-amy-T及CTD对玉米淀粉的结合率和降解率
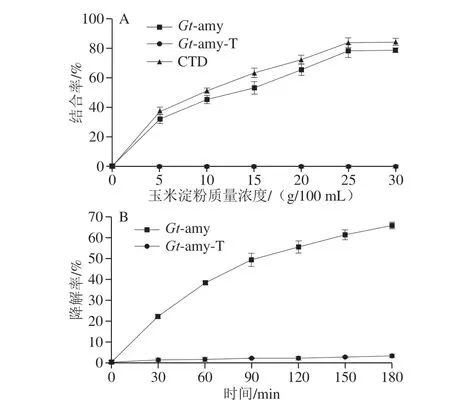
图 4 CTD对玉米淀粉结合率(A)及降解率(B)的影响Fig. 4 Effect of the CTD on raw corn starch adsorption (A) and hydrolysis (B)
为研究CTD对Gt-amy结合玉米淀粉的影响,本研究比较了重组蛋白质Gt-amy、Gt-amy-T及CTD对玉米淀粉的结合率,结果如图4A所示。随着反应体系中玉米淀粉质量浓度的提高,Gt-amy及CTD对玉米淀粉的结合率也逐渐提高,而Gt-amy-T不能结合玉米淀粉。当反应体系中玉米淀粉质量浓度达到30 g/100 mL时,Gt-amy及CTD对玉米淀粉的结合率达到最高,其中Gt-amy对玉米淀粉的结合率为78.8%,CTD对玉米淀粉的结合率为84.5%。在玉米淀粉质量浓度为0~30 g/100 mL范围内,CTD对玉米淀粉的结合率均高于Gt-amy,这可能是由于CTD是小分子蛋白质,与Gt-amy相比,CTD更易与玉米淀粉颗粒结合。
以上研究结果表明,CTD具有结合玉米淀粉的能力,并且CTD介导Gt-amy结合玉米淀粉。对于含有SBD或生淀粉结合结构区域的生淀粉酶,缺失该结构会影响生淀粉酶的生淀粉结合率。但该区域的缺失对不同淀粉酶的生淀粉降解率的影响不同。例如,对于来源于L. amylovorus的α-淀粉酶[23]以及来源于G.thermolovorans的α-淀粉酶Gt-amyII[24],SBD缺失突变体或CTD缺失突变体完全丧失了降解生淀粉的能力。对于来源于Bacteroides thetaiotaomicron的α-淀粉酶SusG,其SBD缺失突变体对生淀粉的比酶活力约为SusG的30%[25]。而对于来源于Bacillussp. TS-23的α-淀粉酶[26]和来源于Thermoanaerobacter ethanolicus39E的淀粉普鲁兰酶[27],SBD的缺失不影响其生淀粉降解能力。这说明对于一些淀粉酶,其生淀粉结合域并不是降解生淀粉所必需的。已有研究表明,生淀粉α-淀粉酶的结构域C参与生淀粉的结合,例如结构域C of barely α-amylase[28],结构域C of Gt-amyII[24]。此外,来源于B. licheniformis的 α-淀粉酶BLA已被证实可有效降解玉米淀粉[29-30],其结构域C与Gt-amy CTD进化关系较近(图2),BLA的结构域C中是否也结合生淀粉则有待证实。另外,一些特殊的生淀粉酶不含有生淀粉结合域,却可以降解生淀粉,可能原因是其分子结构中存在生淀粉结合位点[31]。
为研究CTD对Gt-amy降解玉米淀粉的影响,比较 Gt-amy及Gt-amy-T对30 g/100 mL玉米淀粉的降解率。考虑到玉米淀粉的糊化开始温度为64 ℃,将反应体系置于60 ℃进行反应。由图4B可以看出,Gt-amy和Gt-amy-T对玉米淀粉的降解率随时间的延长而提高。当反应时间达到3 h,Gt-amy对玉米淀粉的降解率为65.8%;而 Gt-amy-T对玉米淀粉的降解率仅为2.8%。此外,扫描电镜观察结果(图5)显示,经Gt-amy处理后的玉米淀粉可观察到明显的被降解现象;而经Gt-amy-T处理后的玉米淀粉则无明显变化。以上研究结果均表明,Gt-amy可有效酶解玉米淀粉,Gt-amy-T不能酶解玉米淀粉。这说明CTD在Gt-amy酶解玉米淀粉过程中发挥重要作用。

图 5 玉米淀粉的扫描电镜图Fig. 5 SEM images of raw corn starch before and after enzymatic hydrolysis at 60 ℃ for 3 h
综合以上研究结果,Gt-amy可有效地结合和降解玉米淀粉,而其CTD缺失突变体Gt-amy-T不能结合和降解玉米淀粉。这表明,虽然CTD不属于典型的SBD,但是CTD在Gt-amy结合和酶解玉米淀粉中发挥重要作用。
2.4 CTD中生淀粉结合位点的确定

图 6 生淀粉结合位点突变体对玉米淀粉的结合Fig. 6 Corn starch binding capacities of raw starch binding site mutants
Gt-amy CTD可有效结合玉米淀粉,CTD中可能存在生淀粉结合位点。目前已知的SBD中参与生淀粉结合的芳香族氨基酸残基均为色氨酸。为确定CTD中生淀粉结合位点,将CTD中色氨酸残基Tyr定点突变为丙氨酸残基Ala,并比较CTD与W→A定点突变体对玉米淀粉的结合。根据QuikChange®点突变试剂盒的原理,构建CTD的W→A定点突变体W471A、W501A、W514A、W526A、W533A、W540A、W548A,在枯草芽孢杆菌表达系统中表达各突变体,并采用Ni2+亲和层析纯化各突变体。如图6所示,与CTD相比,突变体W526A和W540A对玉米淀粉的结合率基本不变,突变体W471A、W533A及W548A对玉米淀粉的结合率略有下降,突变体W501A和W514A对玉米淀粉的结合率明显降低。在此基础上,本研究构建双位点突变体W501A/W514A,并检测该突变体对玉米淀粉的结合。如图6所示,突变体W501A/W514A对玉米淀粉的结合率显著下降。根据以上研究结果,可以确定CTD中W501和W514可能是生淀粉结合位点。
2.5 重组蛋白质Gt-amy及Gt-amy W501A/W514A对玉米淀粉的结合率和降解率
图 7 Gt-amy及突变体Gt-amy W501A/W514A的SDS-PAGE图Fig. 7 SDS-PAGE analysis of Gt-amy and Gt-amy W501A/W514A
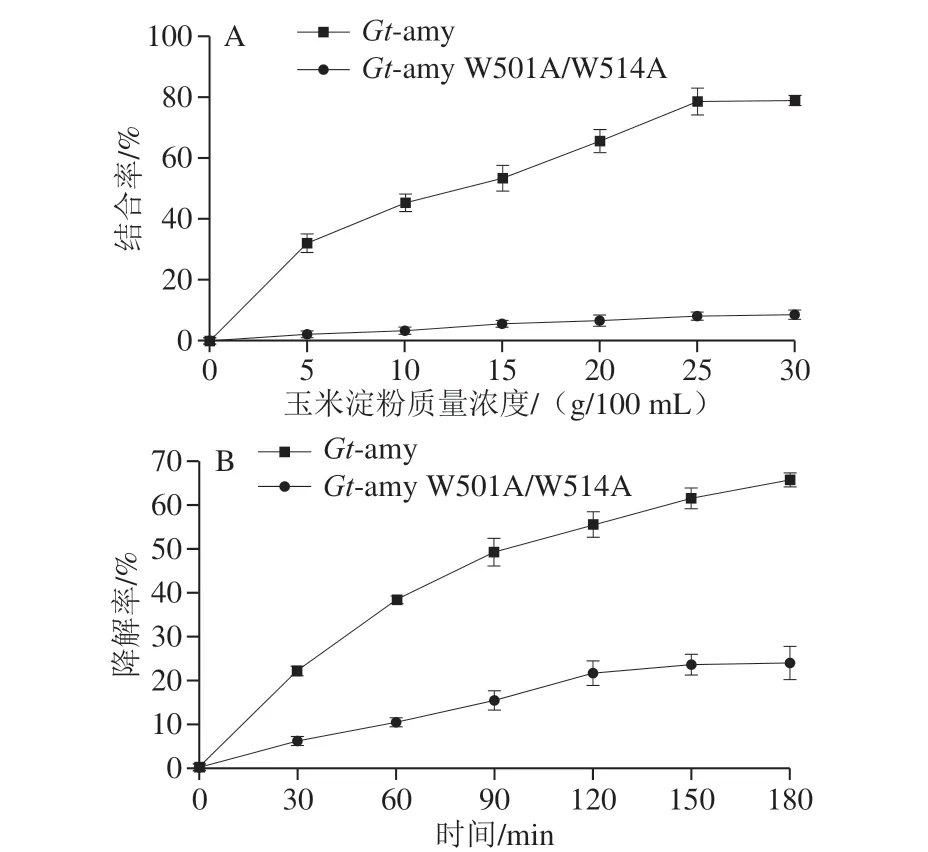
图 8 生淀粉结合位点对玉米淀粉结合率(A)及降解率(B)的影响Fig. 8 Effect of raw starch-binding site on raw corn starch adsorption (A) and hydrolysis (B)

图 9 玉米淀粉的扫描电镜图Fig. 9 SEM images of raw corn starch before and after enzymatic hydrolysis at 60 ℃ for 3 h
为确定生淀粉结合位点W501及W514对Gt-amy结合和降解玉米淀粉的影响,构建突变体Gt-amy W501A/W514A,对Gt-amy W501A/W514A进行表达与纯化 (图7),并比较Gt-amy及Gt-amy W501A/W514A对玉米淀粉的结合率和降解率(图8)。与Gt-amy相比,Gtamy W501A/W514A对玉米淀粉的结合率和降解率均明显降低。其中,当玉米淀粉质量浓度达到30 g/100 mL时,Gt-amy W501A/W514A对玉米淀粉的结合率为8.5%,约为Gt-amy的10.8%;当反应时间达到180 min时, Gt-amy W501A/W514A对玉米淀粉的降解率为25.8%,约为Gt-amy的39.2%。此外,从玉米淀粉的扫描电镜图 (图9)也可以看出,Gt-amy及Gt-amy W501A/W514A均可降解玉米淀粉,但是经Gt-amy处理后的玉米淀粉残留量较经Gt-amy W501A/W514A处理后的玉米淀粉残留量明显偏少,这表明Gt-amy W501A/W514A对玉米淀粉的降解率明显降低。以上结果表明,对Gt-amy CTD中生淀粉结合位点W501和W514进行突变,影响Gt-amy对玉米淀粉的结合和酶解。
2.6 CTD和生淀粉结合位点W501、W514对Gt-amy催化活性的影响
比较Gt-amy、CTD缺失突变体Gt-amy-T以及生淀粉结合位点突变体Gt-amy W501A/W514A对可溶性淀粉和玉米淀粉的动力学常数,以此确定CTD和生淀粉结合位点W501、W514对Gt-amy催化活性的影响。从表2可以看出,以可溶性淀粉为底物时,与Gt-amy相比, Gt-amy-T对可溶性淀粉的Km未明显改变,kcat值明显降低,即Gt-amy-T的可溶性淀粉结合能力未明显改变,以可溶性淀粉为底物时的反应速率明显下降,约为Gt-amy的77.9%;Gt-amy W501A/W514A对可溶性淀粉的Km及kcat值均未明显改变。以玉米淀粉为底物时,与Gt-amy相比,Gt-amy-T不能酶解玉米淀粉;Gt-amy W501A/W514A对玉米淀粉的Km提高至约4.2 倍,kcat值降低了55%,即Gt-amy W501A/W514A的玉米淀粉结合能力明显降低,以玉米淀粉为底物时的反应速率也明显降低。以上研究结果表明,CTD的缺失突变不仅导致Gt-amy丧失酶解生淀粉的能力,还使其对可溶性淀粉的降解能力下降;生淀粉结合位点W501、W514的突变不影响Gt-amy对可溶性淀粉的催化活性,但影响Gt-amy对玉米淀粉的结合和酶解。
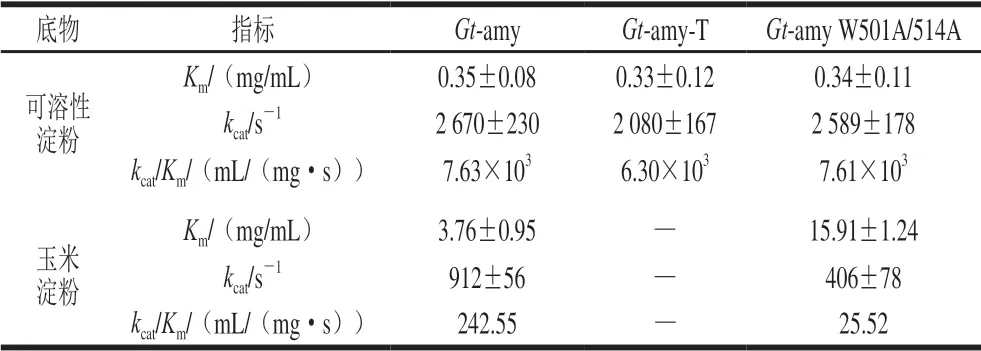
表 2 重组α-淀粉酶的动力学常数Table 2 Kinetic parameters of recombinant α-amylase
据文献报道,α-淀粉酶AmyP的SBD对其可溶性淀粉酶活影响显著,SBD缺失突变体AmyPΔSBD的可溶性淀粉酶活下降了80%[32]。本研究CTD缺失突变体 Gt-amy-T的可溶性淀粉酶活力也低于Gt-amy。也有研究表明SBD的缺失不影响一些生淀粉酶的可溶性淀粉酶活力,如来源于Bacillussp. TS-23的α-淀粉酶[26]和来源于T. ethanolicus39E的淀粉普鲁兰酶[27]。此外,SBD的缺失有利于提高一些生淀粉酶的可溶性淀粉酶活力,如来源于B. thetaiotaomicron的α-淀粉酶SusG[25]和来源于Bacillussp. 195的α-淀粉酶[33]。SBD或生淀粉结合结构区域对淀粉酶的可溶性淀粉酶活力产生不同影响,可能原因是该结构的缺失导致酶分子结构发生了不同的变化。
3 结 论
本研究通过分析Gt-amy、CTD缺失突变体Gt-amy-T和生淀粉结合位点突变体Gt-amy W501A/W514A的玉米淀粉结合率和降解率,确定了CTD的功能和CTD中生淀粉结合位点。CTD属于生淀粉结合结构域,在Gt-amy结合和酶解生淀粉中发挥重要作用,并且CTD影响Gt-amy的可溶性淀粉酶活力,CTD有利于Gt-amy发挥可溶性淀粉酶活力;CTD中氨基酸位点W501和W514可能是生淀粉结合位点,参与生淀粉结合。Gt-amy CTD不属于典型的SBD,却具有生淀粉结合能力,并对Gt-amy的酶学性质产生影响。本研究不仅拓展了对生淀粉结合结构域的结构和功能的了解,也为其他α-淀粉酶的酶学性质优化提供新的理论依据和设计思路。

