伴嗜酸性粒细胞增高慢性阻塞性肺疾病急性加重期肺功能及影像学特征
魏 霞,李 洁,丁 琦,许淑娣,米九运,任京婷,李瑞丽,姚 静,金晨望,郭佑民
(1.西安市第九医院呼吸与危重症医学科,陕西 西安 710054;2.西安交通大学第一附属医院医学影像科,陕西 西安 710061)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是世界范围重大疾病之一,对社会带来经济和健康双重负担[1]。2015年流行病学调查显示我国40岁以上人群COPD发病率高达13.7%[2]。COPD急性加重(acute exacerbation of COPD, AECOPD)定义为呼吸症状急性恶化,导致需要额外治疗[3],是COPD管理中占据医疗资源最多的部分。我国COPD总死亡人群占全球的31.1%[4],急性加重是导致死亡的重要原因,因此,预测管理AECOPD具有重要意义。COPD全球倡议(global initiative for chronic obstructive lung disease, GOLD)自2017年起增加了血嗜酸性粒细胞(eosinophil, EOS)作为预测急性加重的标志物,GOLD 2019和2020更新提出血EOS界值及其对于指导吸入糖皮质激素(inhaled glucocorticoids, ICS)治疗的价值。本研究探讨外周血EOS增高的AECOPD与肺功能参数、影像学参数的关系,旨在识别其特征,为临床治疗提供参考。
1 资料与方法
1.1 一般资料 回顾性分析2014年10月—2017年9月西安市第九医院收治的357例AECOPD患者,均符合GOLD诊断标准,即吸入支气管舒张剂后第1秒用力呼气容积(forced expiratory volume in one second, FEV1)占用力肺活量(forced vital capacity, FVC)的百分比(FEV1/FVC)<70%;其中男316例,女41例,年龄41~93岁,平均(68.3±10.3)岁;根据入院时血常规检查EOS绝对计数分为2组,将EOS≥300/μl者归入研究组,以<300/μl者为对照组。排除标准:年龄<40岁;孕妇;合并其他肺病如肺癌、肺炎等;既往肺部手术史;无法配合肺功能检查。
1.2 方法
1.2.1 人口学和临床资料 收集性别、年龄、吸烟状况、体质量指数(body mass index, BMI)和过去12个月因AECOPD住院次数等资料,入院时患者自主完成COPD评估测试(COPD assessment test, CAT)和医学研究委员会呼吸困难量表(modified medical research council dyspnea scale, mMRC)评分。采用BC-6800全自动血液分析仪,以鞘流阻抗法、激光放射法结合荧光颜色的流式细胞计数方法检测炎症指标,包括白细胞计数(white blood cell count, WBC)、中性粒细胞比率(neutrophil ratio, N%)及EOS比率(eosinophil ratio, E%);以Siemens全自动蛋白分析仪以散射比浊法检测C反应蛋白(C reactive protein, CRP);采用STA-R凝血分析仪以凝固法检查纤维蛋白原(fibrinogen, FIB);以Coapresta 2000全自动凝血分析仪用乳胶免疫比浊法检测D二聚体(D-dimer)和纤维蛋白降解产物(fibrin degradation products, FDP);按检验标准执行质控。
1.2.2 肺功能检查 于患者出院前无喘息症状时检测肺功能,依序进行脉冲振荡阻力测定(impulse oscillometry system, IOS)、流速容积曲线测定以及一口气弥散法测量弥散功能及支气管舒张试验;对符合质控要求者[5-6]记录传统肺功能参数,包括第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、FEV1/FVC、一氧化碳弥散量(carbon monoxide diffusing capacity, DLCO)与肺活量(vital capacity, VC)比值(DLCO/VC)、残气量(residual volume, RV)与肺总量(total lung capacity, TLC)比值(RV/TLC)以及最大呼气中期流速(MMEF25%-75%pred);同时记录IOS参数包括阻抗指标呼吸总阻抗占预计值百分比(Z5%pred)、呼吸道总黏性阻力(R5)、呼吸道总黏性阻力占预计值百分比(R5%pred)、中心气道黏性阻力(R20)、中心气道黏性阻力占预计值百分比(R20%pred)、周边气道黏性阻力(R5-R20)和电抗参数X5、响应频率Fres及电抗面积Ax。
1.2.3 64排容积CT检查 采用Siemens SOMATOM 64排容积CT机,行仰卧位吸气末屏气扫描,扫描参数:管电压120 kV,管电流自动调节,曝光时间0.5 s,矩阵512×512。使用标准内核算法连续重建图像,层厚1 mm(重叠0.625 mm)。
利用影像学测量软件,于“数字肺”平台[7-8]采用骨架提取算法对支气管进行三维分割,提取各级支气管骨架,并自动测量支气管参数。肺实质分析包括自动分割叶间裂、测定全肺及各肺叶肺密度和肺容积。定量分析肺气肿时,先使用三维边界自适应推算法计算整个肺容积,再用几何算法分割叶间裂;个别叶裂以隐式曲面函数确定。“数字肺”平台自动分析并记录以下参数:各叶第4~9代支气管壁面积百分比(支气管壁横截面积占支气管横截面积的比例,WA%),肺气肿指数(emphysema index,EI)[指CT值小于-950 HU的低衰减区(low attenuation area, LAA)占肺体积的比例(LAA%-950)],肺组织CT值分布频率图中第15百分位点所对应的CT值(PD15),平均肺气肿密度(mean emphysema density, MED)[指CT值小于-950 HU的LAA平均密度],平均肺密度(mean lung density, MLD)(特定肺体积内的平均密度);肺体积是吸气相测定的肺容积;肺气肿异质性指数(emphysema heterogeneity index, HI)[8-9]表示肺气肿分布情况,变化范围-1~+1。HI=(上肺叶肺气肿指数-下肺叶肺气肿指数)/(上肺叶肺气肿指数+下肺叶肺气肿指数)×100%。数值靠近+1表示上肺肺气肿优势;靠近-1表示下肺肺气肿优势;靠近0表示肺气肿在上下肺分布均匀。
1.3 统计学分析 采用SPSS 22.0统计分析软件。以Kolmogorov-Simimov非参数检验判断计量资料是否符合正态分布,对符合数据以±s表示,不符合数据表达为中位数(上下四分位数),用Mann-WhitneyU检验进行组间比较。分类资料表示为比例,以χ2检验进行组间统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 AECOPD临床参数 研究组N%较对照组低(64.70% vs 73.00%,P<0.001);FIB(3.59 vs 3.97,P=0.031)、CRP较低(3.30 mg/L vs 8.63 mg/L,P=0.012)及吸烟量亦均低(25包/年 vs 40包/年,P=0.009); 但2组患者年龄、CAT评分、mMRC、BMI差异均无统计学意义(P均>0.05,表1)。
2.2 AECOPD肺功能参数 研究组RV/TLC低于对照组(51.91% vs 57.44%,P=0.041), FEV1/FVC(55.00% vs 46.25%)、FEV1%pred(57.21% vs 53.84%)和DLCO/VA(87.70% vs 78.90%)均较好,但差异无统计学意义(P均>0.05)。
IOS中,研究组R5(0.56 vs 0.49,P=0.036)和R5%pred(178.65% vs 155.70%,P=0.027)高于对照组,而Z5%pred、R20、R20%pred、R5-R20、X5、Fres和Ax差异均无统计学意义(P均>0.05,表2)。
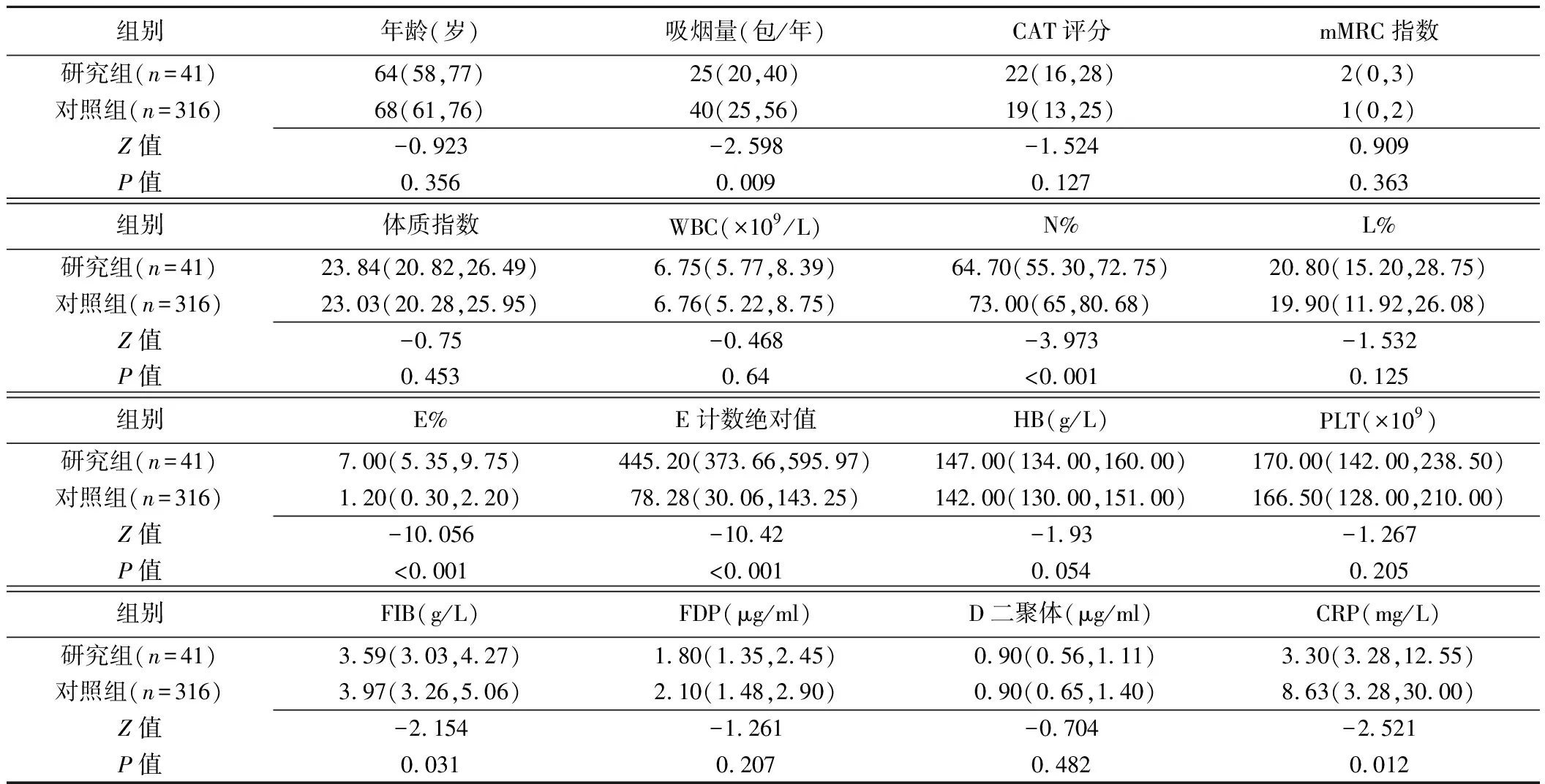
表1 组间AECOPD临床参数比较
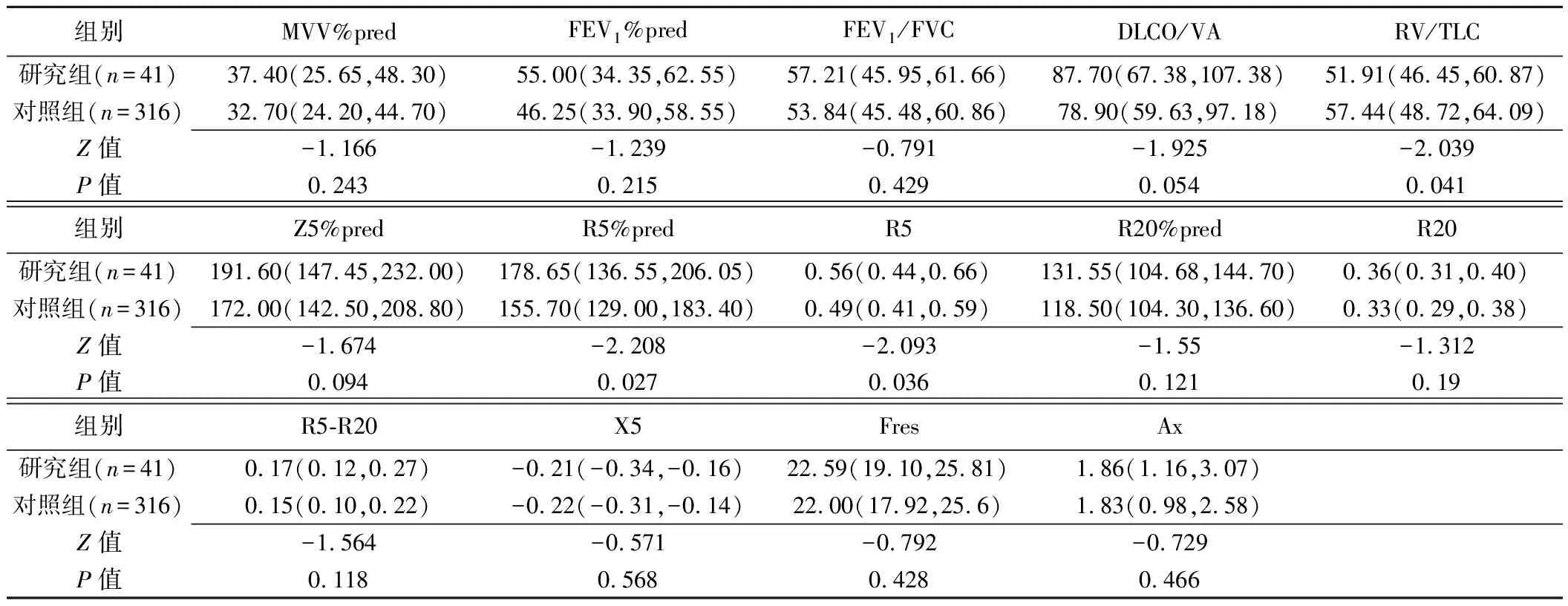
表2 组间两种肺功能检查参数比较
2.3 各组影像学参数 研究组全肺、右肺和左肺的MED和PD15均高于对照组(P均<0.05),见图1、2;肺体积、EI、MLD和HI差异均无统计学意义(P均>0.05),见表3。2组WA%在右上叶、右中叶和左上叶第4~7代支气管以及右下叶和左下叶第4~9级支气管差异均无统计学意义(P均>0.05)。
3 讨论
COPD为复杂异质性疾病,识别对治疗具有最佳反应的表型对临床决策具有重要意义,使得识别治疗表型的生物标志物成为研究的重要部分[10]。COPD的本质是慢性炎症性疾病,大多数主要是中性粒细胞炎症,有些会出现EOS计数增加,COPD具有EOS表型,可能由TH2细胞和2型先天性淋巴样细胞通过上皮细胞释放IL-33引起,故对ICS的反应更强[11]。研究[10]发现,外周血EOS相对值偏低的COPD易发肺部感染,而EOS是关键的先天免疫细胞,在宿主防御中发挥抗感染作用。
目前临床通过肺功能诊断COPD,以肺功能受损程度为判定COPD严重程度的重要指标。用力肺活量测定和支气管舒张试验是我国及世界范围内诊断并监测COPD的传统方法,但有其局限性,尤其要求患者能配合良好,呼吸困难者难以完成检查。脉冲振荡阻力对配合度要求低,平静呼吸即可完成,对于反映气道阻塞性疾病阻力分布有独特价值[12]。多层螺旋CT(multi-slice spiral CT, MSCT)容积扫描及薄层重建成像技术使呼吸系统成像极其接近解剖学,形态学改变可反映功能变化,对COPD表型分型等具有重要价值。前期研究[13-14]显示,联合影像学结构改变与功能学改变,结合临床特征,可更精准判断特定AECOPD特征。
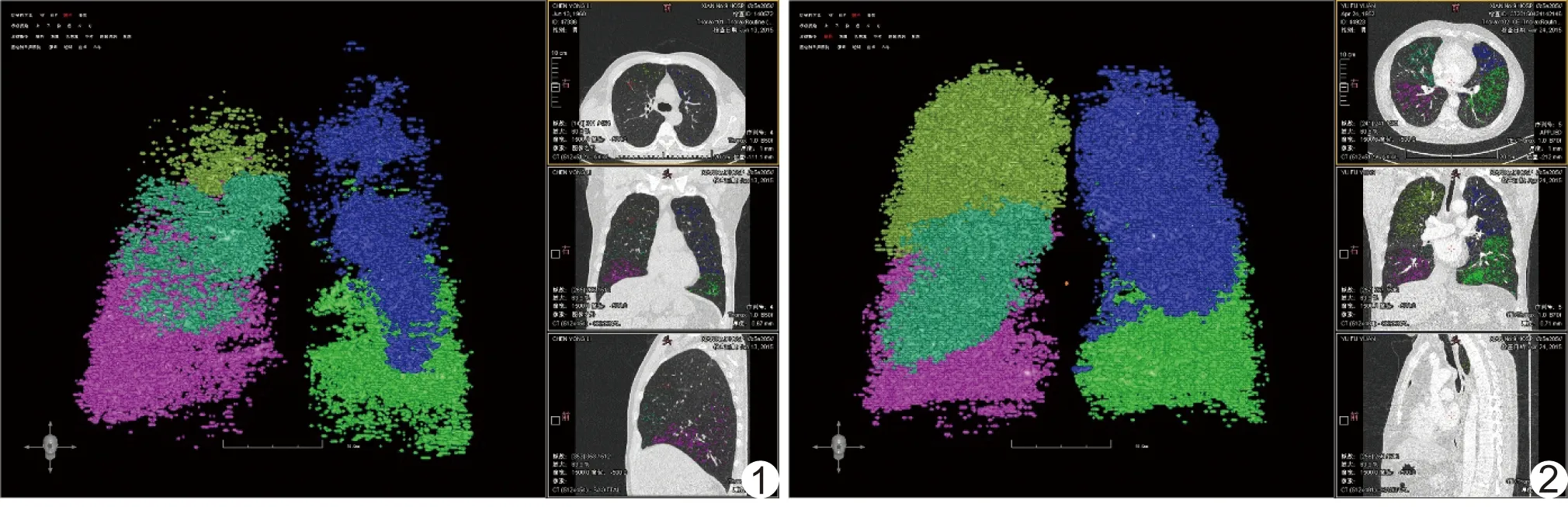
图1 患者男,55岁,研究组数字肺图像 EOS=539/μl,FEV1%pred=28.40%,FEV1/FVC=46.83%,MED=-979.65 HU,PD15=-1 004 HU 图2 患者男,63岁,对照组数字肺图像 EOS=42/μl,FEV1%pred=21.7%,FEV1/FVC=38.01%,MED=-991.2 HU,PD15=-1 023 HU

表3 组间影像学参数比较
本研究中研究组中性粒细胞和非特异炎症指标均偏低,提示中性粒细胞相关炎症反应偏低。既往研究[15]发现吸烟者EOS下降,香烟烟雾与中性粒细胞活性增加相关;本研究中研究组吸烟量亦偏低。本研究肺功能结果提示研究组气道阻力增加,以气道病变为主,并经影像学检查证实;肺容积增加提示存在气体潴留,全肺、右肺和左肺的肺气肿程度指标(MED和PD15)在对照组更严重,而反映肺气肿范围的指标(EI)组间并无显著差异,原因可能在于对照组炎症以中性粒细胞为主,其所释放的弹性蛋白酶引起的肺实质破坏更为严重;肺功能和影像学检查显示研究组气道病变明显,提示对于此类患者应加强扩张支气管治疗,而针对对照组以中性粒细胞为主的COPD亚型则应以抗氧化抗炎症反应为治疗重点。
本研究中EOS≥300/μl的病例数远低于既往文献报道[10,16],原因可能在于中国COPD人群特征,即发病与吸烟、环境污染密切相关。识别治疗表型的标记物,尤其中国EOS COPD患者尚需更多临床研究。

