miR-155对人脐静脉内皮细胞增殖与迁移的影响
郑小兰 邱大健 张 怡
微小RNA(miRNA)是由RNA聚合酶Ⅱ转录的长度约22nt的内源性单链非编码RNA分子,序列具有高度保守型,在组织和细胞中特异性高,自1993年蠕虫秀丽隐杆线虫首次发现以来,已有大量研究表明miRNA可在各个生理过程如生物发育、脂肪代谢,细胞过程如细胞分化、增殖和凋亡中发挥重大作用,在血管生成、病变以及心血管疾病等过程中亦可发挥重要作用[1~3]。近年来研究发现,microRNA-155(miR-155)在血管相关疾病的发生、发展中发挥至关重要的作用[4]。同时,miR-155也参与了天然免疫应答和特异性免疫应答,其在活化的各种免疫细胞中表达普遍升高,是免疫系统最主要的miRNA之一[5]。miR-155转录来自于21号染色体B细胞整合簇区域,对应的是非编码RNA的一个外显子,主要表达在造血细胞。miR-155可调节巨噬细胞,血管平滑肌细胞及内皮细胞等多种细胞的生物学功能[6,7]。然而,关于miR-155对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖与迁移功能的影响尚不清楚。本研究探讨了miR-155对HUVEC增殖与迁移功能的影响。
材料与方法
1.材料:HUVEC购自中国科学院武汉生物细胞库;DMEM培养基、胎牛血清(fetal bovine serum,FBS)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)均购自美国Hyclone公司;Lipofectamine 3000转染试剂购自美国Invitrogen公司;NucleoZOL试剂盒购自日本TaKaRa公司;0.25%胰蛋白酶购自美国Gibco公司;miR-155 mimic、mimic NC、 miR-155 inhibitor、inhibitor NC、miR-155及U6反转录和qRT-PCR引物均购自广州锐博生物科技有限公司;水溶性四唑盐(WST)试剂盒购自中国江苏碧云天生物技术公司。
2.HUVEC的培养和转染:HUVEC用含有100mg/L链霉素、1×105U/L青霉素、含10%FBS的DMEM培养基培养,置于37℃、5% CO2、饱和湿度培养箱中。细胞生长融合到培养板75%~80%时,将0.25%胰蛋白酶加入到培养板中进行消化,待内皮细胞皱缩变圆时,加入含10%FBS的培养基终止消化,1200×g、3min离心,收集已消化的细胞,在超净台中吸去上清,加入含10%FBS的DMEM培养基重悬,将细胞浓度调至细胞数为1×105/ml,均匀接种于6孔板(2毫升/孔)过夜后,细胞生长约40%~50%,弃去原培养液,PBS液清洗3次后换成无血清DMEM培养基。采用Lipofectamine 3000分别在HUVECs各组中转染miR-155 mimic、mimic NC、miR-155 inhibitor及inhibitor NC。饥饿处理6~8h后换成正常培养基继续培养48h后提取RNA进行检测。
3.qRT-PCR检测miR-155表达:按照NucleoZOL试剂盒说明书提取4组实验细胞总RNA,加入1ml异丙醇沉淀RNA,DEPC水溶解后,取RNA溶液1μl于Nano2000上检测RNA的浓度和纯度,取A260/280比值1.8~2.0为合格标准,可继续用于试验。按照反转录试剂盒说明书合成cDNA,并以cDNA作为模板进行qRT-PCR检测,以U6为内参,miR-155引物序列为:上游引物:5′-GGAGGTTAATGCTAATCGTGATAG-3′;下游引物:5′-GTGCAGGGTCCGAGGT-3′。qRT-PCR分析采用2-△△CT方法,实验重复3次。
4.WST-1检测HUVEC增殖活力:采用WST-1法检测各组细胞连续3天的增殖情况。96孔板每孔加入细胞密度为1×105/ml的HUVEC悬液100μl,每组设置3个复孔,在37℃、5%CO2培养箱内过夜培养使其贴壁,对各组细胞进行转染,转染方法如上述,分别于转染后0、24、48、72h对各组细胞增殖活力进行检测:每孔加入WST-1试剂10μl,培养箱避光孵育3~4h,用酶标仪检测450nm波长处的吸光度(A)值,试验重复3次。
5.细胞划痕实验检测HUVEC迁移能力:取对数生长期HUVEC配制成细胞悬液,调整细胞密度为每孔2×105/ml,接种于6孔板(2毫升/孔),过夜培养,待细胞贴壁、生长成单细胞层时,用200μl枪头垂直于孔板底面划痕,用PBS洗涤3次,然后对各组细胞进行转染,加入无血清DMEM培养基继续培养。分别于转染后0h和48h显微镜下观察细胞划痕宽度并拍照记录,利用Image J软件统计计算,迁移率(%)=(划痕0h后划痕宽度-划痕48h后划痕宽度)/划痕0h后划痕宽度,实验重复3次。

结 果
1.qRT-PCR检测miR-155的表达:miR-155过表达组的miR-155表达量明显高于对照组(P=0.003)。与对照组比较,miR-155抑制组miR-155表达量显著下降(P=0.000,图1)。
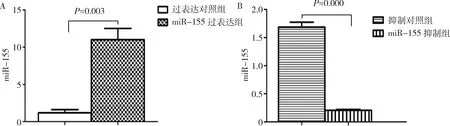
图1 qRT-PCR检测转染后各组miR-155表达量差异A.miR-155过表达;B.miR-155抑制
2.各组HUVEC的增殖活力比较:在24、48及72h,与对照组比较,miR-155过表达组WST-1检测A值皆显著降低(P<0.05)。与对照组比较,miR-155抑制组A值明显升高(P<0.05),详见表1。

表1 WST-1法检测各组细胞A值
3.miR-155对HUVEC迁移的影响:转染了miR-155 mimic的细胞经48h培养后其划痕愈合速度较对照组慢,而转染了miR-155 inhibitor的细胞划痕愈合情况明显优于其对照组,经Image J软件及SPSS 22.0统计学软件计算,miR-155过表达组与其对照组迁移率比值为0.65,miR-155抑制组与其对照组迁移率比值为1.26,各组之间迁移率比较差异有统计学意义(P<0.05),详见图2。

图2 转染后各组细胞迁移能力比较(光镜,×100)
讨 论
miRNA是一类内源性的小非编码RNA,可通过与编码蛋白质mRNA的非翻译区互补结合而抑制蛋白质翻译或降解多肽[8]。近年来大量研究发现,miRNA可参与调控细胞的增殖、迁移和凋亡等一系列过程,可以作为生物学标志物来检测各种疾病,包括癌症、心血管疾病和自身免疫性疾病[9~12]。血管内皮细胞是研究各种疾病,特别是血管相关疾病的重要细胞模型。而HUVEC因其具有分化潜能和新生血管内皮细胞特性,获取容易,所以目前对内皮细胞功能的了解大部分是基于HUVEC的研究[13]。本实验选用HUVEC为细胞模型,对进一步探索和理解miRNA对内皮细胞功能的影响有重要意义。
miR-155是一种典型的多功能miRNA,在众多血管细胞的调控中起着至关重要的作用[14]。多项研究表明miR-155在肿瘤、脓毒血症、免疫系统疾病、冠状动脉粥样硬化等多种疾病中发挥重要作用[15~17]。目前miR-155对内皮细胞功能的影响尚未完全阐明。miR-155可靶向作用于多种基因,调控机制复杂,容易受到机体状态的影响,故目前发现miR-155在不同的疾病中可发挥不同的作用[15~17]。本研究发现,miR-155过表达可抑制HUVEC的增殖与迁移功能,同时也验证了抑制miR-155的表达可增强HUVEC增殖和迁移功能。Wang等[18]研究发现,miR-155可通过调节肿瘤相关巨噬细胞的纤维母细胞生长因子-2的表达而抑制HUVEC血管系统的形成。Yin等[19]研究发现,miR-155可能通过靶向PI3K/Akt/mTOR通路而促进血管内皮细胞的自噬。Yee等[20]研究表明,miR-155可通过抑制肿瘤坏死因子-α和干扰素-γ表达而诱导内皮细胞程序性死亡配体-1的产生。这些机制都可能对内皮细胞的增殖和迁移功能造成影响。因此,miR-155对血管内皮细胞增殖与迁移的影响过程可涉及多种因素,其机制不仅仅是受单一分子或基因所调控,其具体分子机制尚不明确,有待于进一步研究。

