鱼源藤黄微球菌三重PCR检测法的建立及耐药性分析
(西南民族大学生命科学与技术学院,四川成都 610041)
藤黄微球菌(Micrococcusluteus)为微球菌科微球菌属的革兰氏阳性球菌,一般为单生、对生和多方向分裂形成四联体或不规则的立体菌落[1]。微球菌是一种被认为具有一定污染性的微生物,而藤黄微球菌是微球菌属中的主要致病微生物之一[2]。该菌广泛分布于土壤、空气、水体等生活环境以及动物体表,可定植于人类皮肤和口腔粘膜上,但该菌临床病例较为少见[2-4]。Fleming[5]发现藤黄微球菌在正常机体中会被吞噬细胞的溶菌酶杀灭。Ganz等[6]发现藤黄微球菌在小鼠缺乏M型溶菌酶的情况下更具有致病性。该菌可引起人类组织炎症、败血症、休克等和鱼类内脏、体表出血等疾病[2-4,7-10],对人类和动物健康均造成威胁[4]。因此,藤黄微球菌是一种在机体免疫力低下时才可能引起体表伤口组织或体内组织感染的条件致病菌。
目前,对藤黄微球菌的研究主要有致病性和在食品加工应用等方面,未见关于该菌的分子生物学检测法的报道。快速检测细菌的分子生物学检测技术主要有常规PCR技术、多重PCR技术。常规PCR技术主要是扩增细菌的一条特异性基因,而不同细菌间16S rDNA基因、23S rDNA基因序列具有一定同源性,这将对该检测方法的特异性产生一定的影响[3,11]。多重PCR技术具有高效性、系统性、经济简便性等特点,与常规PCR技术相比具有更高的特异性,在细菌快速检测方法有着重要的临床意义和广泛的应用前景[12-13]。在目前的研究中,国内未见检测该菌耐药基因的研究,国外仅Liebl等[14]研究了该菌大环内脂类抗生素耐药基因。而检测藤黄微球菌的耐药表型和耐药基因型,在防控该菌方面有着重要的意义。本实验鉴定发病黄颡鱼的病原,建立一种快速检测病原菌的方法并进行药物筛选,以期为防控由该菌引起的人和动物的食源性感染提供理论依据。
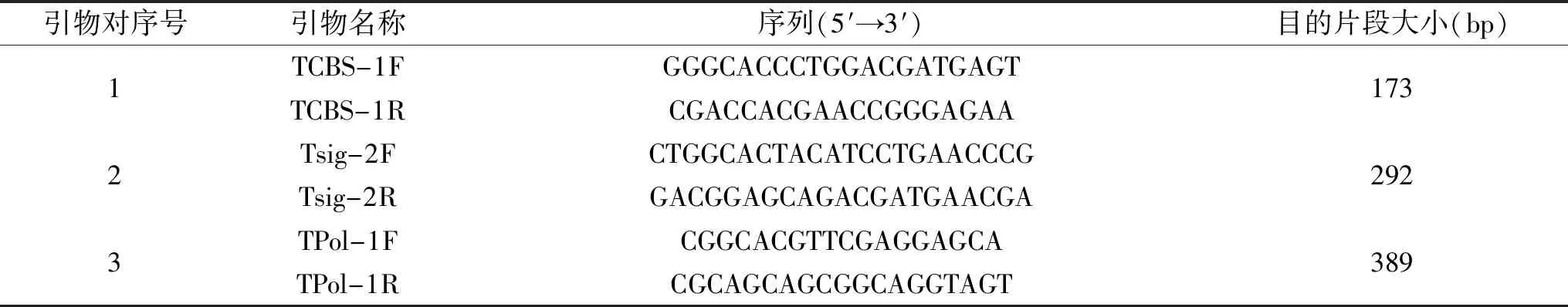
表1 引物信息Table 1 Primers information
1 材料与方法
1.1 材料与仪器
实验动物 成都某市场上购买的尾部皮肤溃烂、腹鳍出血的黄颡鱼;LB培养基、MBS培养基、MRS培养基、Mueller-Hinton Agar培养基 青岛高科园海博生物技术有限公司;PCR聚合酶(1.1×T3 Super PCR Mix)、细菌基因组DNA提取试剂盒 北京天根生化科技有限公司;细菌生化鉴定管、抗菌药物药敏纸片 杭州微生物试剂有限公司;标准革兰氏染色试剂盒 北京雷根生物技术有限公司。
ESJ200-4电子天平 沈阳龙腾电子有限公司;HZQ-X100恒温振荡培养箱 四川新科仪器有限公司;SteriLGARD ⅢADVANCE生物安全柜 Baker公司;DHP-9052电热恒温培养箱 上海齐欣科学仪器有限公司;DHG-9203A高温鼓风干燥箱 上海一恒科技有限公司;WGZ-2XJ细菌浊度计 上海昕瑞仪器仪表有限公司;DYY-6B稳压稳流电泳仪 北京市六一仪器厂;13395H2X生物显微镜 Leica公司;KW-1000DC恒温水浴锅 金坛市科析仪器有限公司;S1000 Thermal Cycler基因扩增仪、GEL DOC2000凝胶成像系统 伯乐公司。
1.2 实验方法
1.2.1 菌种的分离、培养和生理生化鉴定 接种环无菌处理后,在病鱼腹腔积液取样并接种于LB固态培养基中,28 ℃恒温培养18 h观察。挑取外观一致的单菌落,并对其进行细菌纯化培养。采用革兰氏染色法对细菌菌体进行染色[15],显微镜下观察其颜色和形状。采用细菌生化鉴定管进行生化鉴定,鉴定标准参照《伯杰细菌鉴定手册》[1]和《鱼类及其他水生动物细菌实用鉴定指南》[16]。
1.2.2 细菌基因组DNA提取及16S rDNA序列分析 根据细菌基因组DNA提取试剂盒说明书,提取细菌总DNA。采用李晨阳等[17]所使用的16S rDNA通用引物(正向引物:AGAGTTTGATCCTGGCTCAG,反向引物:CTACGGCTACCTTGTTACGA),以提取的细菌DNA作为模板进行PCR扩增。PCR反应体系(25 μL):1.1×T3 Super PCR Mix 22 μL,细菌DNA模板和上、下游引物各1 μL。16S rDNA PCR反应条件:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸30 s,共30个循环;72 ℃再延伸2 min。取5 μL PCR扩增产物采用1.0%琼脂糖凝胶电泳法检测DNA片段长度,并在凝胶成像系统下观察并拍照。确认质量合格、无明显杂带后将PCR扩增产物送至生工生物工程(上海)股份有限公司进行双向测序并拼接。取得拼接后的16SrDNA序列后,提交至GenBank获取登录号,并在GenBank上进行BLAST序列比对,选取相似度为100%的细菌16S rDNA基因序列,利用Mega 5.0软件构建系统进化树。
1.2.3 人工回归感染 将分离菌株接种到LB培养基中,28 ℃、180 r/min培养24 h,离心后用灭菌的0.9%生理盐水制备浓度为3×109cfu/mL的菌悬液。选取10尾健康黄颡鱼腹腔注射0.1 mL菌悬液,另选取10尾健康黄颡鱼腹腔注射0.1 mL生理盐水作对照,饲养7 d观察发病和死亡情况。
1.2.4 特异性引物设计及三重PCR扩增 根据GenBank公布的藤黄微球菌基因序列(GenBank登录号:CP001628.1),采用Primer Premier 5.0软件设计三对特异性引物,详见表1。引物由上海生工生物工程技术服务有限公司合成,工作浓度为10 pmol/L。通过对各反应条件和体系的单因素试验,确定三重PCR最优反应条件为:98 ℃预变性5 min;98 ℃变性30 s,61.3 ℃退火30 s,72 ℃延伸40 s,共35个循环;72 ℃再延伸4 min。三重PCR最优反应体系为:1.1×T3 Super PCR Mix 21 μL,藤黄微球菌DNA模板1.2 μL,Tsig-2上、下游引物各0.6 μL,TCBS-1和TPol-1上、下游引物各0.4 μL,总体系为25 μL。表1中各引物对单独扩增作为对照,PCR反应体系25 μL:1.1×T3 Super PCR Mix 22 μL,细菌DNA模板和上、下游引物各1 μL,反应条件同三重PCR。分别取5 μL PCR扩增产物,采用1.0%琼脂糖凝胶电泳,在恒压120 V条件下电泳45 min,置于凝胶成像系统下观察PCR扩增结果。

表2 耐药基因引物序列Table 2 Primers of drug resistance genes
1.2.5 引物特异性和灵敏度试验 按照无菌操作要求及常规菌种活化方法,固态培养基分别活化枯草芽孢杆菌(Bacillussubtilis)、粪肠球菌(Enterococcusfaecalis)、链球菌(Streptococcus)、杀鱼爱德华氏菌(Edwardsiellapiscicida)、血短杆菌(Brevibacteriumsanguinis)、温和气单胞菌(Aeromonassobria)、霍乱弧菌(Vibriocholerae)、蜡样芽胞杆菌(Bacilluscereus)、厦门希瓦氏菌(Shewanellaxiamenensis)、维氏气单胞菌(Aeromonasveronii)保种菌株,挑取单菌落接于液态培养基37 ℃恒温摇床培养三代,分别取1~5 mL菌液按照1.2.2的方法制备DNA模板进行三重PCR扩增,反应条件、体系、引物及结果检测方法同1.2.4。上述所用试验菌株均保种于西南民族大学青藏高原动物遗传资源保护与利用重点实验室。测定1.2.2中提取的藤黄微球菌基因组DNA浓度后,对DNA样品依次按照10倍、20倍、50倍、102倍、103倍、104倍、105倍、106倍、107倍进行稀释,制备试验DNA模板并进行三重PCR扩增,反应条件、体系、引物及结果检测方法同1.2.4。
1.2.6 多重PCR检测法的临床应用 采用1.2.3的方法人工回归感染黄颡鱼,将发病和死亡黄颡鱼的溃烂伤口组织取下,匀浆后进行细菌基因组DNA提取,采用1.2.5中的三重PCR检测法检测样品。
1.2.7 耐药基因检测 以提取的细菌DNA为模板,参考文献[18-20]设计氨基糖苷类、磺胺类和β-内酰胺类抗生素的耐药基因引物,引物详见表2。PCR反应体系同1.2.2,PCR反应条件:98 ℃预变性2 min;98 ℃变性10 s,退火10 s(退火温度见表2),72 ℃延伸30 s,共35个循环;72 ℃再延伸2 min,取5 μL PCR扩增产物采用1.0%琼脂糖凝胶电泳法检测DNA片段长度,并在凝胶成像系统下观察并拍照。
1.2.8 耐药表型试验 参照周海波等[21],采用琼脂纸片扩散法,取适量菌液均匀涂布于Mueller-Hinton Agar培养基上。再分别将药物药敏纸片(见表4)放置于培养基中,35 ℃培养16~18 h观察结果。药物药敏纸片规格及敏感程度判断标准数据参照CLSI标准。
1.3 数据处理
PCR扩增图谱均有Biorad ChemiDoc MP凝胶成像系统产生,后由Adobe Photoshop 13.0和Paint 3D处理。系统发育树图片由Mega 5.0软件构建,Adobe Photoshop 13.0处理。菌株生化鉴定和耐药表型试验均为三个重复组。
2 结果与分析
2.1 形态学和理化特性鉴定
菌株fsznc-CL菌落均呈圆形,边缘整齐,颜色为柠檬黄色或金黄色,大多数菌落叠聚一起呈链状或成片排列,少数为单菌落(图1)。该菌革兰氏染色后1000倍镜检,可见多数成对或成片排列的紫色或黑紫色球形菌体,表明该菌为革兰氏阳性球菌。该菌理化特性试验结果详见表3。该菌形态学和理化特性与《伯杰细菌鉴定手册》[1]、《鱼类及其他水生动物细菌使用鉴定指南》[16]中关于藤黄微球菌的描述基本一致。

表3 生理生化试验结果Table 3 Results of biochemical characteristics
注:+,阳性;-,阴性。
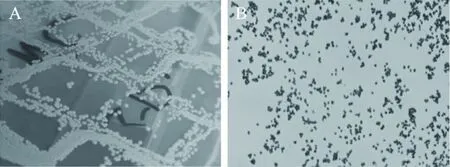
图1 菌株fsznc-CL的形态Fig.1 Colony morphology of fsznc-CL注:A:菌株fsznc-CL在培养基上的菌落形态;B:菌株fsznc-CL革兰氏染色结果(1000×)。
2.2 16S rDNA序列分析
该菌PCR扩增产物的琼脂糖凝胶电泳检测显示其片段长度大约为1500 bp(图2)。测序结果显示,分离菌株16S rDNA片段长度为1286 bp。将分离菌株16S rDNA基因序列提交到GenBank中获得登录号MK521703。系统发育树(图3)结果表明,菌株fsznc-CL的16S rDNA基因序列与MicrococcusluteusHMC01的16S rDNA基因序列置信度为100,结合分离菌株形态学和理化特性,综合判定菌株fsznc-CL为藤黄微球菌(Micrococcusluteus)。

图3 菌株fsznc-CL 16S rDNA基因序列与相关菌株的系统发育树Fig.3 Phylogenetic tree of fsznc-CL 16S rDNA gene sequence and its relatives strains

图2 分离菌16S rDNA基因PCR扩增结果电泳图Fig.2 PCR amplification results of 16S rDNA gene of isolation bacteria注:M.DL2000DNA Marker;1.fsznc-CL。
2.3 人工回归感染结果
经腹部注射分离菌株的黄颡鱼,7 d内死亡7尾,2尾病鱼体表出现溃烂伤口,1尾未见明显病变,对照组未见异常或死亡鱼。图4为人工回归感染后的发病黄颡鱼,症状表现为尾部、鳍部、腹部等部位有溃烂伤口、腹鳍基部有出血点、部分病鱼腹部膨大、部分内脏略有出血点,但未见明显病变,外观变化与自然感染的病鱼相似。
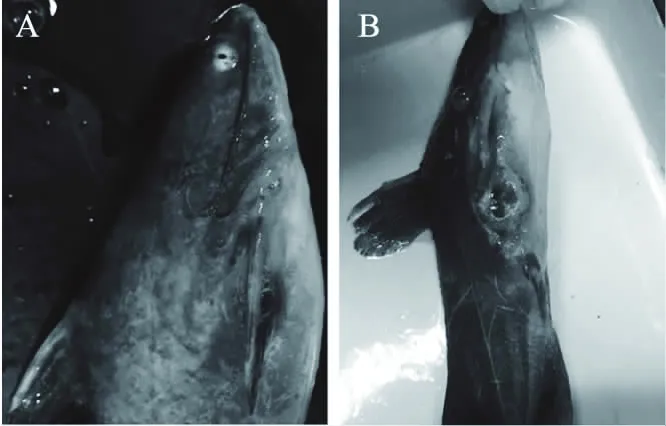
图4 人工感染后黄颡鱼的外观与剖检变化Fig.4 Appearance and anatomical changes of artificially infected Pelteobagrus fulvidraco注:A:鳍部溃烂和出血;B:腹部和鳍部溃烂。
2.4 三重PCR扩增结果
图5为各引物对和三重PCR扩增结果,1~3号泳道依次为引物对1~3独立扩增结果,测序结果与数据库中对应基因序列的相似性分别为97%、98%和97%,片段大小分别为173、292和389 bp。4号泳道为使用三对引物进行扩增的结果,出现三条清晰条带,且无其他杂带,三对引物之间无干扰,扩增准确。
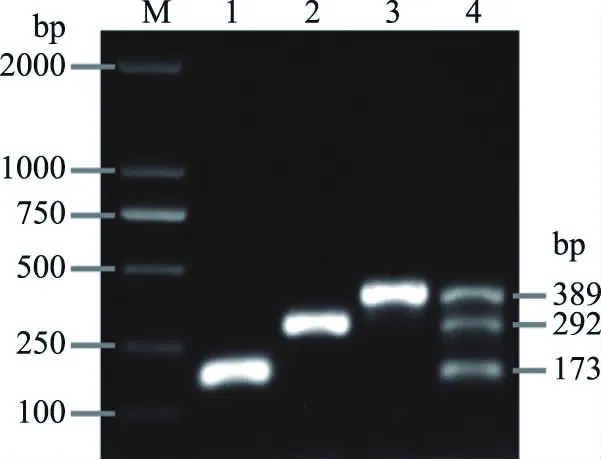
图5 特异性引物扩增Fig.5 Specificprimers for PCR amplifications注:M.DL2000DNA Marker;1.TCBS-1;2.Tsig-2;3.TPol-1;4.The triple PCR。
2.5 引物特异性、灵敏度试验和临床应用结果
图6为引物特异性试验结果,仅1号泳道的藤黄微球菌三重PCR扩增结果出现三条清晰条带,片段大小分别为173、292和389 bp,其他菌株均未出现目的条带,说明所建立的检测方法就有较好的特异性。图7为引物灵敏度试验结果,1~7号泳道均能出现清晰的目的条带,藤黄微球菌DNA模板稀释前的浓度测定结果为58.220 ng/μL,7号泳道所对应的DNA模板浓度为5.822×10-3ng/μL,所建立的多重PCR检测法检测该菌的最低模板浓度为5.822×10-3ng/μL,说明该检测法具有较高的灵敏度,可在被检菌株DNA模板浓度较低的情况下扩增出目的片段。
临床应用试验中采集8条发病黄颡鱼的不同溃烂伤口组织,共12个样品,多重PCR检测结果见图8,其中10个病变组织结果呈阳性,阳性率约为83.33%。

图6 三重PCR的特异性检测Fig.6 Specificity of the triple PCR注:M.DL2000DNA Marker;1.Micrococcus luteus;2.Streptococcus;3.Edwardsiella piscicida;4.Brevibacterium sanguinis;5.Aeromonas sobria;6.Vibrio cholerae;7.Bacillus cereus;8. Shewanella xiamenensis;9.Aeromonas veronii;10. Bacillus subtilis;11.Enterococcus faecalis。

图7 三重PCR的灵敏度检测Fig.7 Sensitivity of the triple PCR注:M.DL2000DNA Marker;1~10DNA模板浓度(ng/μL): 58.220、5.822,2.911、1.164、5.822×10-1、5.822×10-2、 5.822×10-3、5.822×10-4、5.822×10-5、5.822×10-6。
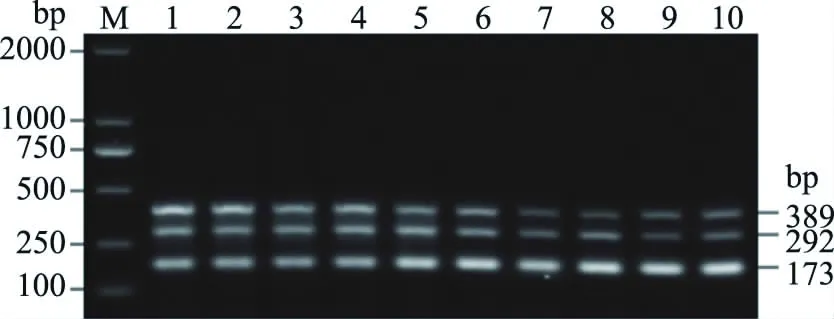
图8 临床样品多重PCR检测结果Fig.8 Detection results of clinical samples by multiplex PCR注:M.DL2000DNA Marker;1~10:病变组织。
2.6 耐药基因检测结果
β-内酰胺类抗生素耐药基因中扩增出TEM基因,片段长度约为740 bp的条带(图9)。氨基糖苷类抗生素耐药基因中扩增出aph(3′)-Ⅱa和aac(6′)-Ⅰb基因,片段长度分别约为740、500 bp的条带(图10)。磺胺类抗生素耐药基因中扩增出Sul1和Sul2基因,片段长度分别约为240、800 bp的条带(图11)。以上扩增片段大小与预期基本一致,未检测出aac(3)-Ⅱa和Sul3基因。

图9 TEM耐药基因检测结果Fig.9 Detective results of TEM resistant genes注:M.DL2000DNA Marker;1.TEM。

图10 氨基糖苷类药物耐药基因检测结果Fig.10 Detective results of aminoglycosides resistant genes注:M.DL2000DNA Marker;1.aph(3′)-Ⅱa;2.aac(6′)-Ⅰb。
2.7 耐药表型试验结果

表4 药敏试验结果Table 4 Results of antibiotic sensitivity test
注:R:耐药;I:中度敏感;S:敏感。
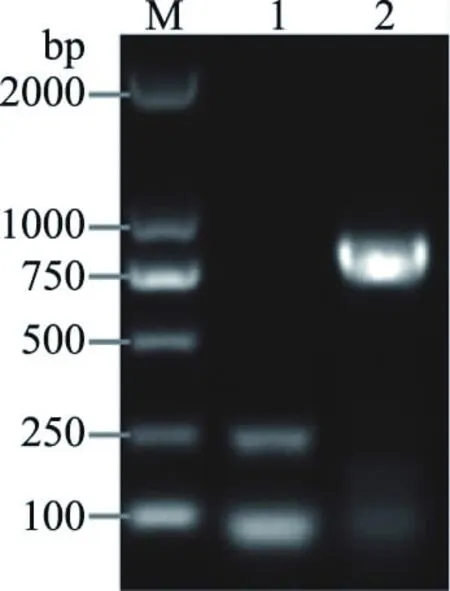
图11 磺胺类药物耐药基因检测结果Fig.11 Detective results of sulfonamides resistant genes注:M.DL2000DNA Marker;1.Sul1;2.Sul2。
从药物药敏试验结果(表4)可以看出,藤黄微球菌对羧苄西林、哌拉西林、氨苄西林、头孢呋辛、麦迪霉素等24种药物敏感,对诺氟沙星、苯唑西林、红霉素和呋喃唑酮耐药。
3 讨论
藤黄微球菌作为人畜生存环境中的条件致病菌,营养不良、机体免疫力较差成为该菌的主要易感因素[22]。彭彬等[9]认为该菌是导致黄鳝出血病的致病菌株。叶妍琳等[23]在火烈鸟的粪便中分离出该菌并认为其具有致病性。陈宇明[24]报道该菌可引起猪败血症并以2月内的幼龄猪为主要感染对象。本试验在病黄颡鱼腹腔积液中分离出菌株fsznc-CL,综合判定该菌为藤黄微球菌,并通过人工回归感染试验确定菌株fsznc-CL对黄颡鱼具有一定的致病性。这说明藤黄微球菌对多种属动物菌存在一定的致病性。
影响多重PCR检测的效果的因素有很多,模板浓度、引物特异性和稳定性等均可影响检测效果。在目前的研究中,有多种形式的多重PCR检测方法,如利用多条毒力基因的方法检测一种或多种细菌[25]、利用数条特异性基因同时检测数种细菌[13]等,此类方法通过一条特异性基因或多条非特异性基因(如毒力基因、16S rDNA和23S rDNA序列)来判断样品中是否含有目的细菌,但检测方法的特异性和准确性欠佳。本试验所选取的特异性基因均通过BLAST比对,确保比对结果中只包含藤黄微球菌相关序列,并采用三条特异性基因检测一种细菌的方法,以提高所建立检测法的特异性和准确性。临床应用试验结果可检测出约83.33%含有藤黄微球菌的样品,另外约16.67%的样品结果呈阴性可能是由于样品中模板浓度低于本方法检测藤黄微球菌的最低模板浓度等原因。综合引物特异性、灵敏度试验和临床应用结果,本试验建立的快速检测藤黄微球菌的三重PCR检测法具有特异性高、灵敏度高、准确可靠的特点。并且该方法可在2 h内检测出菌样是否含有藤黄微球菌,同时降低了鉴定细菌的成本。
关于藤黄微球菌的耐药表型已有一些报道。彭彬等[9]研究表明藤黄微球菌对阿米卡星、环丙沙星、羧苄西林、四环素等抗生素敏感,与本次耐药表型试验结果一致。但彭彬等[9]从病黄鳝分离出的藤黄微球菌对诺氟沙星敏感。李权生等[10]研究表明藤黄微球菌对诺氟沙星和红霉素敏感。Brągoszewska等[26]在办公室空气质量研究中,对藤黄微球菌药敏试验结果显示该菌对诺氟沙星耐药,而本试验结果为该菌对诺氟沙星和红霉素耐药。由于时间、地点、分离源的不同,藤黄微球菌对诺氟沙星和红霉素的药敏结果不同,这可能是在不同地区、不同时间等条件下的用药习惯不同而产生的差异。本试验检测出藤黄微球菌1条β-内酰胺类抗生素耐药基因,氨基糖苷类抗生素耐药基因和磺胺类抗生素耐药基因各2条。该菌株对苯唑西林(β-内酰胺类抗生素)表现为耐药,而对所有涉及到的氨基糖苷类抗生素和磺胺类抗生素并未出现耐药表型。这种现象可能是由于该菌氨基糖苷类抗生素耐药基因和磺胺类抗生素耐药基因并未表达。药敏试验抑菌圈30 mm以上的抗生素中除氯霉素、麦迪霉素和克林霉素外均属于β-内酰胺类抗生素,由于氯霉素为水产禁用药物,因此可将麦迪霉素和克林霉素作为防治藤黄微球菌时替代β-内酰胺类抗生素的药物。
4 结论
本试验从病黄颡鱼中分离出藤黄微球菌,经人工回归感染试验验证了该菌为病原菌,并建立了一种快速、准确地检测藤黄微球菌的三重PCR方法。本试验检测出藤黄微球菌具有β-内酰胺类抗生素、氨基糖苷类抗生素和磺胺类抗生素耐药基因,并对诺氟沙星、苯唑西林、红霉素和呋喃唑酮耐药,可将麦迪霉素和克林霉素作为防治藤黄微球菌时替代β-内酰胺类抗生素的药物。这为藤黄微球菌的快速检测及防控提供了科学资料。

