不同马铃薯基因型对根际细菌群落结构的影响
颜 朗, 张义正, 方志荣, 清 源, 黄 莓, 赖先军
(1.西昌学院农业科学学院, 四川马铃薯高等学校重点实验室, 西昌 615000;2.四川大学生命科学学院 四川省分子生物学及生物技术重点实验室, 成都 610064)
1 引 言
植物依赖其根系和土壤微生物之间有益的相互作用来促进其营养吸收,根际是土壤-植物生态系统物质交换的活跃界面,根际微生物对促进作物生长、减少病原微生物侵害以及维持根际微生态平衡等具有重要作用[1].根际微生物组被认为是植物的“第二基因组”,研究估算约有106~109cells/cm2的微生物群落定殖[2].特定的生态环境和植物类型条件下根际土壤中微生物群落结构差异使植物表现出特定的根际效应(Rhizosphere effect),根际效应直接影响着根际微生物的营养选择和富集[3].在自然条件下,植物及多种生态因子复杂的多变性,使得不同植物甚至是同一物种的不同基因型间对根际微生物群落结构也有着不同的影响[4].根际微生物组主要由植物体外部土壤中的微生物组合而成[5].根据植物根际和内生微生物组的组成,已有研究提出植物可以分为两步组装它们的微生物组,第一步是将根系附近微生物召集到根表面区域,第二步才是进入根内部,这涉及到物种特异性的遗传因素.虽然该模型尚未通过详细的动态研究获得直接的数据支持,但研究认为这是一个貌似有理的假设[6].然而,我们至今对植物和土壤之间的关键屏障,也就是根际微生物的群落结构及其定殖因素仍然知之甚少,并且大多数作物中根际微生物的组成以及影响因素也都是未知的.
高通量测序方法提供了根际微生物组的最新研究手段,最近越来越多的研究使用高通量测序来对不同植物(包括拟南芥、水稻和玉米)的细菌组提出了新的认识[7-9].通过测序产生高覆盖深度的16S rRNA基因的测序数据,用以估计细菌群落的物种构成及其丰度,能够更加真实的揭示原位环境中细菌群落的多样性和复杂性,这些研究为探索植物微生物组的组成和结构以及影响它们的因素开辟了新的途径[10].然而,这些研究仍处于初始阶段,迄今为止,不同基因型作物品种对根际微生物活性及群落组成的作用研究甚少并且几个关键问题尚未得到解决,如作物基因型影响根际微生物群落的主要机制尚未知晓,基因型对根际微生物的影响是否与根系分泌物有关等问题值得研究.
马铃薯是四川凉山州广大彝区世代相传的主食作物,也是我国西南贫困山区脱贫致富的优势作物.随着栽培面积的不断扩大和高效栽培发展的滞后,马铃薯逐渐遭遇幼苗生长发育不良、产量降低、畸形薯比例增高、病虫害严重等问题.土壤中微生物种群变化直接或间接影响着土壤养分的吸收和转化,根际微生物种群结构的失衡是导致土壤质量下降、马铃薯等作物减产和病害发生的主要原因.本文以马铃薯为研究对象,通过对不同马铃薯品种根际细菌16S rRNA基因的深度测序检测了超过250 000个操作分类单位(OTU),旨在揭示不同马铃薯基因型对根际细菌定殖的影响,以进一步探究马铃薯地下部分与微生物的互作关系.
2 材料与方法
2.1 材 料
选取具有凉山特色的马铃薯高山地方种‘乌洋芋’、‘牛角洋芋’、西昌学院自育的高产品种‘西薯1号’、‘西薯3号’以及凉山州主栽品种‘青薯9号’和‘米拉’(图1A).
2.2 方 法
2.2.1 马铃薯盆栽试验及样品采集 进行自然条件下盆栽试验.试验地点为四川省凉山彝族自治州普格县五道箐乡西昌学院马铃薯科研繁种基地(坐标:东经102.414 583,北纬27.643 844),试验时间为2018年3~8月.试验地土质为轻质壤土,将基础土壤填装于口径34 cm的塑料盆钵中并以75 g/m2用量的有机肥作基肥施于10 cm以下处的土层中.将不同品种的马铃薯种薯表面用无菌水冲洗干净,用 1%次氯酸钠溶液消毒10 min,70%乙醇浸泡30 s后立刻除去乙醇,无菌水冲洗5次,避光晒干后播种.每个品种设置6个生物学重复.
播种前采用多点混合采样法对基础土壤和有机肥料进行取样,至马铃薯收获期时对根际土壤进行取样.取样时,每个马铃薯品种随机选取3盆作为一个生物学重复,把马铃薯植株从盆钵中整株挖出,不要伤害根系,抖落根系土壤表层未分解的凋落物层后用无菌刷刷取根际区域约1 mm的紧密粘附在根表面的土壤.不同品种的6个生物学重复间单独刷取以避免样品污染.每个样品采集5 g左右的根际土壤并搜集至50 mL无菌离心管中,带回实验室过2 mm筛后分装至冻存管中,迅速置于液氮中冷冻 3~4 h,冰上备用或转移至-80 °C长期保存.
2.2.2 样品总DNA提取与测序 根际细菌DNA提取采用美国MOBIO公司的 Power Soil DNA Isolation Kit 试剂盒进行.称取 0.5 g 保存于-80 °C冰箱中的土壤样品,按试剂盒说明书过程提取总DNA,通过超微量分光光度计(Nanodrop 2000)检测DNA浓度≥20 ng/mL,OD260/280为1.8~2.0,OD260/230为1.8~2.0即为合格.提取的总DNA在-20 °C条件下保存用于后续PCR扩增.用通用引物338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT)扩增细菌16S rRNA基因的V3-V4区域,并采用Illumina MiSeq 2×300测序平台对PCR扩增产物进行双端测序.测序委托北京百迈客生物科技有限公司完成.
2.2.3 数据质控与分析 高通量测序得到的原始数据进行数据质控(Trimmomatic软件, version 0.33)和软件拼接(FLASH软件 , version 1.2.11)[11-12],过滤掉低质量的Reads序列并将得到的双端序列数据拼接成一条序列Tags,同时对拼接效果进行质控,主要包括去除低质量Tags和去嵌合体(UCHIME软件, version 8.1)[13].将有效Tags按照相似性≥97%序列聚类成为单元(USEARCH软件,version 10.0)[14],1个操作分类单元为1个OTU (Operational Taxonomic Units) ,以测序所有序列数的0.005%作为阈值过滤OTU[15].使用R/BioConductor包edgeR中trimmed mean of M values (TMM) 方法对OTU矩阵进行均一化[16].基于Silva(细菌)分类学数据库对OTU进行分类学注释(RDP Classifier软件,version 2.2,置信度阈值为0.8)[17-18],得到每个OTU对应的物种分类信息,进而在各水平统计各样品群落组成.
使用QIIME软件进行单样品组成Alpha 多样性分析,计算样品的 Coverage、Chao1、ACE、Simpson、Shannon 指数等[19].其中Chao1和ACE丰富度估计量度量了样本中的菌群丰度,Simpson和Shannon指数度量了样本中菌群的多样性.Simpson指数值越小,说明群落多样性越高,Shannon指数越大说明群落多样性越高.Coverage则反映测序结果是否代表了样本中微生物的真实情况,其数值越高表明样本中序列被测出的概率越高.样本相关性分析中statistic 为R值,范围为-1到1.如果 R 值越接近 1,说明样本间OTU种类和丰度呈现高度正相关.使用R包Ape中的pcoa()函数进行样本间主坐标分析(PCoA).PCoA分析基于由样本组成计算得到的距离矩阵进行特征向量降维排序,从均一化的OTU矩阵中计算加权和未加权的UniFrac距离矩阵,其中加权考虑物种的丰度,未加权则没有对物种丰度进行加权处理.
3 结果与分析
3.1 不同基因型样本根际细菌群落组成
共计采集样品36个,细菌16S rRNA基因测序共获得3 542 568对双端序列(Reads),经Reads拼接过滤后得到3 097 269条高质量序列(Clean tags),每个样本中Clean tags数在65 081~89 830之间;质控后的序列依据97%的序列相似性聚类获得细菌OTU数1 565个(不同样本和重复间取并集所得),其中播种前的基础土样和肥料中OUT数据量分别在1 159~1 191之间和52~57之间,收获期不同品种马铃薯根际土壤中有效OTU数量在1 357~1 514个之间(图1B).使用M值方法对每个样本中得到的OTU数量进行标准化.所有样本中OTU的覆盖率均>99%,认为该测序量能够反映样本中细菌群落的真实情况(表1).将不同样本生物学重复间的OTU数据合并后进行细菌群落特异性分析显示,所有样本中共有OTU仅4个,而肥料中特异性OTU为26个,占肥料总OTU数的47%,表明肥料中大量细菌菌群并未形成优势种群残留于收获期根际土壤中.基础土壤中特异性富集的OTU数为5个,另在牛角洋芋发现10个特异性OTU,乌洋芋和西薯3号中发现8个,其余品种中各发现1个(图1C).若仅统计6个马铃薯品种中根际细菌群落特异性,则品种间共有OTU为1 000个,品种间OTU种类相差不大.
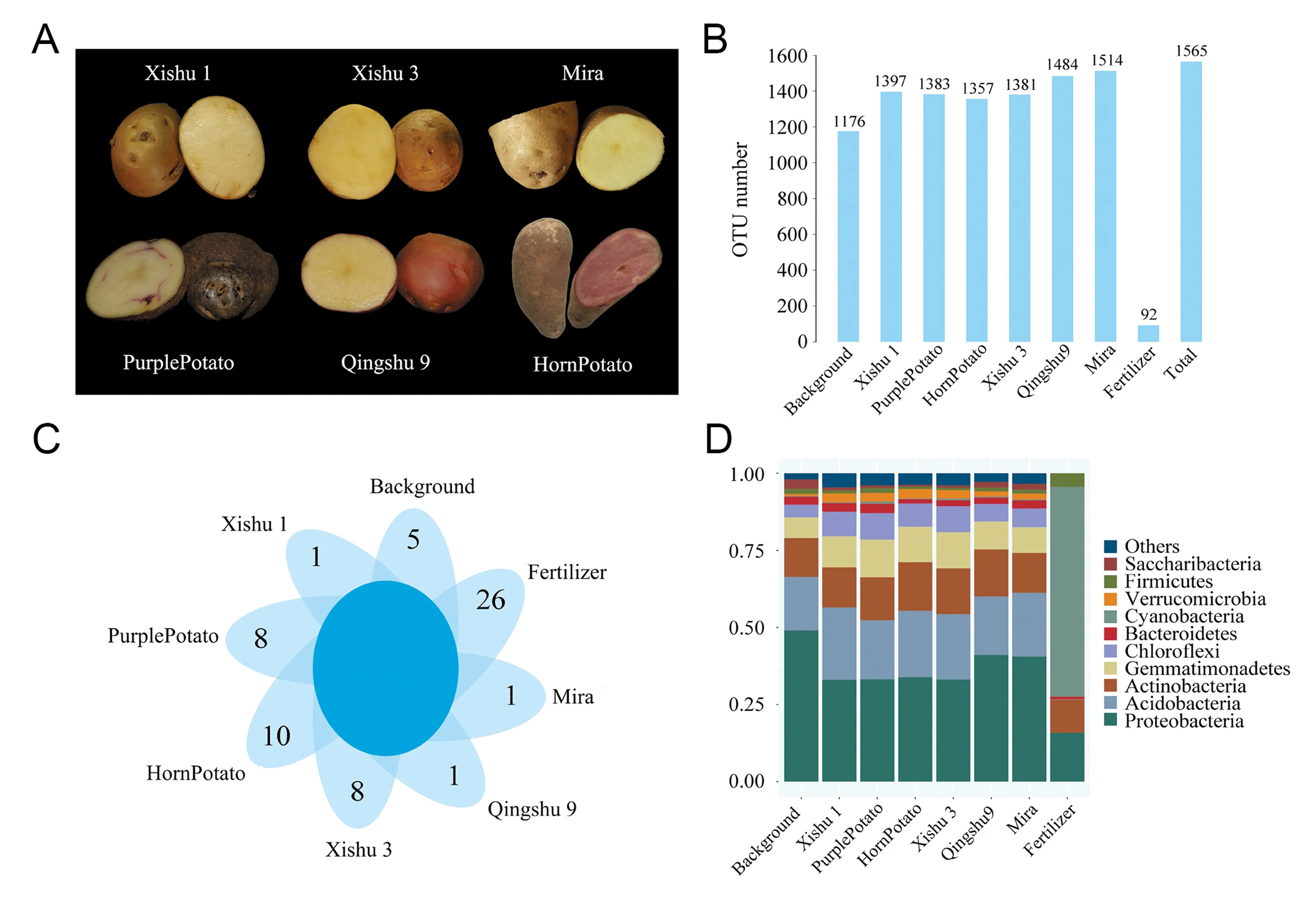
图1 不同基因型马铃薯根际细菌菌群组成
(A)不同马铃薯试验材料表型示意图;(B)不同样本根际细菌总OTU数量;(C) 不同样本间特异性根际细菌OTU数量;(D)不同样本根际细菌菌门相对丰度
Fig. 1 Rhizosphere bacterial composition among different potato genotypes
(A) Phenotypes of different potato materials. (B) Total number of OTUs in rhizosphere microbiome among different samples. (C) Specific OTUs in rhizosphere microbiome among different samples. (D) Relative abundances of bacterial phyla among different samples
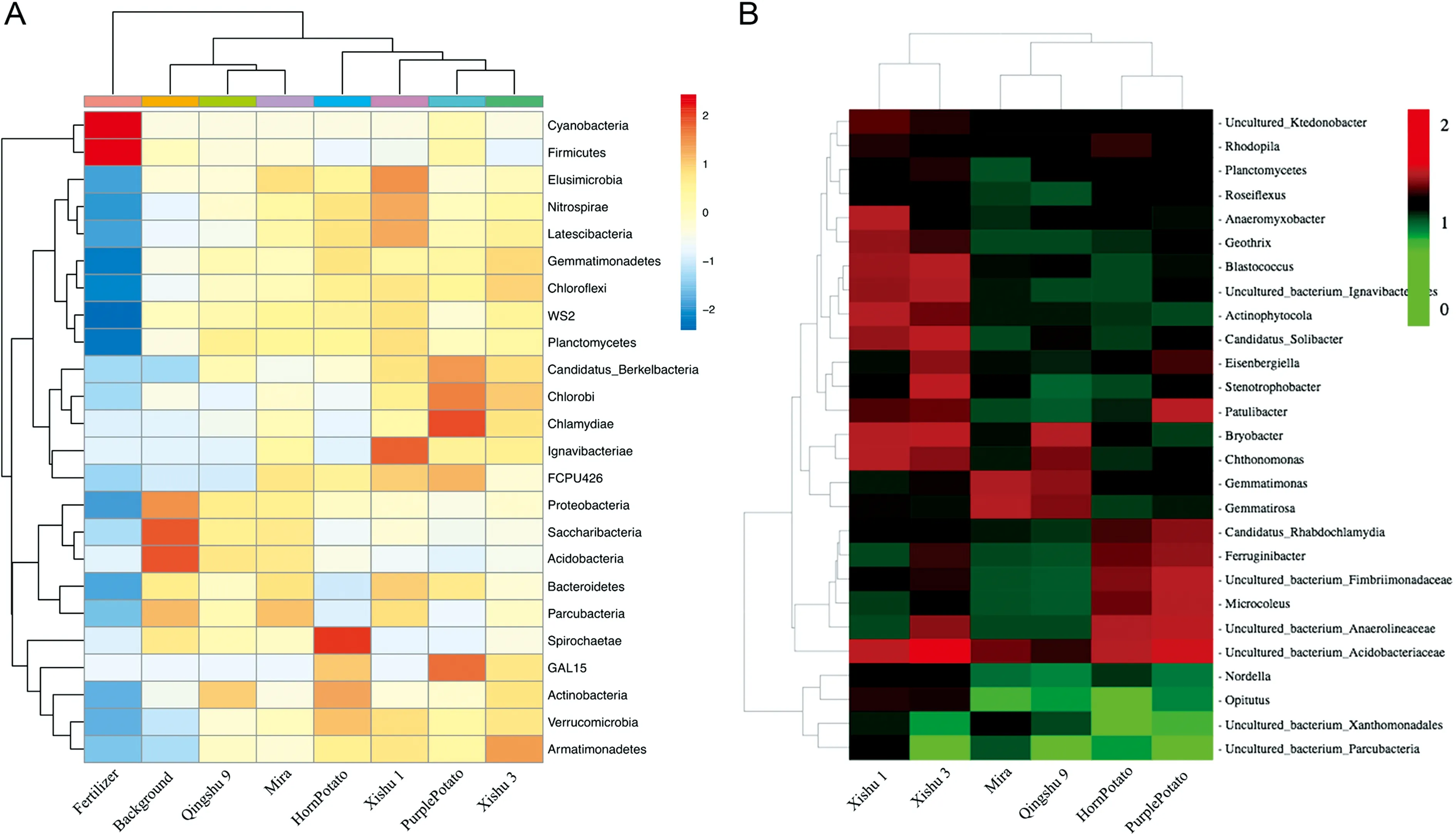
图2 不同马铃薯基因型根际细菌群落物种分布热图
(A) Relative abundance of bacterial community at phyla-level among all samples. (B) Relative abundance of rhizosphere bacterial community at genus-level
经注释后的细菌种类相对丰度比例图显示(图1D),品种间主要根际细菌群落种类趋于一致,群落丰度水平Top 5的菌门分别是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes).值得注意的是,肥料中占绝大多数的蓝藻(Cyanobacteria)在马铃薯收获期的根际细菌中丰度锐减,几乎无法存活,类似的情况还有厚壁菌门(Firmicutes).图2A显示了样品中的物种分布丰度的聚类情况,将高丰度和低丰度的细菌群落分块聚集,通过颜色梯度及相似程度来反映多个样品群落组成的相似性和差异性.除了上述肥料中的特异性菌群特征外,基础土壤中的酸杆菌门(Acidobacteria)和Saccharibacteria特异性显著富集,表明这两类存在于基础土壤中的菌群在马铃薯生长过程中丰度降低.同样,在收获期乌洋芋和牛角洋芋中分别发现衣原体门(Chlamydiae)和螺旋体门(Spirochaetae)呈现特异性显著富集.另外,有389个OTU在基础土壤和肥料中均未富集,但富集在马铃薯收获期根际细菌样本中.对这些OTU进行注释和富集分析后发现,这部分新出现的细菌种类呈现分块聚集,以芽球菌属(Blastococcus)为代表的5个分类群特异性富集在西薯1号和西薯3号;以芽单胞菌属(Gemmatimonas)为代表的2个分类群在青薯9号和米拉中丰度较高;而以鞘藻属(Microcoleus)为代表的6个分类群在地方品种乌洋芋和牛角洋芋中呈现高丰度(图2B).
3.2 不同基因型马铃薯根际细菌的群落多样性
为了分析在平行条件下根际细菌群落结构是否受到马铃薯基因型的影响,我们对收获期马铃薯根际细菌样本间OTU丰度的相关性进行了统计(图3),以皮尔森相关性系数R判定两两样本间相关强度,结果表明,6个马铃薯品种根际细菌群落两两间都具有显著的正相关性,青薯9号(R=0.853,P<2.2e-16)和米拉(R=0.872,P<2.2e-16)中的根际细菌丰度与基础土壤之间呈现显著正相关,而其他马铃薯品种与基础土壤之间并无显著相关性,即青薯9号和米拉品种的根际细菌群落受基础土壤细菌群落的影响更大.另外,所有马铃薯根际细菌和肥料细菌群落均无相关性.
Alpha(α)多样性能够反映样品内部物种丰度及物种多样性,是用来衡量微生物群落丰富度和均匀度的综合指标.不同马铃薯基因型根际细菌群落丰度及多样性指数见表1.由表可知在平行处理
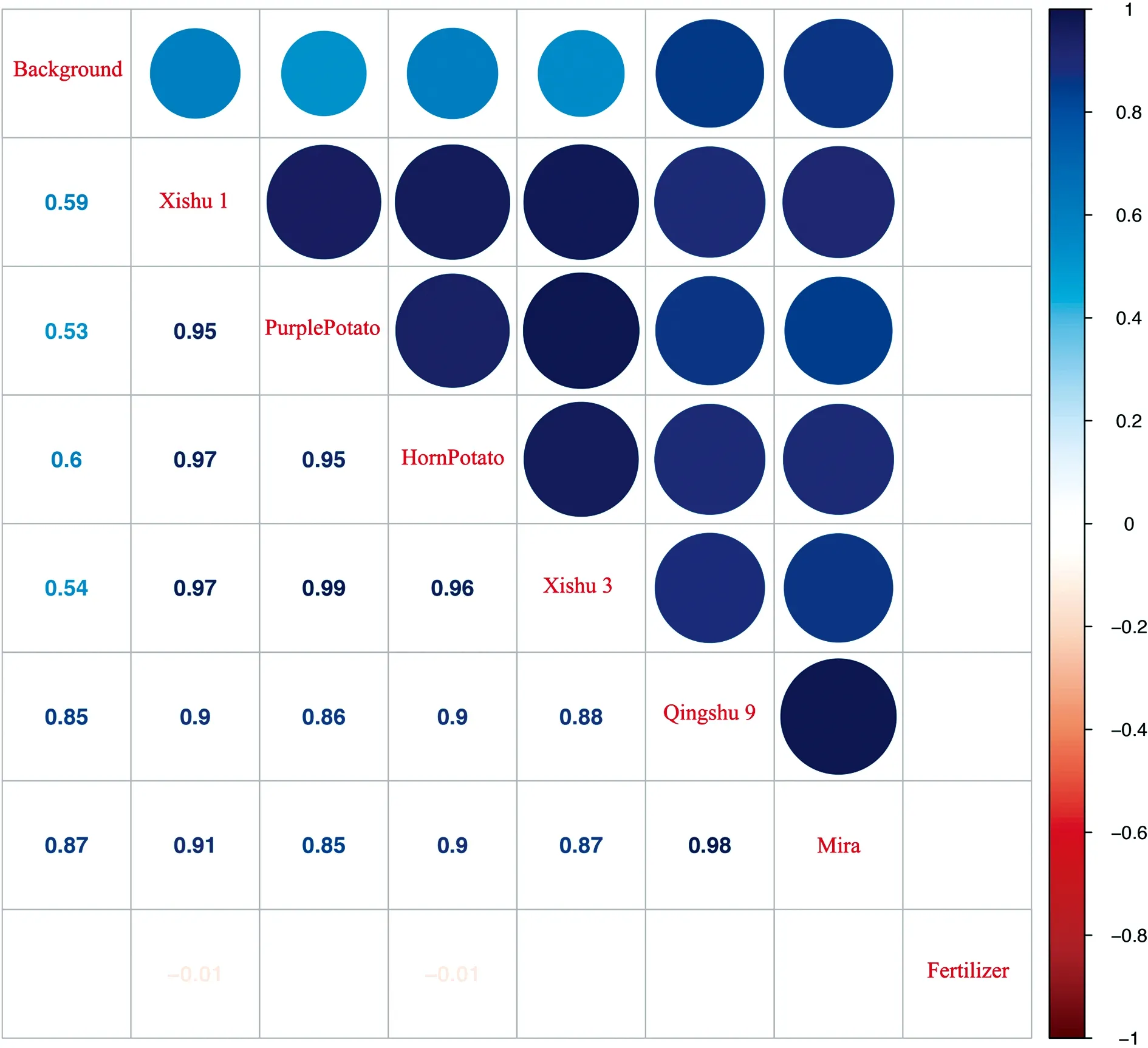
图3 不同马铃薯基因型根际细菌群落相关性分析Fig.3 Correlation analysis of rhizosphere microbiome between different potato genotypes
下,牛角洋芋根际细菌群落ACE指数和Chao1指数最低,表明其群落丰度最低;乌洋芋根际细菌群落中Shannon指数最低,表明该基因型样本根际细菌多样性最低.等级丰度曲线解释了样本中所含物种的丰富度和均匀度.由图4可知,不同基因型马铃薯根际细菌群落组成丰富度从大到小排列为:米拉>青薯9号>西薯1号>西薯3号>牛角洋芋>乌洋芋.值得注意的是,从群落物种组成的均匀度可以看出,乌洋芋和牛角洋芋根际细菌样本的均匀程度高于其他基因型.T检验和ANOVA方差分析同时表明,乌洋芋和其他品种的根际细菌群落间存在着显著的多样性差异(T检验:P=2.73e-3~4.4e-2;ANOVA:P=1.86e-3~1.53e-2).
表1样本Alpha多样性指数统计
Tab.1StatisticsofmicrobialAlphadiversityindexinthesoilsamples

SampleOTUACEChao1SimpsonShannonCoverage/%Background1 1761 226.39 1 147.410.005 16.1199.7Xishu11 3971 414.911 435.510.006 16.2399.84PurplePotato1 3831 409.411 416.260.022 75.6499.81HornPotato1 3571 393.701 408.660.006 36.1499.72Xishu31 3811 401.081 421.470.008 46.0899.87Qingshu91 4841 501.011 511.240.005 56.3499.81Mira1 5141 517.431 519.520.004 66.4199.94Fertilizer55153.708 4128.140.488 21.2899.96

图 4 不同马铃薯基因型根际细菌等级丰度曲线Fig.4 Rank-abundance distribution curve of rhizosphere microbiome of different potato genotypes
我们进一步通过加权和未加权UniFrac距离的无约束主坐标分析(PCoAs)来研究不同基因型根际细菌群落之间的分离模式.UniFrac距离基于群落间的分类相关性,其中加权UniFrac(WUF)度量考虑了分类群丰度,而未加权的UniFrac(UUF)则没有,因此对稀有的分类群更敏感.如图5所示,在UUF PCoA中,第一主要坐标揭示了样本间84.78%的差异并将基础土壤与马铃薯收获期根际土壤样本区分开来,同时米拉和青薯9号与其余马铃薯品种相区隔,表明这两个基因型样本根际细菌群落变异程度较其余基因型更小.同时,第二主要坐标揭示了样本间9.66%的差异并将乌洋芋和其他基因型区分开.通过UUF距离的置换多变量方差分析(PERMANOVA)支持了PCoA结果(P<0.001),表明马铃薯不同基因型根际细菌群落之间存在显著的变异.

图5 基于未加权的UniFrac(UUF)距离的主坐标分析(PCoA)Fig.5 Principal coordinates analysis (PCoA) using UUF metric
3.3 受马铃薯基因型影响的根际细菌菌群
为了揭示马铃薯根际细菌群落中是哪些OTU造成了基因型效应,我们在乌洋芋和米拉两个品种间进行了OTU丰度分析.利用fold change(FC)表示样本间OTU丰度的差异倍数,并以log2FC缩小差异特别大的和差异比较小数之间的差距,以T检验衡量样本间差异的显著性.我们在乌洋芋和米拉根际细菌样本间发现198个群落丰度具有显著差异的OTU(P<0.001),这些受马铃薯基因型影响的OTU具体表现为乌洋芋中55个OTU丰度上调,143个丰度下调.经OTU注释后我们通过二项式分布检验(binomial test)对这些差异OTU是否显著富集到某一种类进行了分析(P<1e-8).结果表明,乌洋芋中受基因型影响根际细菌丰度上调的OTU主要显著富集在微杆菌科(Pseudonocardiaceae,放线菌门)、纤线杆菌科(Ktedonobacterales,绿弯菌门)、梭菌科(Clostridiaceae,厚壁菌门)、毛螺菌科(Lachnospiraceae,厚壁菌门)、硝化链球菌科(Peptostreptococcaceae,厚壁菌门)、高温放线菌科(Thermoactinomycetaceae,厚壁菌门)、芽单胞菌科(Gemmatimonadaceae,芽单胞菌门)、浮霉菌科(Phycisphaeraceae,浮霉菌门);同时,在对照米拉中受基因型影响根际细菌丰度上调的OTU则显著富集在酸杆菌科(Acidobacteriaceae,酸杆菌门)、Chitinophagaceae(无中文名,拟杆菌门)、鞘脂杆菌科(Sphingobacteriaceae,拟杆菌门)、Roseiflexaceae(无中文名,绿弯菌门)、球形杆菌科(Sphaerobacteraceae,绿弯菌门)、柄杆菌科(Caulobacteraceae,变形菌门)、黄单胞菌科(Xanthomonadaceae,变形菌门).
4 讨 论
根际是一个独特的环境,是受植物根系和根系分泌物直接影响的薄层土壤,植物和土壤微生物在这里发生着广泛且复杂的相互作用.根际是微生物定殖和发挥活性的重要区域,根际中的微生物类群复杂,对宿主植物的生长发挥着重要的影响[20-21].植物根系与根际微生物之间的互作是特异的并处于共进化的压力下[22].一方面根际微生物可以协助宿主植物抑制土传病害,提高养分的有效性和吸收,促进植物生长,反过来,植物为根际微生物提供根系分泌物作为生长基质与信号分子[23].其中,同种作物不同品种或基因型的根际微生物群落间是否存在着定殖差异,这可能关系到不同种质的土壤适应性问题,因此更具研究价值.相关研究中得出的结论具有一定的差异,玉米中的研究发现品种形态学之间的差异可能会导致根际微生物性质和群落组成的分异[24].Bouffaud等的研究表明玉米根际细菌群落组成明显依赖于玉米品种基因型,且主要表现于某些β变形菌属和特定的伯克氏菌属上的改变[25].有研究者对4个大豆品种采用磷脂脂肪酸(PLFA)法分析了不同基因型对根际微生物区系的影响后发现其中两个品种对根际微生物群落结构的影响差异明显[26].然而在水稻中,有研究团队先后在两篇论文中报道不同的水稻基因型间对根系微生物群落差异有显著的影响,这种变异主要是在水稻内生菌群落(P= 0.001),而根际群落的影响不显著(P=0.191)[9,27].同时,水稻中也有其他研究认为水稻的基因型与其种子的固有细菌群落具有一定的相关性, 且这种相关性在细菌的优势种群中表现得较为明显[28].目前对于基因型影响作物根际微生物种群结构的机制尚无定论,但作者认为基因型对微生物群体的影响与不同品种根基分泌物类型不同有关.由于根系不断向生长介质中分泌大量的有机物质,植物根系分泌物成为了根际微生物的主要营养来源和能源物质,对于根际微生物的数量和组成具有重要的影响.如有研究表明,不同基因型小麦苗期根系分泌物对根际反硝化细菌生长量和反硝化细菌活性均有不同程度的影响,根系分泌物中氨基酸总量高的小麦基因型其根际反硝化细菌的生长量和活性均呈现较高水平[29].因此,在今后的研究中应重点关注作物根系分泌物与根际微生物间的互作关系及相互影响.
凉山地区具有悠久的马铃薯种植历史和得天独厚的自然条件:日照充足、气候冷凉、昼夜温差大、降水集中、雨热同季,同时马铃薯种质资源十分丰富,特别是高山彝区群众世代主食马铃薯,保留着性状独特且多样性丰富的地方品种.本研究中所采用的乌洋芋和牛角洋芋均为凉山州布拖县采哈乡来源的高山地方种,具有鲜明的性状特征和其他推广品种无法比拟的品质,主要表现为皮薄、质嫩、淀粉含量高、口感好、耐贮存.同时,以乌洋芋为代表的特色地方种对气候、土壤和肥料都有着特殊的要求,这也导致了这些种质资源一旦离开其原有生长条件后就会出现产量降低和品质退化[30].本研究发现,乌洋芋和牛角洋芋的根际细菌群落虽然在群落组成上与其他自育品种和广推品种相似,品种间具有高度的相关性,但是在群落丰度和均匀度上表现出显著的差异.同时,本研究通过差异分析挖掘乌洋芋与广栽品种米拉之间出现显著丰度差异的根际细菌类群,也是可能对特色地方种定殖起关键作用的细菌类型.其中在乌洋芋中显著性差异富集的土壤红色杆形菌(Solirubrobacter)和Ferruginibacter菌已被研究认为是具有改善作物农艺性状的根际促生菌[31].这对于下一步开发针对地方种的专用生物菌肥和生物农药具有指导意义,为马铃薯特色地方种的土壤环境改良实现优质种质资源广谱性种植奠定基础.

