四川地区ODF1基因多态性与特发性弱精子症的相关性研究
邓 丹, 丁显平,2, 何娇雨, 林小莉
(1.四川大学生命科学学院, 成都 610064; 2.特色生物资源研究与利用川渝共建重点实验室, 成都 610064)
1 引 言
研究报道, 不孕不育发病率约占世界育龄夫妇的15%, 其中男性因素约占30% ~40%[1-2].无精子症、少精子症、畸形精子症和弱精子症(AZS)是4种常见的男性不育疾病.因此, 探索弱精子症的分子机制, 对于诊断和治疗男性不育具有重要的意义[3].到目前为止, 已经证实了一些易感基因与男性特发性AZS相关, 如鞭毛轴丝微管蛋白家族蛋白2(Tektin2)[4]、前列腺睾丸蛋白1(PATE1)[5]、生精蛋白1(SEMG1)[6]、轴丝动力蛋白重链1(DNAH1)[7].
在哺乳动物中, 外周致密纤维(ODFs)是精子鞭毛中主要的张力承载元件, 在附睾运输和射精过程中, 鞭毛所累积的剪切力主要通过ODFs蛋白传递到鞭毛底部[1, 3].ODF1作为ODFs中一种主要的蛋白组成部分, 然而到目前为止, 国内该基因与弱精子症男性不育的相关性研究仍较少[8], 因此, 本实验旨在探究ODF1基因的多态性与四川地区男性特发性弱精子症的相关性.
2 材料与方法
2.1 材 料
2.1.1 组织样本 选择2016年11月到2017年9月就诊于四川生殖卫生研究中心附属医院的弱精子症男性不育患者为病例组, 选择精液参数正常的男性(至少育有一个自然受孕孩子)为对照组.年龄22~35岁(各组年龄无差异,P>0.05), 研究对象需符合以下所有条件: ①根据第5版世界卫生组织(WHO)的标准, 所有精液样本进行3次常规精液参数检测分析, 精液量>2.0 mL, 正常可育男性组的精液(对照组:精子密度<20 × 106/mL, A级精子>25% 或A + B级精子>50%)和弱精子症患者的精液(病例组:精子活力A级精子<25% 或A + B级精子<50% );②参考中国的研究与欧洲男科学院的诊断标准, 选择无Y 染色体微缺失(AZF)的DNA样本为实验对象[6];③排除已知其他非遗传因素的造成的男性弱精子症不育, 如职业病危害、隐睾、酗酒、抽烟和不良生活习惯等[5].所有受试对象均签署知情同意书, 本研究已经伦理委员会审核通过.
2.1.2 主要试剂 胰蛋白酶(北京全式金);琼脂糖(美国Invitorgen 公司);Taq DNA 聚合酶 (北京全式金);核酸染料(北京天根生物科技有限公司);DNA Ladder Maker(北京全式金);Giemsa染料(潍坊康华生物生物科技有限公司);秋水仙素溶液(潍坊康华生物生物科技有限公司);DNA提取试剂盒(北京全式金);Taq DNA 聚合酶(北京全式金);蛋白酶K(上海生工).
2.1.3 主要仪器 精液参数自动检测系统MIX7.5(清华同方);Hema9600PCR扩增仪(中国杭州朗基有限公司);KQ-100E超声波清洗器(江苏常州奥森电器有限公司);DYY-6D电泳仪(北京六一仪器厂);GSG-2000凝胶成像系(美国BIO-RA公司);Milli-Q超纯水仪(美国Millipore公司);HH420恒温水浴箱( 江苏常州奥森电器有限公司);染色体图像分析系统(捷克Laboratory Imagin公司);CO2细胞培养箱(上海博远实业).
2.2.1 精液分析 按照第5版《人类精液检查与处理实验室手册》进行精液参数分析, 将采集的新鲜精液样本37 ℃孵育液化约 30 min 后, 放入精子参数自动检测系统仪器中进行自动分析, 包括精液浓度, 精子活力等.
2.2.2 核型分析 采集的外周血细胞在植物凝集素作用下, 在RPMI-1640培养液中37 ℃, 培养72 h获得大量分裂中期的细胞, 加入秋水仙素使分裂中期的细胞停止分裂;再经低渗膨胀处理, 防止染色体之间相互重叠和缠绕;最后用甲醇和冰醋酸(3∶1) 将细胞固定于载玻片上, 经Giemsa染色后, 在光学显微镜和染色体图像分析仪中根据染色体的形状及G显带的相对位置对所有的染色体进行计数、分类.
2.2.3 Y染色体微缺失(AZF)检测 采用多重PCR扩增的方法检测Y染色体微缺失(AZF)片段.参考中国的研究与欧洲男科学院的诊断标准, 选取AZF微缺失三个区域中的7个代表序列标记位点(STS), 如:AZF a区域:sY86、USP9Y;AZF b区域:sY127、sY134;AZF c区域:sY254、sY255[8](表1).
2.2.4 提取基因组DNA 采用DNA提取试剂盒提取精子全基因组DNA.将精子重新悬浮在无菌水中, 与含有20 mg/mL蛋白酶K和结合缓冲液3的溶解溶液混合, 室温下溶解10 min.将裂解液加入离心柱, 结合DNA.清洗结合的DNA, 从离心柱中洗脱.所有的DNA样品于-20 ℃下保存, 备用.

表1 AZF 区域的 6 个 STS 位点引物
2.2.5 PCR扩增 利用表2的引物对ODF1基因的两个外显子和部分侧翼内含子序列进行了PCR扩增. PCR扩增条件如下:预变性(95 ℃, 5 min), 变性(94 ℃, 30 s), 退火(56 ℃, 30 s), 延伸(70 ℃, 30 s).扩增体系总体积为25 μL, 包括:10 ×buffer 3.0 μL, dNTPs 2.5 μL, 双蒸水9.6 μL, 正、反引物各1.0 μL, DNA模板6 μL.所有PCR扩增产物均进行2%的琼脂糖凝胶电泳, 采用全能凝胶成像系统进行观察检测.合格样品送往上海生工测序.
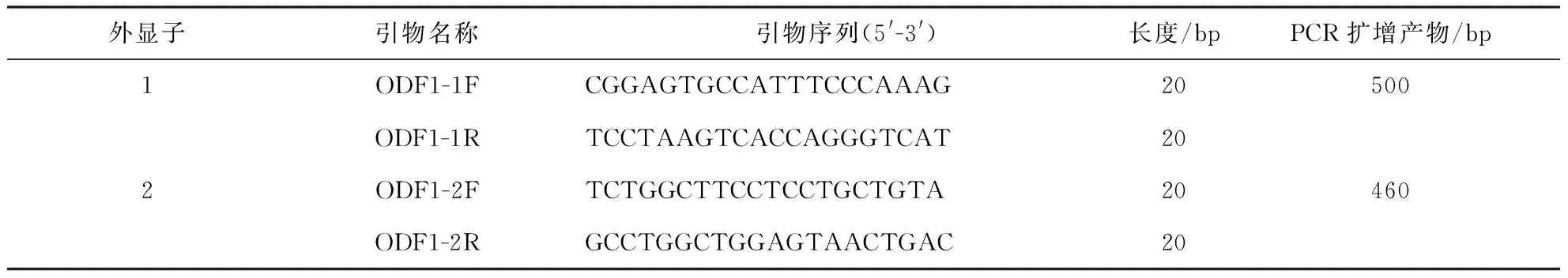
表2 ODF1基因的扩增引物
注:F forward primer, R reverse primer
2.2.6 基因突变分析 使用MEGA对所有测序结果进行比对、分析.采用SPSS 20.0软件进行统计学数据分析, 用χ2检验和哈迪温伯格平衡定律分析比较对照组和病例组, 使用非条件Logistic回归方程计算OR比值和 95% 置信区间(95% CI), 衡量弱精子症与变异基因型相关的风险,P<0.05 时具有统计学意义.从蛋白模型网站PMP(http://www.protein model portal.org)获取ODF1蛋白的3D结构.通过生物信息学软件PROVEAN软件 (http://provean.jcvi.org/index.php)预测变异体对ODF1蛋白功能的影响.此外, 利用ExPASy-ProtScale (http://web.expasy. org/protscale/) 分析错义突变对ODF1蛋白亲疏水性的影响.
3 结 果
3.1 对照组与病例组精液参数对比分析
经过严格的精液分析、染色体G显带分析和AZF微缺失等步骤, 此次实验总共挑选出符合条件的病例组106例(四川地区特发性弱精子症男性不育患者)和对照组104例(具有正常孕育史的男性), 两组精子浓度、精子活力(A+B级)均有统计学差异(P<0.05), 而年龄无统计学意义(表3).
3.2 ODF1基因的突变分析
对106例AZS患者的ODF1基因两个外显子和部分侧翼内含子序列进行测序后, 我们发现2号外显子里有三种核苷酸突变和两种核苷酸缺失:P211P(c.C633G)、P214P(c.C642G)、S216N(c.G647A)、C221-P229delinsSPCNPCS(c.665del GCCCC TGCAACCCGTGCA, 缺失18 bp)和C218-P229delinsNPCSPCNPCS(c.656del ACCCCTGC AGCCCCTGCAACCCGTGCA, 缺失27 bp).病例组和对照组中c.C633G、c.C642G和18-bp缺失变异分布情况几乎相同(P值>0.05), 无统计学意义.然而, 与对照组相比, 等位基因中27- bp缺失变异体(OR=1.783, 95%CI=1.178-2.700,P=0.006)的频率在弱精子症患者中显著增加(表4).此外, 错义突变c.G647A(OR=1.671, 95%CI=1.116-2.502,P=0.012)的基因型和等位基因频率也与对照组有明显的差异(表5), 并且将216位的丝氨酸转变为天冬酰胺.总之, 27-bp缺失突变和错义突变分散在病例组和对照组的比例有明显差异(图1).采用PMP蛋白质的模拟软件, 发现这两个突变均位于蛋白质3D模型的侧面褶皱区域, 是ODF1蛋白的功能区域(图2), 在人类近缘的物种中具有相对较高的保守性.同时通过PROVEAN软件分析, 错义突变被预测为中性突变, 而缺失突变则会对蛋白质的功能有潜在损害, 且分值为-10.462(图3).
表3病例组和对照组的基本信息
Tab.3Comparisonofageandsemenparameterbetweenasthenozoospermicgroupandcontrol

临床参数对照组(n=104 )a病例组(n=106)aP年龄33.6±4.232.1±3.50.431精液浓度/(×106/mL)68.4±15.336.3±17.6<0.001快速精子活力/%37.3±4.68.1±5.1<0.001精子活力/% 62.61±6.219.8±7.6<0.001AZF微缺失无无核型46, XY46, XY后代个数1.4(1-3)0
注:a数据的平均值±SDP<0.05具有统计学意义

表4 特发性弱精子症和正常组中ODF1基因中27-bp缺失的基因型和等位基因频率
注:A-G 为无缺失;A27G为缺失27-bp;A18G为缺失18-bp;CI为置信区间
*P<0.05 和**P<0.01具有统计学意义
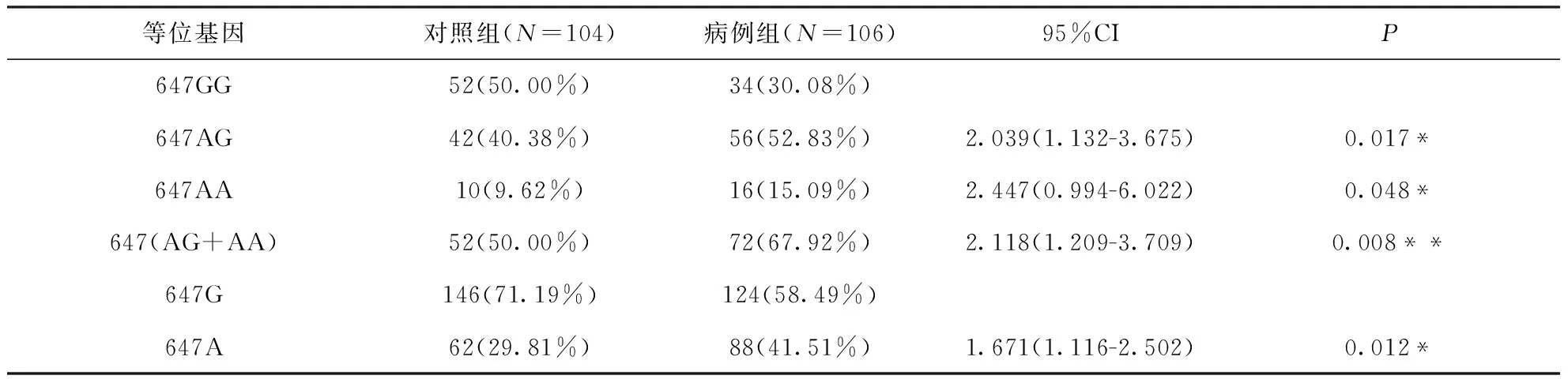
表5 特发性弱精子症和正常组中ODF1(c.G647A)的基因型和等位基因频率
注:*P<0.05和**P<0.01具有统计学意义
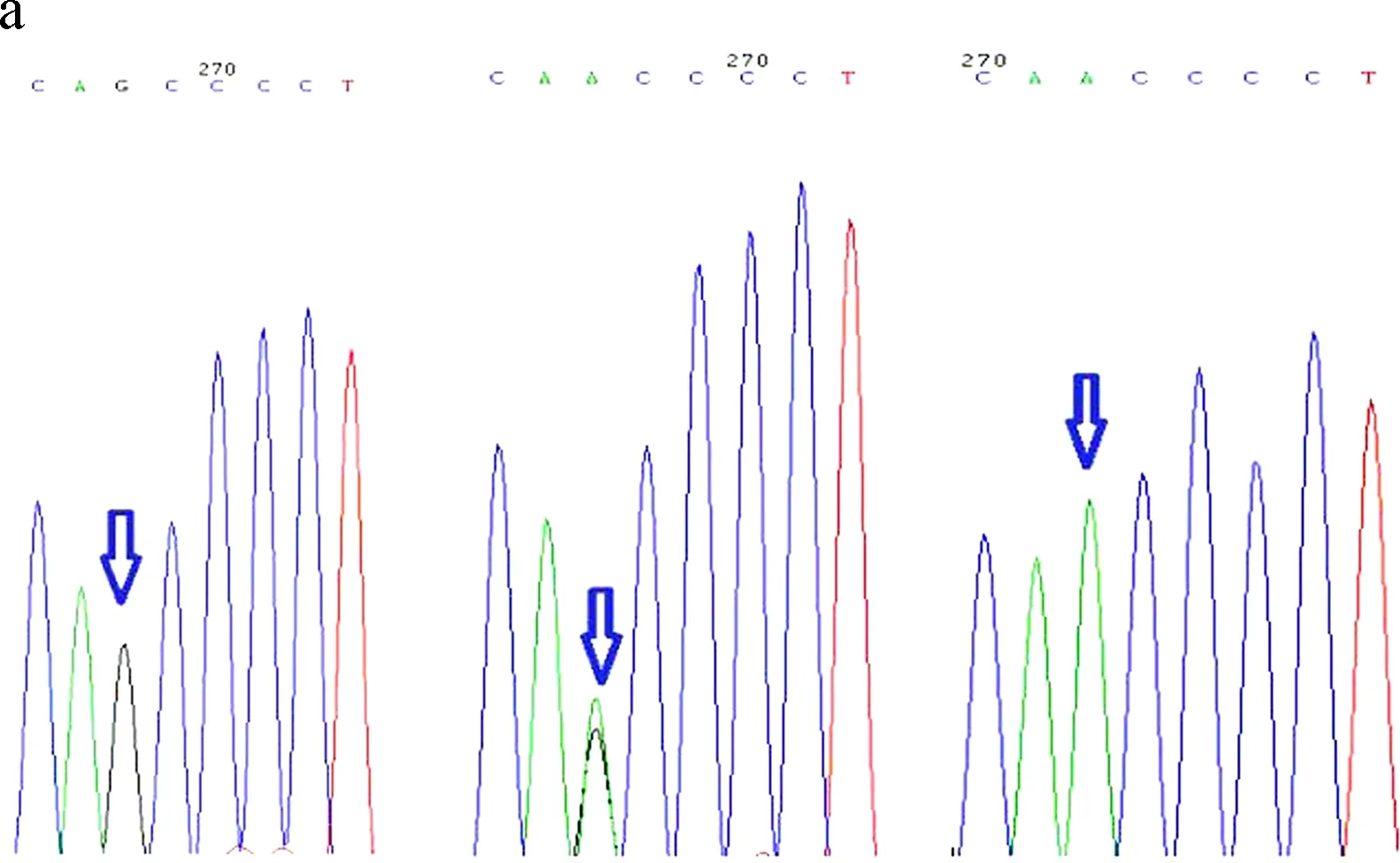
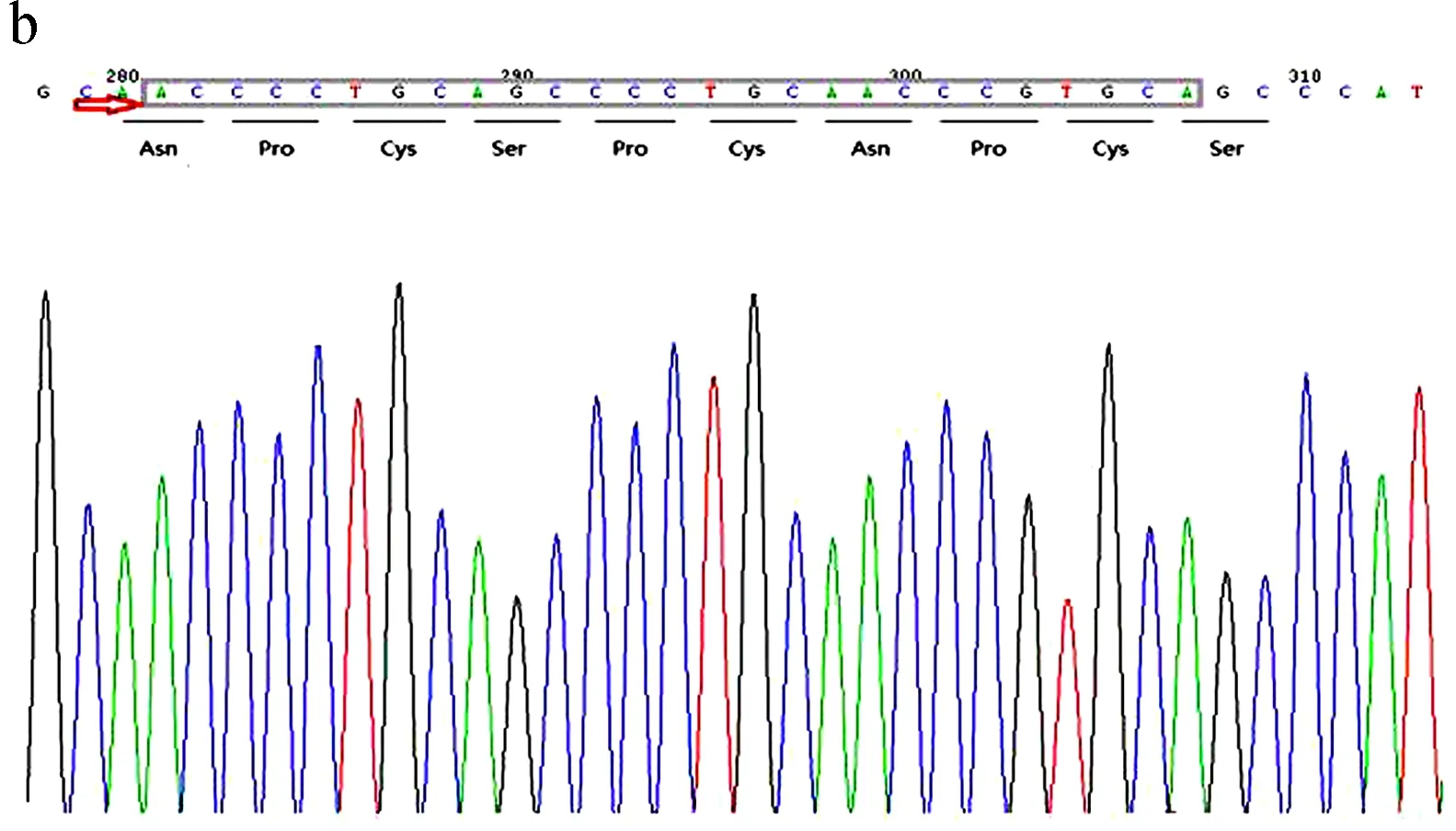



图1 ODF1基因中突变的序列峰图
a图为c.G647A的峰图,从左到右依次为的野生纯合子(GG)、突变杂合子(GA)、突变纯合子(AA);b图为27-bp缺失的的峰图,从上到下依次为野生纯合子、缺失杂合子、缺失纯合子; c图为27-bp 缺失导致10个氨基酸缺失
Fig.1 Sequencing mutations of ODF1 gene
a. sequencing analysis of c.G647A from left to right: wild homozygote (GG), mutant heterozygote (GA), mutant homozygote (AA); b. sequencing analysis of 27-bp deletion from top to bottom: wild homozygote, deletion heterozygote, deletion homozygote;c. 27-bp deletion caused ten amino acids deletion
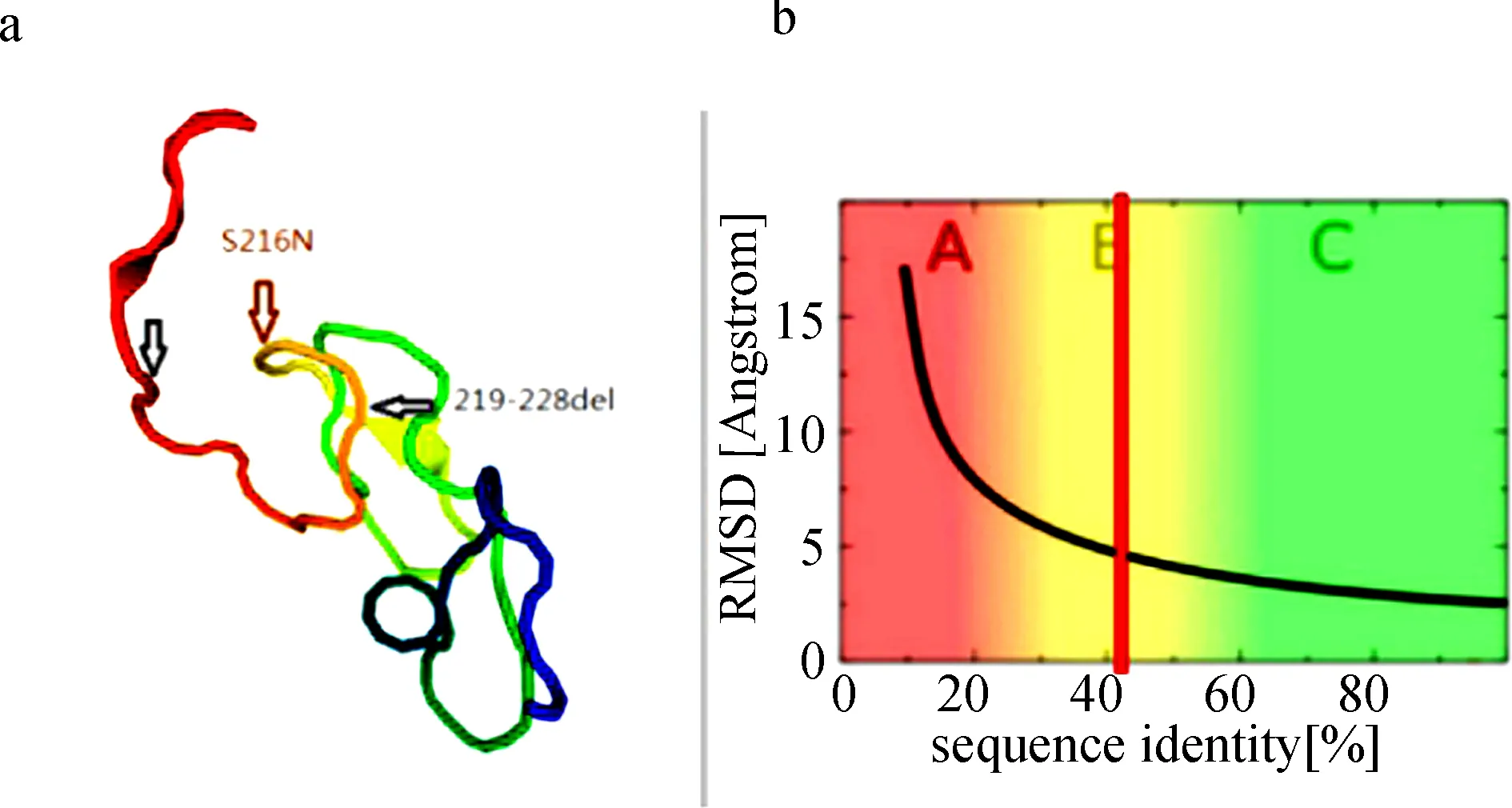
图2 PMP蛋白质模型软件中ODF1的蛋白质结构模型
a突变位点在ODF1蛋白三维结构中的位置; b该模型基于42%序列标识的目标模板序列对齐
Fig.2 Protein structure model of ODF1 was given from the protein model portal
a. The location of mutation in ODF1 protein 3D structure; b. this model is based on target-template sequence alignment of 42% sequence identity

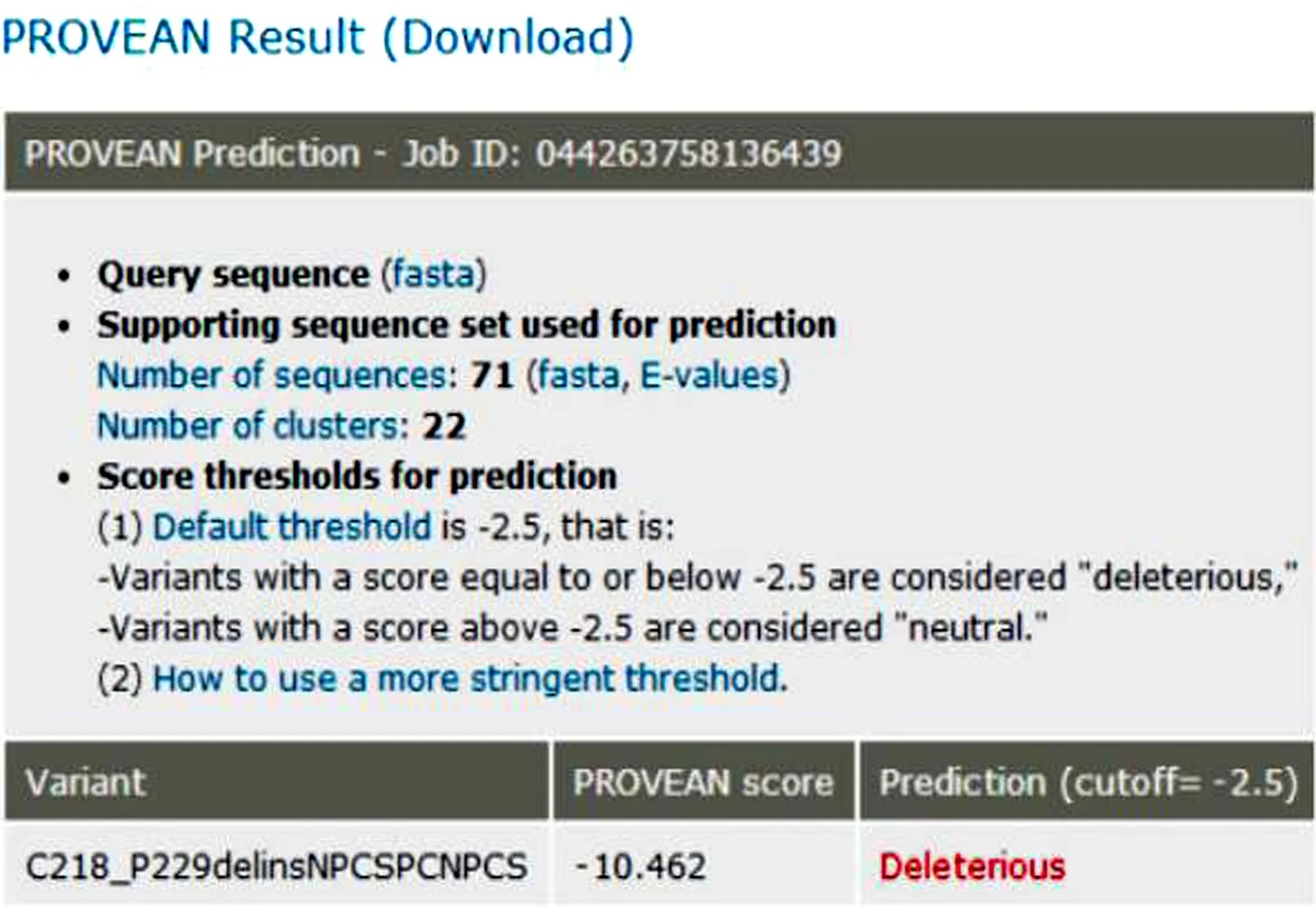
图3 PROVEAN分析预测突变对ODF1蛋白功能影响
Fig.3 PROVEAN analysis predicts the effect of mutation on the function of ODF1 protein
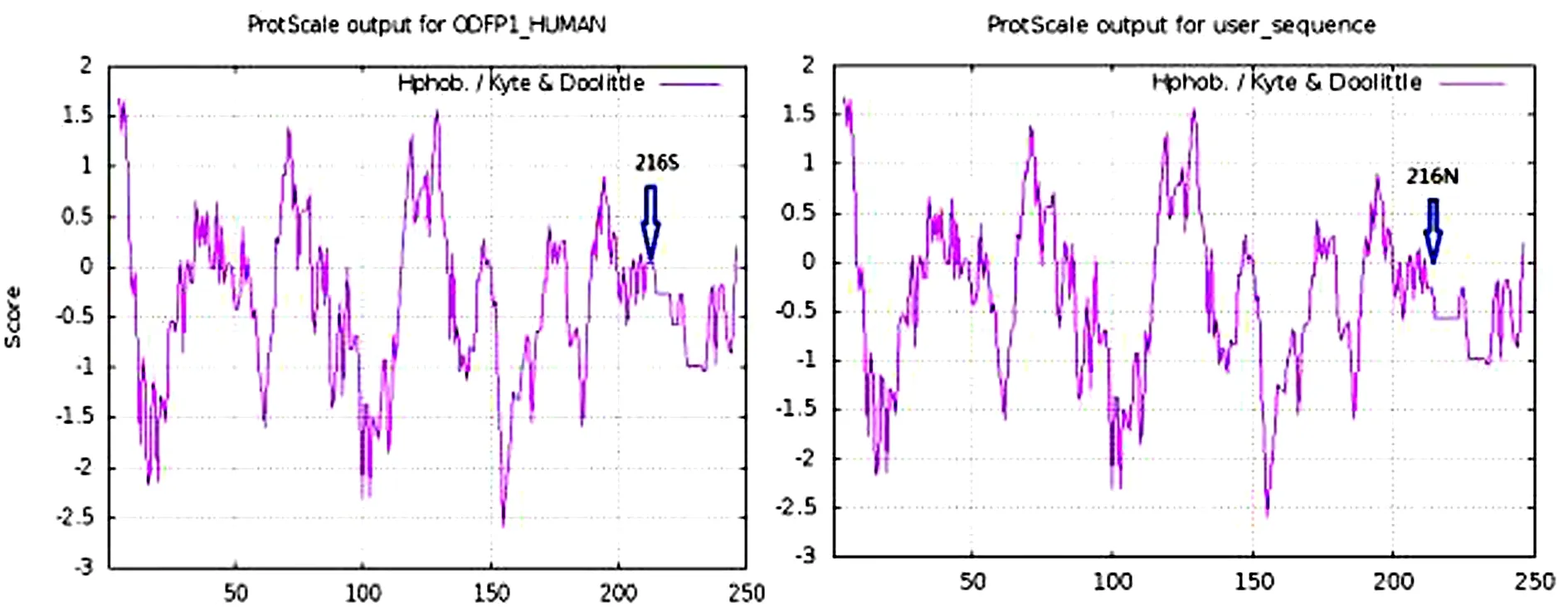
图4 Expasy-ProtScale软件分析ODF1蛋白中S216N的亲疏水性
Fig.4 The hydrophobicity of S216 N in ODF1 protein was analyzed by Expas-ProtScale software
4 讨 论
精子活力即依靠精子尾部鞭毛的不断摆动完成向前运动的能力, 已经被证实是引起男性不育的重要因素之一[9].AZS常表现为精子活力低下, 因此精子鞭毛的形态和结构异常均可以导致精子运动障碍.大量研究显示, 染色体异常、Y染色体微缺失和基因变异也与AZS有关联[10-11].近年来随着研究的不断深入, 已鉴定了许多与精子形成密切相关的基因[4].
ODFs蛋白作为一种特异性表达在精子尾部的细胞骨架结构, 是支持精子运动的重要组成成分.它由9根纵向平行的柱状蛋白围绕而成, 每一根致密纤维都与其对应二联微管相互平行, 外周包裹着纤维鞘, 主要表达在精子尾部[12-13].ODF1和ODF2是ODFs种蛋白中最主要的两种蛋白.ODF1蛋白的N末端是与亮氨酸拉链结构相似的两性α螺旋结构, C末端是重复的三肽结构(Cys-Gly-Pro, CGP)[14-15].由于ODF1蛋白蜷曲成棒状结构, 因此推测, N末端的亮氨酸拉链结构和C末端的三肽重复结构在ODF1蛋白自身的作用或与其他蛋白相互作用中可能起着一定的作用, 从而实现对精子运动的调节[9, 16].
在此次研究中, 我们发现ODF1基因中27-bp缺失变异体在弱精子症患者中杂合子(A-G/A27G)和纯合子(A27G/A27G)的频率和为64.15%, 在对照组中为45.19%, 病例组和对照组之间的显著性增加(OR=2.396, 95%CI=1.348~4.259,P=0.003), 这表明27-bp缺失变异体可能增加精子形成过程中发生障碍的风险(OR=1.783, 95%CI=1.178~2.700,P=0.006).且PROVEAN软件预测这一缺失可能对蛋白质功能造成潜在损害.借助MEGA软件发现在这缺失的10个氨基酸序列中存在4个类似的C-X-P的结构(图1), Krausz等[12]研究表明果蝇中重复的三肽结构(Cys-Gly-Pro, CGP)缺失直接导致功能精子中减少2倍的mRNA.Lourenco等[10]也证实了弱精子症组中ODF1基因转录的mRNA明显低于正常人, ODF1蛋白的平均带强度较低, 数量较少.对于约为27 kDa的ODF1小分子蛋白质来说, 侧面保守区域内10个氨基酸的缺失可能直接对蛋白质功能产生不利影响[17].除此之外, ODF1蛋白作为一种小的热休克蛋白(sHSP), 可以与其他蛋白相互影响, 如Sha等[18]发现SUN5基因中c.381delA突变不仅会导致SUN5蛋白的表达量下降, 也会改变ODF1蛋白的在精子尾部的分布情况.因此, ODF1基因中的4个类似的C-X-P序列结构缺失可能导致了ODF1基因转录的mRNA减少, 同时也会影响其他蛋白的表达量, 进而引起弱精子症患者精子的活力下降.
此外, 我们还检测到一个错义突变(c.G647A)将216位的丝氨酸转变为天冬酰胺.在PROVEAN软件中被预测为中性突变, 但我们通过亲水性观测发现氨基酸的改变导致蛋白质的表面的亲疏水性下降(图4), 可引起蛋白质在相应位点疏水不平衡, 对蛋白质的功能造成影响[4].因此, 需要进一步评估错义突变带来的影响.
综上所述, 此次研究结果表明ODF1基因中27-bp缺失变异体极有可能与四川地区特发性弱精子症男性不育相关.考虑到区域遗传差异和较小的样本量, 未来需要扩大研究标本的数量以及选取来自不同区域的样本, 为诊断和治疗男性弱精子症提供理论基础.

