人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺功能影响及机制研究
罗文娟 王灿敏 叶敏宜
百草枯(1,1-二甲基-4,4二氯二吡啶,PQ)作为一种除草剂被广泛用于农业生产,百草枯误服进入体内会引起肺、肝脏、肾脏、肌肉等组织器官的急性不可逆损伤,中晚期会肺部纤维化而造成呼吸衰竭,引起死亡[1,2]。目前,百草枯引发损伤的机制尚不明确,常用的治疗药物主要有抗纤维化制剂、抗氧化剂、免疫抑制剂以及糖皮质激素等,但是并没有有效的拮抗药物,临床治疗仍然存在巨大挑战[3]。
传统中药三七具有活血化瘀、消肿止痛的药理作用,其主要成分是三七总皂苷,包括人参皂苷Rb1、人参皂苷Rg1、三七皂苷R1等,其中人参皂苷Rb1作为主要的活性单体成分之一,具有抗氧化、免疫调节、抗衰老等药理作用,药效明显且对多种疾病皆有明显的调节作用[4~6]。但是人参皂苷Rb1对百草枯所致的肺部纤维化以及呼吸衰竭的作用及机制并未有研究报道。Wnt信号通路是一条高度保守的信号通路,调控多种蛋白的表达,其中包括对肺纤维化标志物MMP表达的调控,但人参皂苷Rb1是否能通过调节Wnt信号通路而影响百草枯所致肺部纤维化尚无报道。本研究旨在探究人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺功能的影响,通过检测肺干湿重比评价肺水肿情况,检测炎性因子水平以评价体内炎性反应程度,通过病理切片观察三七皂苷对肺组织结构的影响,并通过检测Wnt信号通路关键蛋白表达,以探究其潜在作用机制,为临床的治疗提供帮助。
材料与方法
1.材料:健康清洁级SD大鼠,50只,体质量150~180g[南京卡文斯生物技术有限公司提供,实验动物许可证号:SCXY(苏)2016-0010];百草枯原液[浓度20%,由英国先正达(中国)科技股份有限公司生产];人参皂苷Rb1(四川成都瑞芬思生物科技限公司);TNF-α、IL-6、IL-1β的ELISA检测试剂盒(天津安诺瑞康生物技术有限公司);GRP78抗体、β-catenin抗体、GAPDH抗体、MMP2抗体、HRP-羊抗兔二抗(武汉三鹰生物技术有限公司);BCA蛋白定量试剂盒(沈阳万类生物技术有限公司);超敏发光液(沈阳万类生物技术有限公司);多功能酶标仪(德国BMG Omega公司);电泳仪(南京大学仪器厂);微型垂直电泳槽(上海天能科技有限公司);凝胶成像仪(美国Bio-Rad公司);AniRes2005动物肺功能仪(北京贝兰博科技有限公司)。
2.动物造模及给药:将50只SD大鼠随机分成5组,即G1组(对照组)、G2组(模型组)、G3组(人参皂苷Rb1低剂量组)、G4组(人参皂苷Rb1中剂量组)、G5组(人参皂苷Rb1高剂量组),G2、G3、G4、G5各组均用20%的百草枯溶液以40mg/kg的剂量灌胃,构建大鼠百草枯中毒呼吸衰竭模型,G1组给予等体积0.9%NaCl溶液;造模1天后各组给药治疗7天(具体给药设置、给药剂量、给药方式见表1;治疗期间每天测量大鼠体质量变化,观察大鼠活动、精神、呼吸及饮食等生理状况;7天后,取血并处死大鼠,解剖取肺组织,拍照观察。

表1 人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺功能影响实验给药分组
3.大鼠肺功能检测:实验结束后,各组大鼠腹腔注射水合氯醛麻醉,于喉部切开,分离气管与呼吸机连接,外力加压,使大鼠深吸气、深呼气,AniRes2005动物肺功能仪检测大鼠肺功能各指标,主要检测指标有25%肺活量的最大呼气流量(FEF25)、50%活量的最大呼气流量(FEF50)、75%肺活量的最大呼气流量(FEF75)、用力最大呼气流量(PEF)。
4.肺湿干重比(W/D)检测:给药7天结束后,颈椎脱臼处死大鼠,解剖取大鼠肺组织,分离左肺后称重计为湿重;称重后将左肺置于60℃烘箱中干燥24h,称重计为干重;肺湿干重比(W/D)=湿重/干重,用于评价肺水肿情况。
5.ELISA法检测血清TNF-α、IL-6、IL-1β含量:给药7天结束后,取血,将所取血液3000×g、4℃离心5min,收集上层血清于无菌离心管中;按照ELISA检测试剂盒说明书,标准品孔中加入50μl标准品,待测样品孔加入40μl待测样品和10μl生物素标记抗体,然后分别在标准品孔和待测样品孔100μl辣根过氧化物酶标记抗体,37℃孵育75min后,清洗5次并弃尽孔内液体,分别加入50μl显色剂Ⅰ/Ⅱ,避光反应15min,每孔加入50μl终止液,使用酶标仪于450nm波长处测吸光度,根据标准曲线计算血清TNF-α、IL-6、IL-1β含量。
6.组织HE染色:取各组大鼠右肺于组织固定液中固定72h,经梯度乙醇脱水、透明、石蜡浸泡与包埋后制成组织切片,然后将石蜡切片进行透明水化、苏木精-伊红(HE)染色、封片后于显微镜下观察拍照。
7.Western blot法检测肺组织β-catenin、 GRP78、MMP2的表达:取各组大鼠肺组织,加入裂解液和蛋白酶抑制剂,用匀浆机冰上充分匀浆后于4℃继续裂解30min, 12000r/min离心5min,取上清即为总蛋白;BCA蛋白定量后进行SDS-PAGE凝胶电泳,转膜,用5%的脱脂牛奶对PVDF膜封闭2h,然后以稀释后的GAPDH、GRP78、MMP2一抗4℃孵育过夜,TBST洗膜后二抗室温孵育1.5h,再用TBST洗膜后按照ECL试剂盒说明书配置发光液,并将PVDF膜浸入发光液中反应30s,曝光并拍照,用Image J软件曝光结果进行定量分析。
8.统计学方法:实验数据均用 GraphPad Prism 5 软件制图,采用SPSS 20.0统计学软件对数据进行统计分析,两组之间均数比较,采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1.大鼠一般情况观察:对照组大鼠进食和饮水正常,体质量上升明显,呼吸平稳正常,无异常反应;模型组大鼠给药1~2天即出现精神萎靡、身体发抖、进食和饮水均减少,且出现呼吸急促、频繁张口等呼吸衰竭样体征等异常体征;3~7天上述现象更加显著,呼吸更加急促且出现点头呼吸等现象,表明呼吸衰竭加重,提示百草枯所致呼吸衰竭造模成功;人参皂苷Rb1低剂量组亦出现上述现象,但均轻于模型组;随着人参皂苷Rb1给药剂量的加大,中剂量组和高剂量组大鼠以上异常体征也逐渐减弱;体质量变化见图1。
2.人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺功能影响:根据各组大鼠肺功能检测结果(表2),与对照组比较,模型组FEF25、FEF50、FEF75、PEF均显著下降(P<0.05),提示造模成功;与模型组比较,人参皂苷Rb1低、中、高剂量组FEF25、FEF50、FEF75、PEF均显著上升(P<0.05)。
3.人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺组织湿干重比影响:模型组大鼠左肺的湿干重比均高于对照组(P=0.000),模型组大鼠肺水肿明显;人参皂苷Rb1低、中、高各组湿干重比均显著小于模型组(P<0.01),并且随着给药剂量的增加肺组织水肿逐渐减轻(表3)。
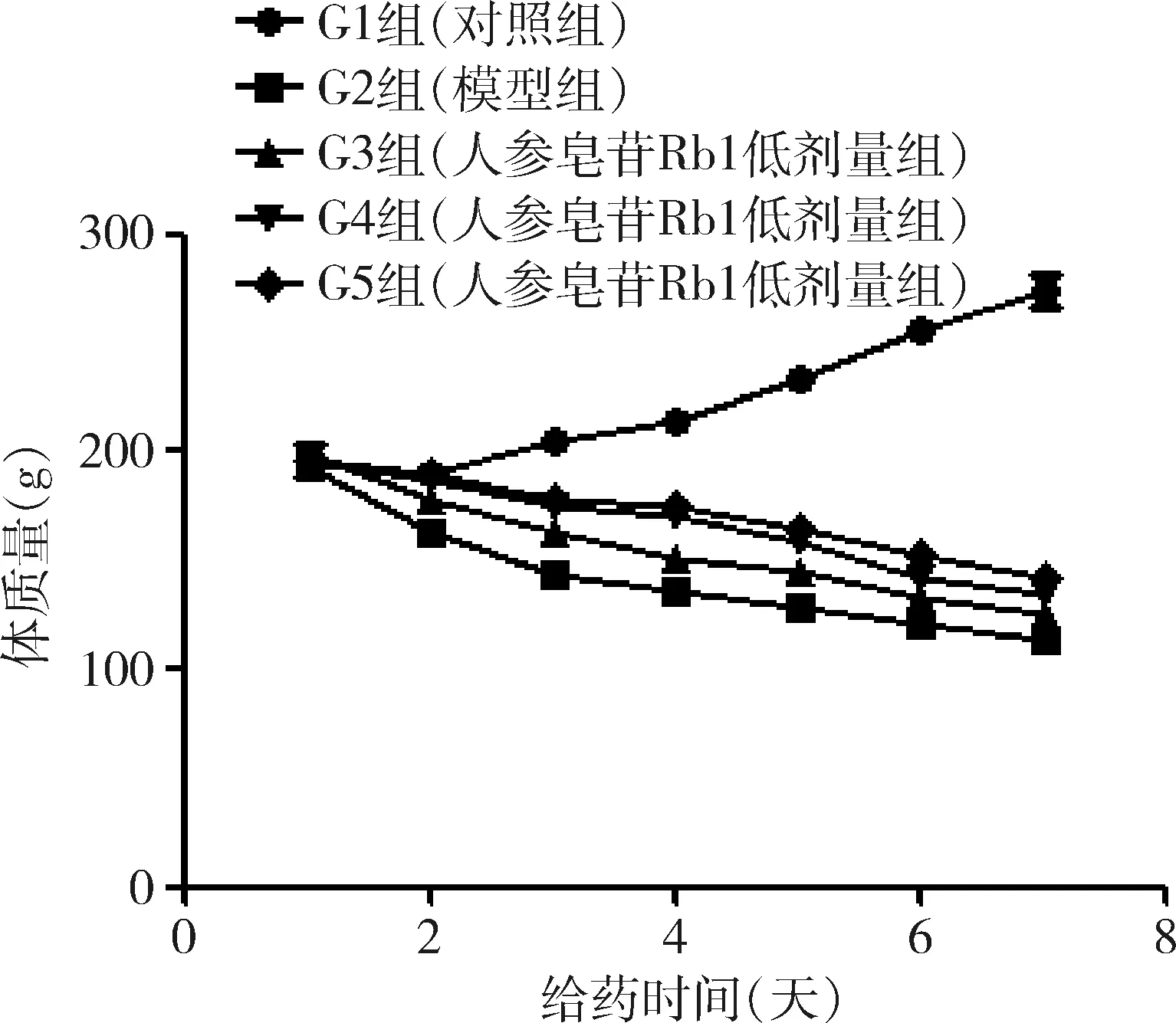
图1 人参皂苷Rb1低、重、高剂量对百草枯所致呼吸衰竭大鼠体质量影响
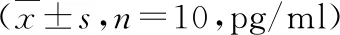
表2 人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺功能的影响
与对照组比较,*P=0.000;与模型组比较,#P<0.05,##P<0.01,###P=0.000
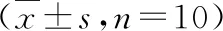
表3 人参皂苷Rb1低、中、高剂量对百草枯所致呼吸衰竭大鼠肺湿干重比影响
与对照组比较,*P=0.000;与模型组比较,#P=0.000
4.人参皂苷Rb1对百草枯所致呼吸衰竭大鼠血清TNF-α、IL-6、IL-1β影响:ELISA法检测各组大鼠血清TNF-α、IL-6、IL-1β浓度结果显示,与对照组比较,模型组、人参皂苷Rb1低、中、高剂量组大鼠血清TNF-α、IL-6、IL-1β含量均显著上升(P=0.000);与模型组比较,人参皂苷Rb1低、中、高剂量组大鼠血清TNF-α、IL-6、IL-1β含量显著减少(P=0.000),且呈现浓度依赖性(表4)。
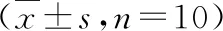
表4 人参皂苷Rb1对百草枯所致呼吸衰竭大鼠血清TNF-α、IL-6、IL-1β影响
与对照组比较,*P=0.000;与模型组比较,#P<0.01,##P=0.000
5.人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺组织形态学及病理学影响:对照组大鼠肺组织颜色鲜红、质地柔软、表面光滑且颜色均一、表面无斑点和出血点、无组织病变等现象;模型组大鼠肺组织颜色暗沉且发白,表面无光泽,质地坚硬、表面有明显的出血点且有大量水泡出现、组织病变明显,表明造模成功;人参皂苷Rb1低剂量组表面暗沉、质地较硬、有明显出血点和水泡,但组织病变情况均轻于模型组;随着人参皂苷Rb1给药剂量的增加,人参皂苷Rb1中剂量和高剂量组病变特征逐渐变弱,但与空白对照组比较仍有明显病变(图2)。HE染色结果(图3)显示,对照组大鼠的肺组织结构完整,肺泡腔结构完整且清晰,无炎性细胞浸润,肺间质无明显的充血和水肿等不良病理变化;模型组大鼠肺组织结构严重病变,无清晰的肺泡结构,有严重的炎性细胞浸润,肺间质水肿且充血极为显著,并且伴有严重的微血栓生成;人参皂苷Rb1低剂量组肺组织结构不完整,亦无清晰的肺泡结构,同时具有大量的炎性细胞浸润和大量的微血栓形成;随着给药剂量的增加,上述病理变化逐渐减轻,但是与对照组比较仍然存在明显的病理改变。
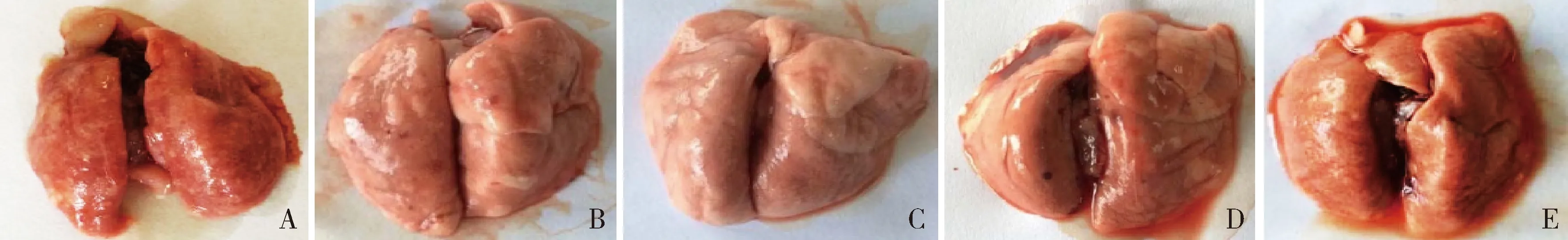
图2 各组大鼠肺组织形态比较图A.对照组;B.模型组;C.人参皂苷Rb1低剂量组;D.人参皂苷Rb1中剂量组;E.人参皂苷Rb1高剂量组

图3 各组大鼠肺组织HE染色结果比较图(×400)A.对照组;B.模型组;C.人参皂苷Rb1低剂量组;D.人参皂苷Rb1中剂量组;E.人参皂苷Rb1高剂量组
6.人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺组织GRP78、MMP2以及Wnt信号通路中β-catenin蛋白表达水平的影响:Western blot法检测结果显示,与对照组比较,模型组、人参皂苷Rb1低、中、高剂量组GRP78、MMP2、β-catenin的表达量显著增加(P=0.000),百草枯可引起肺部内质网应激反应,激活Wnt信号通路,促进MMP2的表达;与模型组比较,人参皂苷Rb1低、中、高剂量组GRP78、MMP2、β-catenin的表达量显著降低(P<0.01),且随着人参皂苷Rb1给药剂量的增加GRP78、MMP2、β-catenin的表达量逐渐降低(图4)。
讨 论
百草枯作为一种毒性物质,一旦进入体内就会引起人体不可逆的急性损伤,百草枯中毒24h以上会引起严重急性肺、肾脏、肝脏等重要器官的损伤[7]。其中肺组织尤为严重,出现肺部水肿和出血,中毒后肺组织纤维化,引起呼吸窘迫综合征,后期因呼吸衰竭以及肺功能丧失而死亡[8]。目前对于百草枯所致的肺纤维化以及呼吸衰竭等损伤的机制尚不明确,已有研究表明,百草枯所致肺纤维化可能与炎性反应、应激反应、自由基氧化等有关[9]。临床上百草枯中毒主要是由口服引起,故本实验采用20%的百草枯溶液灌胃的方法建立百草枯所致大鼠呼吸衰竭模型,给药后使用动物肺功能仪检测各组大鼠肺功能,发现人参皂苷Rb1能够显著提高百草枯所致呼吸衰竭大鼠肺功能。
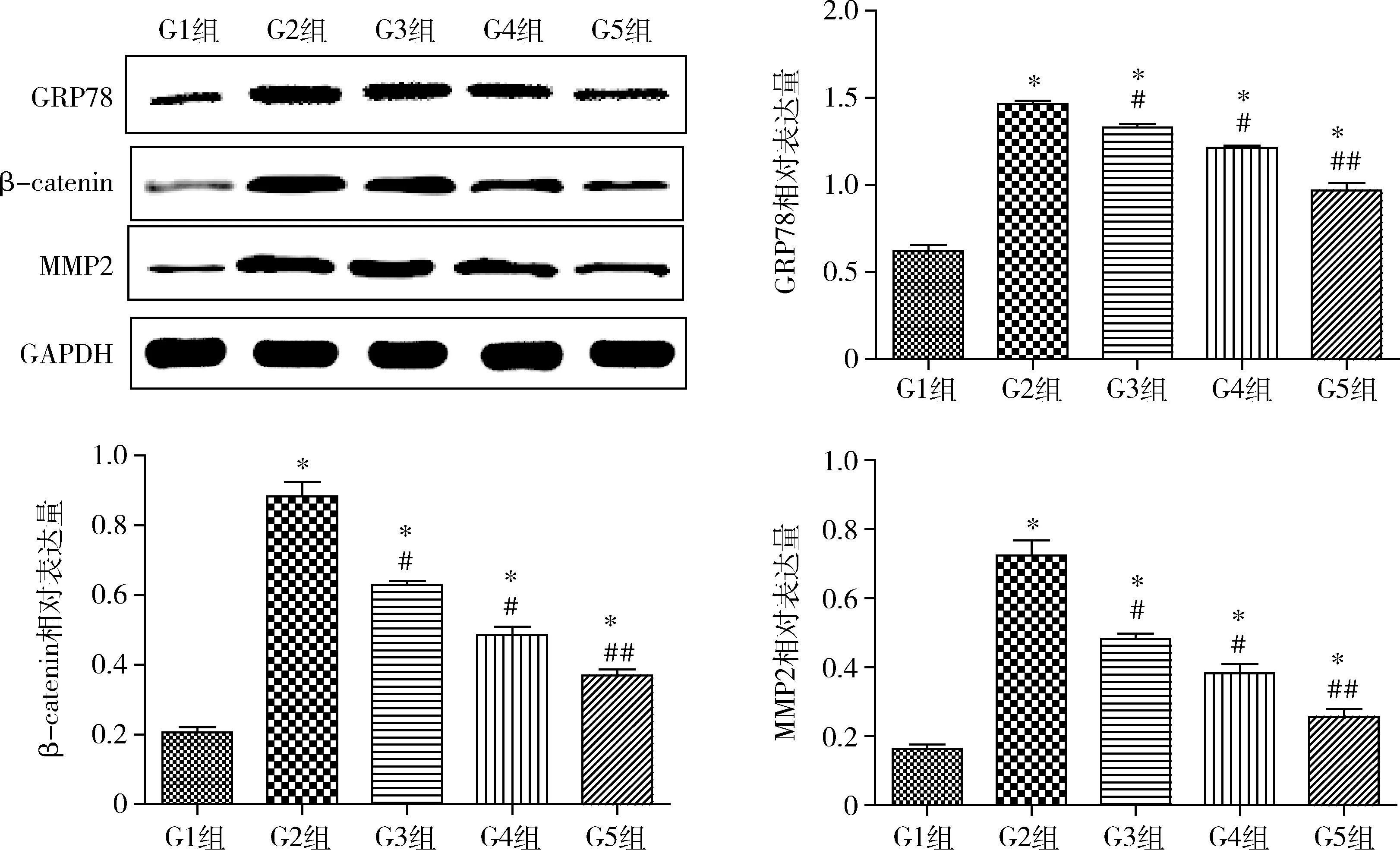
图4 人参皂苷Rb1对百草枯所致呼吸衰竭大鼠肺组织GRP78、MMP2、β-catenin相对表达量的影响G1、G2、G3、G4、G5组分别为对照组、模型组、人参皂苷Rb1低、中、高剂量组;与对照组比较,*P=0.000;与模型组比较,#P<0.01,##P=0.000
百草枯所致肺组织损伤的主要临床表现为肺纤维化所引起的严重肺水肿,本实验中,人参皂苷Rb1各给药组肺组织湿干重比显著降低,肺水肿情况得到有效缓解;炎性反应是百草枯所致肺纤维化的主要临床病理反应,亦是肺组织纤维化的启动条件[10]。主要表现为巨噬细胞等活化后释放大量TNF-α、IL-6、IL-1β等炎性性子,炎性因子的增多会进一步扩大肺组织炎症,而本研究发现人参皂苷Rb1能够显著抑制TNF-α、IL-6、IL-1β的释放,进而缓解肺部炎症[11]。
内质网应激是指在机体出现缺氧、氧化应激、异常糖基化、钙离子稳态失衡等情况下,内质网未折叠的蛋白质会明显增多,细胞会激活一些相关信号级联反应,来恢复内质网良好的蛋白质折叠环境[12,13]。已有研究表明,内质网应激所引起的中性粒细胞激增会导致急性肺损伤,呼吸衰竭,引起死亡。GRP78作为内质网的主要成分之一,是参与蛋白质的折叠和修复的关键蛋白,对内质网应激反应具有抑制作用,并且已经被广泛用作内质网应激反应的标志蛋白[14,15]。本研究发现人参皂苷Rb1会降低内质网应激标志物GRP78表达量降低,表明人参皂苷Rb1可能通过抑制肺部内质网应激而起到治疗作用。
Wnt信号通路是一条高度保守的信号通路,在细胞的生长、发育、分化等生理过程中发挥重要的作用,该通路中的关键蛋白β-catenin具有调控下游靶基因MMP表达的作用,在肺组织纤维化的过程中,MMP的表达量也上调,临床上已将MMP作为肺纤维化的标志物[16~20]。本研究发现,人参皂苷Rb1各给药组大鼠肺组织中β-catenin和MMP2表达量均显著下调,表明人参皂苷Rb1或可通过抑制Wnt信号通路,降低MMP2的表达而降低肺组织纤维化。
综上所述,人参皂苷Rb1对百草枯所致的大鼠呼吸衰竭有治疗作用,其机制可能是缓解机体炎性反应,抑制肺组织内质网应激,以及抑制Wnt信号通路而降低MMP的表达,但具体的机制还需要进一步探讨。
——疾病防治的新靶标

