不同年龄幽门螺杆菌感染与胃部疾病关系分析
张蓓琳,符策月,黄玉伟
(上海市第一人民医院宝山分院,上海)
0 引言
随着对幽门螺杆菌(Helicobacter pylori, Hp)的不断深入研究,Hp的致病危害性越来越得到人们的关注。但Hp耐药菌株的不断产生、昂贵的Hp根治费用、药物的不良反应等导致Hp根治失败的因素常常困扰着我们。本文通过对13年前后不同年龄Hp感染与胃部疾病关系的分析,试图为进一步完善Hp根治方案提供一些依据。
1 材料与方法
1.1 一般资料
选取我院2015年1月至2015年12月、2018年1月至2018年12月因体检或各种不适等原因行胃镜检查,资料完整并剔除近两周服用抑酸药物、糖皮质激素、非甾体类抗炎药和抗生素者。2015年共2179例,年龄20-85岁,其中男1125人,女1054人;2018年共4263例,其中男2232人,女2031人。年龄<65岁为中青年组,年龄≥65岁为老年组。诊断标准符合我国2000年5月全国慢性胃炎研讨会共识意见,[1]各组分别按胃镜和/或组织病理学检查结果分为浅表性胃炎为对照组;糜烂性胃炎组,萎缩肠化组、不典型增生组、胃癌组、胃溃疡组为观察组。所有入选者中,2015年Hp阳性率,男52.1%(586/1125)女48.2%(508/1054),χ2=3.30,P>0.05,差异无显著性。2018年Hp阳性率,男40.55%(1327/2232),女 39.04%(1698/2565),χ2=1.00,P>0.05,差异无显著性。
1.2 Hp阳性诊断标准
以13C呼气试验或活检组织(Warthin-Starry,W-S)染色阳性者诊断为Hp阳性。
1.3 统计分析
所有数据以率表示,经χ2检验,以P<0.05为差异有显著性意义。
2 结果
2.1 中青年组
2005年中青年组1683例,Hp阳性率,浅表性胃炎组32.4%(199/615),糜烂性胃炎组 46.8%(89/190),萎缩肠化组 67.4%(310/460),不典型增生组 77.8%(7/9),胃癌组 60%(9/15),胃溃疡组86.1%(31/36)。与对照组浅表性胃炎组相比,各组均为P<0.05,差异有显著性意义。见表1。2018年中青年组3259例,Hp阳性率,浅表性胃炎组2.9%(42/1440),糜烂性胃炎组82.8%(788/951),萎缩肠化组37.9%(489/1290),不典型增生组47.4%(18/38),胃癌组69.2%(9/13),胃溃疡组85.8%(127/148)。与对照组浅表性胃炎组相比,各组均为P<0.05,差异有显著性意义,见表2。

表1 2005年中青年各组胃病Hp阳性率(%)
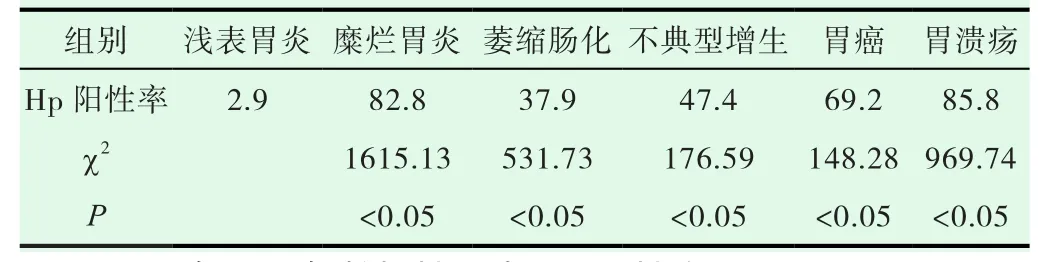
表2 2018年中青年各组胃病Hp阳性率(%)
2.2 2018年不同年龄慢性胃炎Hp阳性率
2018年资料显示Hp阳性率,各年龄段的糜烂性胃炎组均高于萎缩肠化组,差异均有显著性,且高峰在<30岁,见表3。2018年与2005年比较,Hp阳性率,糜烂性胃炎组2018年高于2005年,P<0.05,差异有显著性意义;浅表性胃炎组、萎缩肠化组、不典型增生组2018均低于2005年,均为P<0.05,差异均有显著性。胃癌组因例数少差异无显著性意义。胃溃疡组差异无显著性意义,见表4。
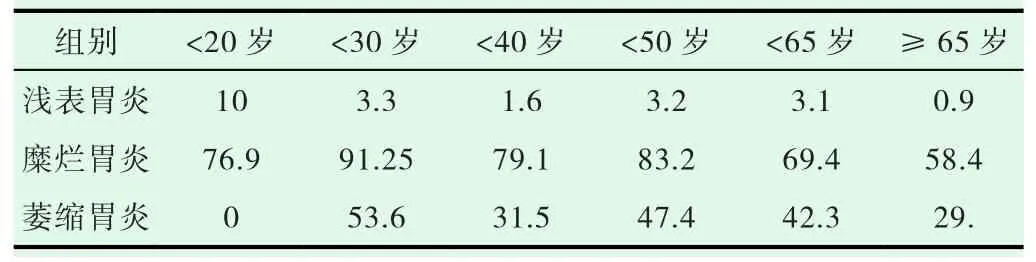
表3 2018年不同年龄慢性胃炎Hp阳性率(%)
2.3 老年组
2005老年组496例,Hp阳性率,浅表性胃炎组33.3%(21/63),糜烂性胃炎组36.2%(17/65),萎缩肠化组44.4%(118/266),不典型增生组 44.4%(4/9),胃癌组 20%(3/15),胃溃疡组 59.1%(13/22)。与对照组浅表性胃炎组相比,胃溃疡组P<0.05,差异有显著性意义;其余各组差异均无显著性意义,见表5。2018老年组726例,Hp阳性率,浅表性胃炎组0.9%(2/215),糜烂性胃炎组58.4%(57/89),萎缩肠化组29.1%(123/422),不典型增生组29.4%(5/17),胃癌组55.6%(5/9),胃溃疡组62.3%(33/53)。与对照组浅表性胃炎组相比,各组均为P<0.05,差异有显著性意义,见表6。
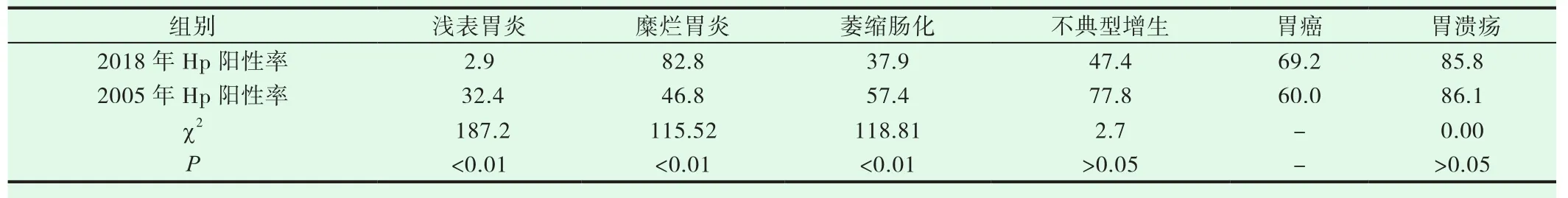
表4 2018年、2005年中青年各组胃病Hp阳性率(%)比较
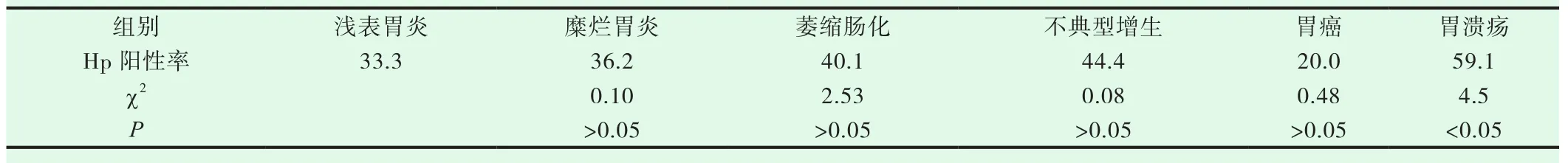
表5 2005年老年各组胃病Hp阳性率(%)
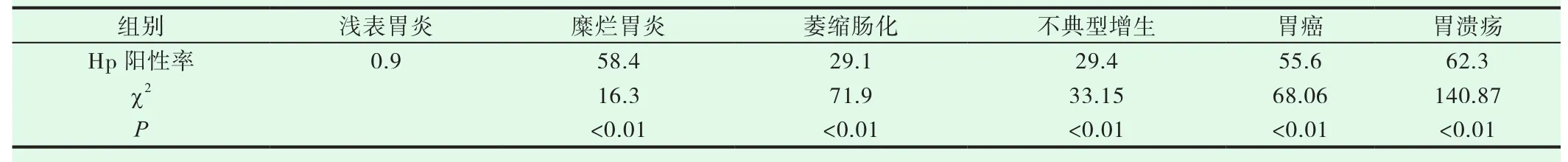
表6 2018年老年各组胃病Hp阳性率(%)

表7 2018年、2005年老年各组胃病Hp阳性率(%)比较
2018年与2005年比较,Hp阳性率,糜烂性胃炎组、胃癌组2018年均高于2005年,浅表性胃炎组、萎缩肠化组、不典型增生组2018均低于2005年。浅表胃炎、糜烂胃炎、萎缩胃炎P<0.01,差异均有显著性。胃溃疡组差异无显著性。不典型增生和胃癌组因例数少而差异无显著性意义,见表7。胃癌检出率2018年1.23%低于2005年检出率3.02%,差异有显著性意义,见表8-9。
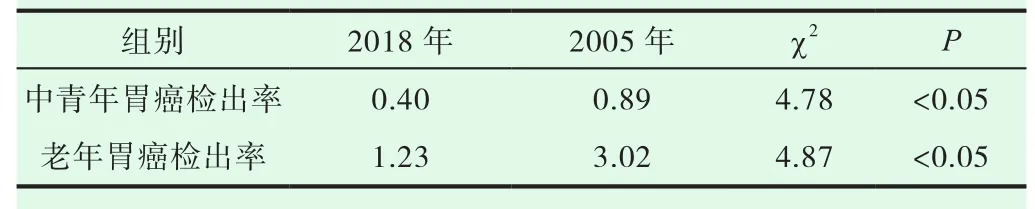
表8 2018年、2005年胃癌检出率(%)比较
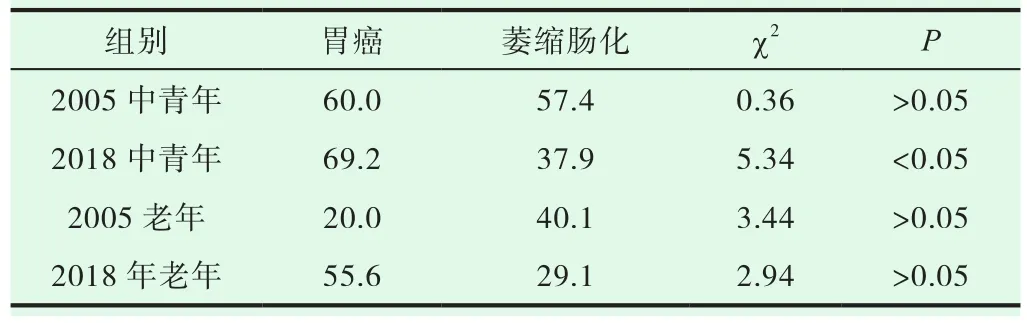
表9 胃癌与萎缩肠化组Hp阳性率(%)比较
3 讨论
本次回顾性分析发现,2018年Hp阳性率男40.55%,女39.04%,性别差异无显著性意义;均较2005年明显下降,低于全国幽门螺杆菌的总感染率56%[2]。Hp按是否表达细胞毒素相关基因(cagA)和空泡细胞毒素基因(vacA),分为I型和II型。I型Hp为高毒力株,在我国等亚洲地区,感染较为普遍;其产生的细胞毒素相关蛋白A和空泡毒素能导致广泛炎症,从中产生的白介素-8(IL-8)等炎症介质能使中性粒细胞活化聚集,诱导急性炎症细胞产生严重的突发性氧化作用,直接损伤上皮细胞,促进溃疡发生[3-5]。这与本次观察分析不同年份不同年龄的胃溃疡组均与Hp感染密切相关且差异无显著性意义一致。
研究表明,几乎所有的Hp感染者在组织学上均存在不同程度的胃黏膜活动性炎症。通常以腺体颈部的炎症为著[6,7],该部正是胃黏膜表层上皮更新、腺体再生的关键部位。目前Hp的传播途径通过人与人之间传播和环境传播,常始于儿童时期,且随着年龄的增长,呈发生、发展和消退趋势,而癌前期病变则呈发生发展趋势[8-9]与本次分析发现2018年各年龄段糜烂性胃炎组Hp阳性率均大于萎缩肠化组,且两种疾病组均以20-29岁Hp阳性率最高,以老年组Hp阳性率最低相符。提示Hp感染与胃黏膜炎症和萎缩肠化密切相关,且高峰在20-29岁。两个年龄组糜烂性胃炎组Hp阳性率2018年均高于2005年;萎缩肠化组、不典型增生组Hp阳性率2018年则均低于2005年;这可能与10余年来人们对Hp根除的重视并不能完全逆转癌前期病变相关。
本次分析发现胃癌组与相应对照组Hp阳性率差异均有显著性意义,随着不同年龄组Hp阳性率2018年较2005年的下降,相应的胃癌发生率2018年亦较2005年下降,P<0.05,差异有显著性意义。提示幽门螺杆菌与胃癌的发生密切相关。但胃癌发病率远低于Hp的感染率,与相应萎缩肠化组比较(除2018年中青年组外)差异均无显著性意义。提示Hp感染可诱发胃上皮细胞增殖和凋亡,这可能是造成不同疾病结局的原因。在胃癌这一发病过程中,Hp的作用可能仅是在其早期萎缩肠化阶段,[10]是一个重要的启动因素,但并不是唯一的因素;可能更多地与遗传基因、机体免疫状态、饮食结构、环境因素等有关。本次数据分析发现,Hp具有普遍易感性,是胃部疾病发生、发展的重要启动因素,与胃炎-萎缩肠化-不典型增生-胃癌的进展过程密切相关。早期对Hp阳性患者的干预治疗,尤其是关注<30岁胃癌高危人群的Hp根除规范治疗,对有效减少胃癌前期病变的发生,降低胃癌发生率具有重要的意义。

