子宫颈癌ADAM12检测及临床预后分析
白 璐 李雯慧 陈必良
子宫颈癌(cervical cancer)在全球妇科恶性肿瘤发生率中位居第3位,据统计全球每年新增病例50万例,每年病死患者26万例[1]。子宫颈癌在发展中国家发生率更高,是女性肿瘤性疾病死亡的主要妇科疾病。病毒感染、基因突变及环境因素是导致子宫颈癌发生、发展的重要因素[2~5]。从宫颈上皮内瘤样病变发展为子宫颈病灶,进而形成子宫颈肿瘤,该过程主要是由人乳头状瘤病毒(human papillomavirus, HPV)感染引发的[6,7]。目前,大量研究报道了与宫颈癌密切相关的原癌基因和抑癌基因,然而调节子宫颈癌病理变化的具体机制仍有待研究,且目前临床上缺乏一种准确、高效预测子宫颈癌患者临床预后的标志物[8~11]。
ADAM金属蛋白酶结构域12基因(ADAM metallopeptidase domain 12, ADAM12)编码了ADAM12蛋白,该蛋白是去整合素和金属蛋白酶家族成员[12]。由于mRNA的不同拼接导致人机体中存在两类ADAM12(又称解链蛋白酶α),分别为长跨膜型(ADAM12-L)和截断分泌型(ADAM12-S),与前者比较后者缺失了跨膜区和胞内区。ADAM12-L和ADAM12-S经过酶解作用,成熟的蛋白会分别转移到细胞膜和胞外[13]。
ADAM12作为预后标志物是因为其主要在病理情况下才激活表达,而在正常组织中通常是严格的表达限制状态[14]。除了在人的胎盘组织及在胚胎发育成肌肉和骨组织过程中瞬时表达升高外,在后天生长的健康机体和非损失器官中ADAM12表达均处于较低状态[15]。研究表明,ADAM12在人类多种肿瘤组织中表达增加,例如胃癌、前列腺癌、肺癌、脑癌、骨癌、肝癌及乳腺癌等[16~22]。然而,ADAM12在子宫颈癌中的表达情况尚未见详细报道,本研究通过检测和比较子宫颈癌患者肿瘤组织及癌旁组织中ADAM12表达,验证ADAM12能否作为该疾病的预后标志物。
材料与方法
1.患者及样品:本研究中使用的子宫颈癌组织、癌旁组织及尿液样品(距离肿瘤组织≥3cm)样品(各78例)均采集2008年1月~2012年1月笔者医院妇科诊治的子宫颈癌患者,所有患者均采用病理学方法进行确诊,收集同期80例在笔者医院健康体检的正常人群尿液样品作为对照。采用国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)标准对子宫颈癌患者进行临床分期,详见表1。患者随访时间为2~71个月,随访截至时间2018年2月。本研究获得入组患者知情同意并通过笔者医院医学伦理学委员会审核。
2.RNA提取及定量PCR分析:采用GenEluteTM总RNA提取试剂盒(美国Sigma公司)提取组织总RNA,QuantiTect反转录试剂盒(美国Qiagen公司)合成cDNA。ADAM12定量PCR引物序列如下:上游引物: 5′- CGAGGGGTGAGCTTATGGAAC-3′;下游引物: 5′- GCTTTCCCGTTGTAGTCGAAT A-3′。将引物与SYBR Green预混Mix(美国Bio-Rad公司)混合,加入模板后进行扩增。选择β-actin基因作为内参,引物序列如下:上游引物: 5′-TGACGTGGACAT-CCGCAAAG -3′;下游引物: 5′-CTGGAAGGTGGACATCCGCAAAG -3′,在Thermo的7500型定量PCR仪进行扩增,结果采用2-ΔCT方法进行比较,每个样品重复3个复孔。
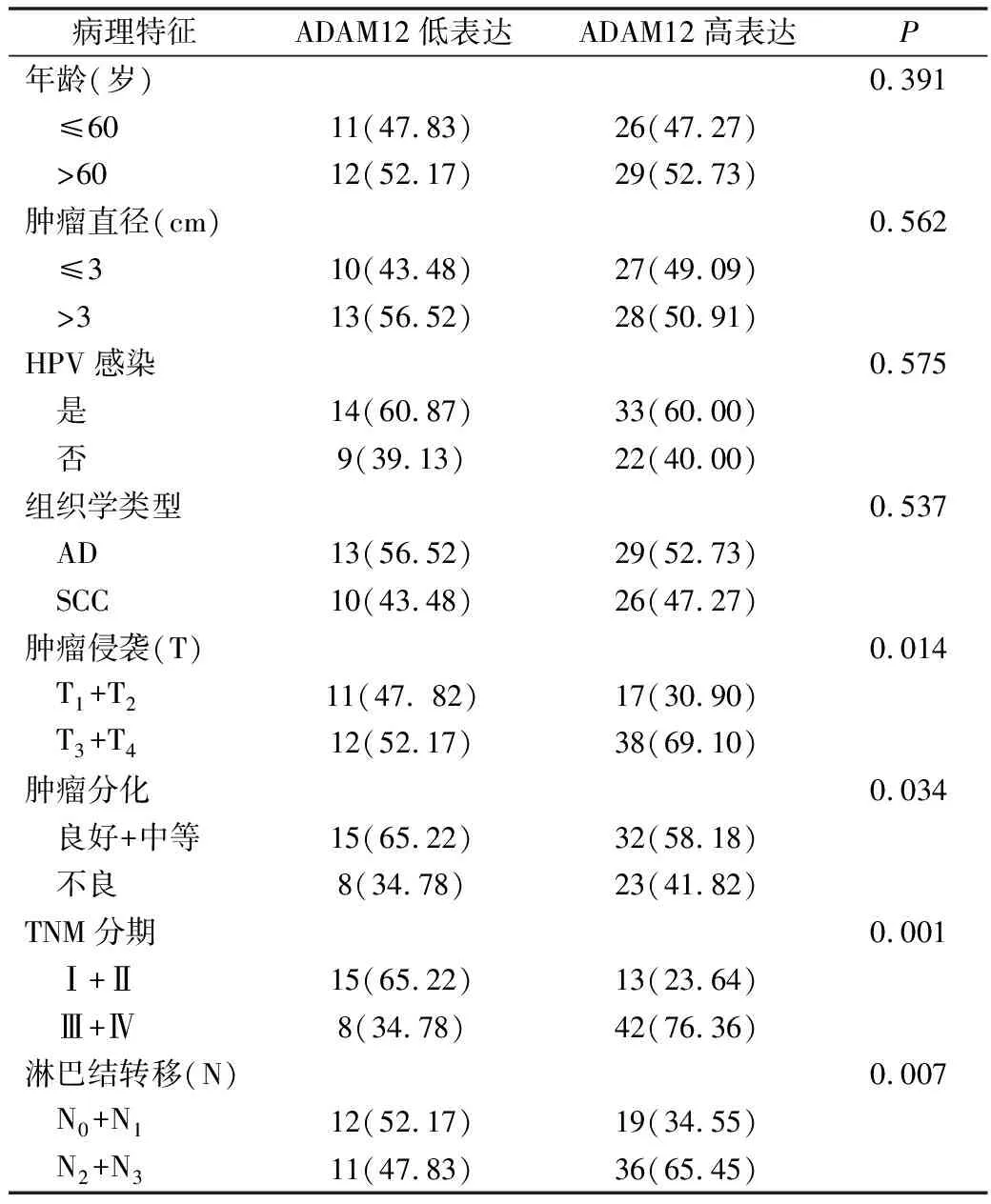
表1 ADAM12表达与子宫颈癌患者临床病理学特征关系分析[n(%)]
3.酶联免疫吸附测定尿液ADAM12含量:参照人ADAM12 ELISA定量检测试剂盒(美国R&D公司)操作步骤检测尿液样品中ADAM12含量,简要如下:向包被人特异性ADAM12单克隆抗体的酶标板中100μl ADAM12标准品及待检尿液,室温孵育2h,每孔加入300μl PBST,反复洗涤3次,最后1次拍板清除残留洗涤液,加入200μl 稀释好的HRP标记的ADAM12特异性抗体,再次室温孵育40min,每孔加入300μl PBST,反复洗涤3次,加入100μl底物,避光反应15min,最后加入50μl 2mol/L H2SO4终止反应。采用酶标仪(美国Bio-Rad公司)测定吸光度值A450,根据标准品标定的标准曲线计算待检样品的ADAM12含量。根据健康人群尿液ADAM12含量(平均值+3倍SD值)作为尿液ADAM12是过表达的临界值。
4.Western blot法检测子宫颈癌组织及癌旁组织ADAM12表达:采用组织总蛋白提取试剂盒(美国Sigma-Aldrich公司)提取子宫颈癌组织和癌旁组织总蛋白,参考文献[23]报道的方法进行Western blot法检测。制备10% SDS-PAGE凝胶后,将收集的样品上样,跑胶后转膜,将膜放入10%脱脂奶中37℃封闭2h,加入一抗4℃孵育过夜。次日,采用TBST溶液洗涤4次,每次10min,然后将膜放入含HRP标记二抗的TBST溶液中,室温孵育1h。之后加入发光液进行曝光。Western blot法检测用的抗体为ADAM12单克隆抗体(美国Sigma-Aldrich公司),采用β-actin蛋白作为内参,β-actin一抗购自美国Sigma公司。
5.免疫组织化学检测子宫颈癌组织及癌旁组织ADAM12表达:制备组织石蜡切片,首先进行抗原修复,采用0.01mol/L pH6.0的柠檬酸盐缓冲液对切片进行。随后将切片放入稀释后的鼠抗人ADAM12单克隆抗体(美国Sigma公司)中4℃孵育过夜,PBST洗涤3次,辣根过氧化物酶标记的二抗室温孵育40min,再次洗涤3次后加入DAB溶液进行显色后,白光拍照。参考文献[23]报道方法根据染色强度进行切片打分,切片评分是由两位对患者临床病理特征不了解的病理学专家独立完成。具体标准如下:0分(阴性),1分(弱阳性),2分(中等),3分(强阳性)。将阳性细胞比例分成5个区间,0分(0%),1分(1%~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)。切片的最终得分是上述两个分数相乘,总分在0~12分。为了评价ADAM12与子宫颈癌患者临床病理学特征之间的相关性将ADAM12表达分成两类:低表达(得分0~4分),高表达(得分5~12分)。
结 果
1.ADAM12在子宫颈癌患者肿瘤组织中表达增加:采用定量PCR法检测78例子宫颈癌患者肿瘤组织及癌旁组织中ADAM12 mRNA表达水平,结果表明,78例子宫颈癌组织中ADAM12相对表达水平为3.46±0.64,显著高于癌旁组织(0.64±0.17,P=0.025,图1A)。Western blot法检测结果显示,子宫颈癌组织中ADAM12表达显著高于癌旁组织(图1B)。

图1 78对子宫颈癌组织及癌旁组织ADAM12表达水平检测结果A.定量PCR法检测ADAM12 mRNA表达水平;B. Western blot法检测ADAM12蛋白表达水平
采用免疫组织化学染色检测了78对子宫颈癌组织及癌旁组织样品中ADAM12蛋白表达水平,在肿瘤组织和癌旁组织中均观察到不同强度的蛋白表达(图2),然而与癌旁组织比较,子宫颈癌组织中ADAM12蛋白表达量更高。根据评分标准,78例宫颈癌样品中55例(70.51%)为ADAM12高表达,而在癌旁组织中21例(26.92%)为ADAM12高表达(表2)。

图2 子宫颈癌及癌旁组织免疫组织化学染色A.子宫颈癌组织(强阳性);B. 子宫颈癌组织(中等);C.子宫颈癌组织(弱阳性);D.癌旁组织(弱阳性);标尺:100μm

表2 78对子宫颈癌及癌旁组织中ADAM12表达水平比较
2.ADAM12在子宫颈癌患者尿液中表达增加:采用ELISA方法检测78例子宫颈癌患者尿液及80例健康人群尿液中分泌型ADAM12表达水平,结果表明子宫颈癌组ADAM12平均表达量为2.15±0.68ng/ml,健康人群尿液中ADAM12含量为0.84±0.35ng/ml,两组比较,差异有统计学意义(P=0.033,图3)。子宫颈癌组尿液ADAM12含量超平均水平(阳性)样品27例(34.63%),阴性样品51例(65.38%)。

图3 子宫颈癌患者及健康人群尿液分泌型ADAM12含量
3.子宫颈癌组织ADAM12表达与患者临床特征分析:ADAM12表达与子宫颈癌患者临床病理学特征分析结果提示ADAM12表达升高与患者肿瘤侵袭(P=0.014)、TNM分期(P=0.010)、淋巴结转移(P=0.070)以及肿瘤分化(P=0.034)等因素密切相关(表1)。
4.子宫颈组织ADAM12表达与患者预后分析:生存分析结果表明,ADAM12高表达患者临床预后不良,ADAM12高表达患者临床中位生存期为29.5个月,低表达患者临床中位生存期为49.4个月,差异有统计学意义(P=0.003,图4)。单因素分析结果表明,肿瘤侵袭(HR=3.633, 95% CI: 1.715~8.526,P=0.017)、淋巴结转移(HR=4.731, 95% CI: 2.636~10.427,P=0.006)、TNM分期(HR=3.041, 95% CI: 1.557~7.062,P=0.027)、组织ADAM12表达(HR=6.466, 95% CI: 3.452~13.690,P=0.004)是影响子宫颈癌患者疾病预后的危险因素(表3)。多因素分析结果表明,子宫颈癌患者淋巴结转移(HR=3.646, 95% CI: 1.683~5.482,P=0.016)及组织ADAM12表达(HR=4.245, 95% CI: 2.614~6.735,P=0.007)是患者预后不良标志物(表3),而患者年龄、肿瘤直径、HPV感染、肿瘤组织学类型、肿瘤侵袭、肿瘤分化、TNM分期不是影响患者疾病预后的危险因素。

图4 ADAM12表达与子宫颈癌患者总生存期预后的Kaplan-Meier分析

表3 子宫颈癌患者总生存期单一和多重变量分析
讨 论
ADAMs家族蛋白具有十分特别的胞外区结构域,例如前导肽序列、金属蛋白酶结构域、表皮生长因子样重复结构域、解聚素结构域、富含半胱氨酸结构域等[24,25]。ADAMs家族蛋白的不同结构域发挥不同的生物学功能参与机体多种生物学途径,其中ADAMs的蛋白酶活性及细胞因子和趋化因子的膜锚定分子的功能在肿瘤的发生过程中发挥重要作用。大量文献研究证实,ADAM12表达水平升高与多种肿瘤的发生密切相关。与正常小鼠比较,乳腺癌及前列腺癌小鼠模型ADAM12-/-小鼠的肿瘤生长和迁移均显著降低[17, 23]。提示ADAM12是肿瘤发生中必须的。临床研究证实,ADAM12可以作为肿瘤诊断和预后的标志物[25]。例如,Western blot法检测分析结果显示,与健康人群比较,乳腺癌患者ADAM12肿瘤组织中表达显著升高。除检测乳腺癌组织中表达外,患者尿液中ADAM12水平与肿瘤分期及疾病进展密切相关。
本研究显示,子宫颈癌患者肿瘤组织中ADAM12表达水平均显著高于癌旁组织,子宫颈癌患者尿液中ADAM12表达水平显著高于健康人群。Kaplan-Meier生存分析结果表明ADAM12高表达患者临床预后不良,ADAM12高表达患者临床中位生存期显著低于低表达患者(P=0.003)。单因素分析结果表明,肿瘤侵袭(HR=3.633, 95% CI: 1.715~8.526,P=0.017)、淋巴结转移(HR=4.731, 95% CI: 2.636~10.427,P=0.006)、TNM分期(HR=3.041, 95% CI: 1.557~7.062,P=0.027)、组织ADAM12表达(HR=6.466, 95% CI: 3.452~13.690,P=0.004)是影响子宫颈癌患者疾病预后的危险因素。多因素分析结果表明,子宫颈癌患者淋巴结转移(HR=3.646, 95% CI: 1.683~5.482,P=0.016)及组织ADAM12表达(HR=4.245, 95% CI: 2.614~6.735,P=0.007)是患者预后不良标志物。此外,本研究显示,子宫颈癌患者尿液中ADAM12含量显著高于健康人群,然而统计单因素分析结果表明,尿液ADAM12水平不是子宫颈癌患者总生存期预后的独立因素。
综上所述,本研究结果证实ADAM12参与子宫颈癌的发生和发展,其在子宫颈癌组织中表达普遍上调。ADAM12表达是宫颈癌患者总生存期预后不良的重要因素,组织ADAM12表达可以作为子宫颈癌患者疾病预后独立标志物。

