探讨活化蛋白C对大鼠心肌缺血再灌注损伤的保护作用及机制的影响
童晓红,查锦芬,丁家望,李 松,李稳慧,吴 辉,陈 勇
(1.宜昌市中心人民医院心内科,湖北 宜昌 443003; 2.宜昌市第一人民医院妇产科,湖北 宜昌 443003)
缺血再灌注损伤(ischemia reperfusion,I/R)一直是心肌缺血治疗难以解决的问题,迄今为止,临床用来治疗心肌缺血再灌注损伤的药物仍存在一定的局限性[1]。心肌缺血再灌注损伤(MIRI)指冠状动脉部分、完全急性阻塞后再通时,缺血心肌虽可恢复正常灌注,但其组织损伤反而加重[1-2]。缺血期患者心肌超微结构、心功能等出现损伤,可诱发心律失常、心肌细胞坏死、心肌组织损伤、心肌收缩功能的减退等,并且再灌注时产生的氧自由基会进一步加重心肌损伤,甚至可发生严重的心律失常而导致猝死。虽然缺血预处理被证实是减轻I/R损伤的有效方法之一,但多种原因导致其临床应用受限[2]。近年药物预处理成为I/R损伤研究的热点。蛋白C系统为机体重要的抗凝系统,由活化蛋白C抑制物(APCI)、血浆蛋白C(PC)、蛋白S(PS)和血栓调节素(TM)组成,其中PC是该系统发挥抗凝效应的重要部分。活化蛋白C(APC)是一种天然的抗凝剂,APC可选择性灭活FⅤa、FⅧa 及纤溶酶原激活物抑制物(PAI),从而发挥强大的抗凝和促纤溶作用。APC作为心肌细胞磷脂酰肌醇信号转导系统的重要组成部分,参与了心肌缺血再灌注损伤,心肌缺血再灌注时PKC活性显著增强除了抗凝作用外,它还能通过抑制炎性因子的转录与表达,达到抗炎作用,还能通过抑制细胞的凋亡过程有效的预防心肌缺血再灌注损伤[3-5]。本实验探讨APC对心肌缺血再灌注损伤的影响
1 材料和方法
1.1 实验动物
纳入30只体重为220~250 g的SPF级雄性SD大鼠,8周龄;购自三峡大学实验动物中心[SCXK(鄂)2011-0012],所有实验操作均在三峡大学第一临床医学院实验室[SYXK(鄂)2011-0061]进行,在温度(22±2)℃,湿度(60±10)%和光照(12 h光照和12 h黑暗循环)条件下,将所有实验大鼠喂养在无特定病原体的动物房中。每个笼子最多容纳5只大鼠,每4~6天更换1次。同时经过我院委员会的批准,并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
MPO试剂盒购买自上海远慕生物科技有限公司(货号:ym-sx1873);TNF-α试剂盒购买自上海生物科技有限公司(货号:f00473);ICAM-1试剂盒购买自上海雅吉生物科技有限公司(货号:iM-05687b);APC购买自上海春麦生物科技有限公司(货号:enz-349)。
1.3 实验方法
1.3.1 动物分组及模型的制作
30只SD大鼠随机分为APC组、缺血再灌注(I/R)组和假手术(Sham)组,各10只。APC组:将APC 100 Ug/kg 溶于1 mL生理盐水中,再灌注前5 min通过颈外静脉注射。I/R组和假手术组注射等体积生理盐水。
按文献[6]复制模型,腹腔注射3%戊巴比妥钠(剂量为30 mg/kg)麻醉大鼠,切开气管,插管连接微型动物呼吸机。参数:潮气量20 mL/kg,呼吸频率每分钟50次,呼吸时比为1∶1。用大头针将四肢皮下穿刺,然后连接心电图机记录一段,对照为正常心电图。开胸、暴露心脏。APC组和I/R组用5/0缝线在左冠状动脉前降支根部穿线,在前降支上垫一塑料管一同结扎,缺血60 min后,剪断结扎线再灌注6 h。假手术组仅在左前降支下穿线不结扎。手术完成,每组随机选取5只大鼠进行心肌梗死面积的检测,其余大鼠用于病理切片检测相关指标。
1.3.2 标本的收集
再灌注6 h末,经下腔静脉采血3 mL,常温下静置20 min,以3000 r/min离心10 min,提取血清,置于-20℃冰箱保存;将心脏迅速剪下,并且用生理盐水进行冲洗,将靠近心尖部分的心肌组织放在10%福尔马林中进行固定24 h,采用常规石蜡进行包埋。另一块快速放入液氮中进行速冻,-80℃保存[7]。
1.3.3 指标检测
心肌组织石蜡切片,常规二甲苯脱蜡。切片经脱蜡后,参照ICAM-1试剂盒说明书用SP法进行免疫组化染色,光镜下每张切片随机选择5个高倍视野进行半定量分析[8]。用酶联免疫吸附试验(ELISA)测定血清TNF-α的浓度,采用硫代巴比妥酸比色法测定心肌组织MPO的水平;HE染色观察各组心肌组织病理学改变。
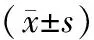
表1 各组大鼠心肌梗死面积的比较
注:与假手术组比较,*P<0.05;与I/R组比较,△P<0.01。
Note. Compared with the sham operation group,*P<0.05. Compared with the I/R group,△P<0.01.
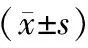
表2 各组血清TNF-α水平及心肌组织MPO含量的比较
注:与假手术组比较,*P<0.01; 与I/R组比较,△P<0.01。
Note. Compared with the sham operation group,*P<0.05. Compared with the I/R group,△P<0.01.
1.4 统计学方法

2 结果
2.1 心肌梗死面积比较
与假手术组比较,I/R组和APC组大鼠心肌梗死面积明显增加(P<0.01),而APC组大鼠心肌梗死面积较I/R组明显减少(P<0.05)(见表1)。
2.2 血清TNF-α水平和心肌组织MPO水平的测定
与假手术组比较,I/R组和APC组血清TNF-α的水平明显升高(P<0.01),而APC组TNF-α的水平较I/R组明显降低(P<0.01)。在I/R组和APC组心肌组织MPO的水平与假手术组比较明显升高(P<0.01);与I/R组比较,APC组心肌组织MPO水平明显降低(P<0.05)(见表2)。
2.3 心肌组织ICAM-1免疫组化染色
与假手术组比较,I/R组和APC组ICAM-1的表达水平明显升高(P<0.05)与I/R组比较,APC组心肌组织ICAM-1的表达明显减少(P<0.05),(见图1A、1B)。
2.5 HE染色观察各组心肌组织病理学变化
再灌注6 h后,假手术组未见炎性细胞浸润,心肌细胞包膜完整;与I/R组比较,APC组心肌组织炎性细胞浸润明显减少(见图2)。
3 讨论
心肌缺血再灌注能够触发急性炎症反应所具备条件,包括补体激活,心肌内化学因子和细胞因子产生,细胞外基质降解和细胞死亡,活性氧生成和微血管通透性增强[9]。近年来有关心肌缺血再灌注损伤等血栓性疾病与活化蛋白C密切相关。活化蛋白C是人体重要抗凝因子,其缺乏可导致血栓性疾病;凝血酶和血栓调节蛋白相互结合时可以激活APC,从而达到抗凝效果。血浆PC系统主要包括血浆蛋白C、PS、APCI和TM等,当凝血酶与TM结合形成复合物时可激活PC,灭活FⅤa/FⅧa,达到抗凝及促纤溶目的。PS为辅因子可加强PC活性,APCI可降低PC活性。研究表明,心肌缺血再通后血小板聚集率明显增高。患者若出现心肌缺血,血浆中 TM含量大幅度上升,与凝血酶形成复合物,消耗血浆APC,同时活化的血小板释放大量 APC抑制血浆APC活性。冠状动脉再灌注后血流急剧增加,血液呈高凝状态,抗凝系统活化,进而激活APC,血浆FPS代偿增多以抵抗高凝状态。

注:与假手术组比较,*P<0.05; 与I/R组比较,#P<0.01。图1 心肌组织ICAM-1免疫组化染色Note. Compared with the sham group,*P<0.05. Compared with the I/R group,#P<0.01.Figure 1 Myocardial tissue ICAM-1 immunohistochemical staining

图2 心肌组织HE染色Figure 2 HE staining of myocardial tissue
APC是存在于血浆中的维生素K依赖性的胰岛素样丝氨酸蛋白酶,生理情况下是血液中的主要抗凝成分,同时近年来的研究显示其具有抗炎、抗凋亡及保护内皮屏障的功能。它的细胞保护效应可以中和细胞损伤,使细胞得以存活并且其效应的发挥依细胞和损伤类型的不同而不同,主要表现为抗炎、抗凋亡、改变基因表达谱和稳定内皮细胞屏障的功能。炎症是机体的防御性反应,主要表现为血流速度加快、血管通透性增加。中性粒细胞在化学趋化因子的作用下渗出血管外在受损组织大量集聚浸润同时释放大量炎性因子如 TNF-α,IL-1β,IL-6,NO,诱导 TNF 的表达导致了大量的凝血酶的产生,这些反应修复现存的组织损伤同时造成进一步的损伤:使凝血和抗凝血平衡紊乱从而促进血栓形成和炎症反应。机体可释放 IL-4、IL-10 产生进一步代偿炎症反应。在人体内,活化蛋白 C 可以减少白细胞与选择素的连接从而抑制中性粒细胞在体内的活化和白细胞产物的定位;抑制核因子 NF-кB 的核转移从而减少单核细胞炎性因子如 TNF-α的释放;通过内皮蛋白 C 受体(EPCR)减少白细胞释放的促炎细胞因子;通过抑制凝血酶的生成和功能的发挥从而间接抑制其促炎效应;促进纤维蛋白溶解,防止血栓形成,减轻炎症反应。活化蛋白 C与内皮蛋白 C 受体结合,激活蛋白激酶活化受体-1(PAR-1),从而激活上皮-间质细胞转化因子(SIP-1)转录,活化内皮生长因子-1,减少 TNF-α诱导的细胞凋亡。活化蛋白 C 可抑制凋亡基因表达,促进细胞的增殖。研究表明其亦可以通过蛋白激酶活化受体复合物阻碍细胞凋亡诱导因子-1 转录,增加抗凋亡基因 Bcl-2 、凋亡蛋白抑制物的表达,抑制 Caspase-3、Caspase-9、P21 及 P53 等诱导的细胞凋亡。研究表明其亦可以通过蛋白激酶活化受体复合物阻碍细胞凋亡诱导因子-1 转录,从而诱导细胞凋亡。本研究发现再灌注6 h心肌组织中有明显的炎性反应,而与对照组比较,APC组的心肌损伤、炎性细胞浸润有所减轻。相关表明APC能够改善大鼠肾脏缺血再灌注损伤肾血流量,减少白细胞在肾组织的浸润、迁移,降低维持肾小球通过性的稳定和在受损肾组织内纤维素沉积[10-11]。相关研究表明APC能够通过下调血浆髓过氧化物酶、IL-8、TNF-α水平,来改善受损骨骼肌的电生理作用[12-13]。TNF-α是一种重要的炎性因子,它能刺激血管内皮细胞表达黏附分子,并促进产生中性粒细胞趋化因子[14-15]。本次研究我们发现APC能明显降低再灌注血清TNF-α的水平,同时减少心肌组织中MPO的含量,降低了ICAM-1的表达水平,减少了炎性细胞与血管内皮的接触机会,在心肌缺血再灌注中具有抗炎作用。
在凝血酶-血栓调节蛋白复合物的作用下蛋白C所形成的APC具有抗凝、抗炎、粗纤溶以及抗凋亡和保护内皮的功能。它通过调节炎性因子的产生,降低血管内皮细胞ICAM-1的表达来减轻炎性损伤。目前APC已被广泛用于脓毒症的治疗,降低了全身炎性反应的病死率[16]同样本次研究也证实了APC通过抑制缺血再灌注的炎性反应明显改善了再灌注后的心肌损伤。同时为心肌缺血再灌注损伤临床干预提供新的途径。

