雌性大鼠生育力与早期胚胎发育毒性阳性模型建立及比较
王 蓉,王 永,骆永伟,许 丽,周 莉,孙祖越
(上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理学检测中心,国家人口和计划生育委员会计划生育药具重点实验室,复旦大学生殖与发育研究院,上海 200032)
2012年,参考人用药品国际协调组织及美国食品药品监督管理总局等指南[1-4],原国家食品药品监督管理总局药品审评中心颁布了我国的《药物生殖毒性研究技术指导原则》。依据该指导原则,I段生殖毒性试验由交配前到交配期直至胚胎着床给药,而Ⅱ段生殖毒性试验自胚胎着床至硬腭旨闭合给药,主要目的在于评价受试物对生殖细胞、受孕和妊娠等亲代生殖机能是否产生不良影响,是新药非临床安全性评价中判定外源性因素生殖毒性的标准方法[1-5]。
考虑到生殖毒性实验主要有以下几个特点:1、SD大鼠交配、接受受试物时间以及分娩时间不同步;2、毒性表现的形式具有蓄积性、迁延性、滞后性和整体性;3、检测指标及其统计处理呈现多样性和复杂性;4、窝效应和窝大小不均一等。因此,数据采集、处理、解释和分析具有一定的复杂性和难点。而阳性对照的设立可以屏蔽干扰因素,平衡非实验因素对于实验结果的影响,以利于充分观察毒性效应。为了对每一次实验都能做到认真和谨慎,我们认为建立一个良好的阳性模型对大量实验数据的分析以及对实验结果的解释才会充分、真实和可信,是保证实验顺利进行的重要环节[6-7]。
环磷酰胺对动物胎仔的致畸性已得到广泛接受,常被设定为Ⅱ段生殖毒性实验的阳性对照受试物。同时,可作为Ⅱ段生殖毒性实验阳性对照的还有敌枯双、阿斯匹林、维生素A和反应停等,本研究室也对此进行了系统研究[8],而鲜有人进行I段生殖毒性实验阳性对照物敏感性高低的对比研究。现有的文献报道显示,CTX的I段生殖毒性研究集中于其对雄性大鼠精子及睾丸生精细胞等毒性[9],少见对雌性动物毒性的报道。因此,本研究在GLP实验室条件下,比较雌性SD大鼠于交配前给予不同剂量和频次的CTX后生殖和发育指标的变化,发现生育力与早期胚胎发育毒性实验(Ⅰ段)标准化阳性对照模型的建立方案。
1 材料和方法
1.1 实验动物
SPF级SD大鼠150只,雌雄各半,雌鼠体重170~190 g,6~8周龄;雄鼠体重380~400 g,12~14周龄(均为接收时体重),由上海西普尔-必凯实验动物有限公司提供 [SCXK(沪)2018-0006],合格证序号0034062。动物饲养于上海市计划生育科学研究所(中国生育调节药物毒理检测中心)SPF级动物房内[SYXK(沪)2018-0017],室温20℃~26℃,湿度40%~70%,12 h/12 h光照/黑暗,换气每小时12次,全新风,自由饮水摄食。本试验所涉及的动物管理、使用和相关操作均经过中国生育调节药物毒理检测中心实验动物管理和使用委员会(IACUC)批准并严格遵循实验动物使用的3R原则给予人道主义关怀,批准号为(IACUC-20150315-01)。
1.2 主要试剂与仪器
BH-2生物显微镜,Olympus公司;PL1501-S电子天平,梅特勒-托利多公司;Zenith 200st酶标仪,Anthos公司。
1.3 实验方法
1.3.1 实验分组及处理
SD大鼠根据体重随机分为3组,分别为溶媒对照组、CTX 20 mg/kg和CTX 100 mg/kg组,每组50只,雌雄各半。
溶媒对照组雌性大鼠交配前连续腹腔注射给予生理盐水14 d至GD7停药;CTX 100 mg/kg组雌性大鼠于交配前14 d一次性腹腔注射给予100 mg/kg的CTX;CTX 20 mg/kg组雌性大鼠于交配前14 d腹腔注射给予20 mg/kg的CTX,每日1次连续5 d。给药体积均为10 mL/kg。
1.3.2 体重和摄食量测定
每天观察1~2次SD大鼠外观体征、行为活动及死亡等情况,发现死亡或濒死动物,及时剖检。每周测定2次体重,每周测定1次摄食量(交配期除外)。
1.3.3 性周期和激素测检测
式中:Pploss为场景k下的有功损耗;Ri为支路i的电阻;λ为惩罚因子;Pi、Qi分别为支路i的有功、无功功率;Vlim取值满足当Vi
各组雌性大鼠按1∶1比例与正常雄性大鼠合笼交配,连续交配2周,每天上午8∶00~9∶30进行阴道涂片检查,查到精子或阴栓时定为GD0,观察其性周期(动情间期、动情前期、动情期和动情后期[10])及是否含有精子,计算SD大鼠交配成功的平均合笼时间和交配率;妊娠SD大鼠于GD14处死,2周内仍未交配成功的雌性大鼠于交配结束后24 h处死,处死前采集外周血约2 mL,分离血清,ELISA法测定睾酮(testosterone, T)、雌二醇(estradiol, E2)、卵泡刺激素(follicule-stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)和孕酮(progesterone, P)含量。
1.3.4 妊娠终末检查
孕鼠于GD14处死后记录黄体数、着床数、子宫连胎重、活胎数、死胎数、吸收胎数,检查卵巢、子宫以及胎盘、胎鼠外观,肉眼观察有异常时进行组织病理学检查。计算交配率、妊娠率、着床前丢失率(1-着床数/黄体数)、着床后丢失率(1-活胎数/黄体数)、平均着床率、活胎率、死胎率和吸收胎率。2周内未交配成功雌鼠,除不检查胎鼠、胎盘外,其它解剖后处理方法同交配成功雌鼠。
1.4 统计学方法
2 结果
2.1 一般状况及体重
给药后第5天开始,环磷酰胺组部分雌性SD大鼠均出现眼角、鼻周分泌物增多现象,至给药后第7天,全部SD大鼠出现该异常,均持续3 d左右基本恢复,CTX 100 mg/kg组2只大鼠伴嘴角溃烂现象,给药后第10天时其中1只死亡,另一只于给药后3周基本恢复。溶媒对照组雌性SD大鼠外观体征、行为活动均未见明显异常,未出现SD大鼠死亡。
溶媒对照组和CTX 20 mg/kg动物交配前体重均呈逐渐升高趋势,20 mg/kg组呈升-降-升趋势,其中第8天和第11天时与溶媒对照组相比降低(P<0.01和P<0.05),详见表1。
如表2所示,妊娠期间,溶媒对照组、CTX 20 mg/kg和100 mg/kg组增重均呈U型变化趋势,提示环磷酰胺造成的体重降低可恢复;GD0~GD3至GD10~GD14时,CTX 20 mg/kg和100 mg/kg组与溶媒对照组相比无明显差异(P>0.05)。
2.2 摄食量
交配前第1周,CTX 20 mg/kg和100 mg/kg组雌性SD大鼠摄食量均明显低于溶媒对照组(P<0.01);妊娠期第2周,CTX 20 mg/kg组摄食量与溶媒对照组相比降低(P<0.01),详见表3。
2.3 性周期
交配期间,溶媒对照组、CTX 20 mg/kg和100 mg/kg组交配成功及未交配成功雌性SD大鼠均未见明显性周期异常。上述各组交配成功的平均合笼时间分别为3.83、3.09和3.00 d,与溶媒对照组相比均未见明显统计学差异。
2.4 激素水平
如表4所示,与溶媒对照组相比,仅CTX 20 mg/kg组T显著降低(P<0.01),其它指标均无统计学差异,提示20 mg/kg的CTX给药方案可能会影响孕鼠卵泡内膜细胞和肾上腺皮质网状带细胞睾酮的产生。
2.5 妊娠结局
如表5所示,与溶媒对照组相比,仅CTX 100 mg/kg组着床后丢失率明显升高(P<0.01),与CTX处理组妊娠率、着床前丢失率、着床率、平均黄体数和平均着床数均无统计学差异,提示CTX 100 mg/kg的给药方案仅影响妊娠母鼠着床后参数,不会影响着床前相关参数。
CTX 20 mg/kg组子宫连胎重和CTX 100 mg/kg组的平均活胎数、活胎率、吸收胎率与溶媒对照组相比有统计学差异(P<0.05或P<0.01),表明CTX 两种给药方案均可导致母体黄体功能不足进而无法维持妊娠后子宫内膜的正常生理作用,引起着床后相关指标的异常。
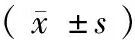
表1 环磷酰胺对交配前SD雌鼠体重的影响
注:与溶媒对照组相比,*P<0.05,**P<0.01。aCTX 100 mg/kg D11时n=24。
Note. Compared with the control group,*P< 0.05,**P< 0.01.aCTX 100 mg/kg group withn=24 (D11).
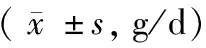
表2 环磷酰胺对SD孕鼠体重的影响

表3 环磷酰胺对SD雌鼠摄食量的影响
注:与溶媒对照组相比,**P<0.01。
Note. Compared with the control group,**P< 0.01.

表4 环磷酰胺对SD孕鼠激素的影响
注:与溶媒对照组相比,**P<0.01。
Note. Compared with the control group,**P< 0.01.

表5 环磷酰胺对SD雌鼠妊娠结局的影响
注:与溶媒对照组相比,*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P< 0.01.
3 讨论
CTX作为一种常见的烷化剂类免疫抑制剂,可以引发SD大鼠体重下降、摄食减低、骨髓抑制、感染甚至死亡等诸多全身毒性症状,但除死亡外其他症状停药一定时间后均具有可恢复性[11]。本研究表明,雌性大鼠以2种不同的给药方案(CTX 100 mg/kg,腹腔注射给药1次和20 mg/kg,腹腔注射给药5次)给予CTX后,体重和摄食降低;并出现明显的眼角、鼻周分泌物增多,偶见皮肤溃烂和死亡,考虑与CTX所致的全身毒性及其恢复性相关。
CTX 20 mg/kg组睾酮显著低于溶媒对照组,孕酮高于溶媒对照组。据Jarrell等报道[12],CTX对卵巢具有潜在的毒性作用,对大鼠的急性影响表现为血清雌二醇和孕酮水平降低。结合本研究中SD大鼠激素的变化,认为该给药方案可轻度影响雌性大鼠卵巢分泌功能,与文献报道具有较好一致性。
CTX 20 mg/kg和100 mg/kg组总黄体数、平均黄体数、总着床数和平均着床数虽与溶媒对照组相比无统计学差异,但均呈减少趋势。据朱长林等报道[13],CTX可使早期胚胎细胞数减少并可影响早期胚胎发育的毒性阈值,但若达到一定阈值,则导致桑椹胚无法生存,呈蜕变状。因此,本研究采用的两种给药方案均可抑制雌性大鼠卵巢排卵数目,进而减少其着床数,与文献报道具有一致性。另外,两种给药方案均可导致吸收胎率和着床后丢失率明显升高,活胎率和子宫连胎重明显降低,表明CTX两种给药方案均可严重影响早期胚胎发育,延缓其生长速度或直接导致其死亡。
综上,在GLP实验室条件下,SPF级雌性大鼠于交配前14 d按20 mg/kg和100 mg/kg分别腹腔注射给予CTX 5 d和1 d,每天1次,均可以成功地建立SD雌性大鼠生育力与早期胚胎发育毒性阳性模型。比较两种给药方案引发的雌性大鼠妊娠结局发现其中100 mg/kg 腹腔注射给予1次的给药方案可以导致更多的阳性指标变化(着床后丢失率明显升高,活胎率和子宫连胎重明显降低)和更明显的阳性特征,可以作为雌性大鼠生育力与早期胚胎发育毒性阳性模型的标准化构建方案。
目前,有文献报道CTX作为烷化剂诱导卵巢功能发生异常[14],少数实验室甚至对其进行了比较全面的雌性生殖功能评价研究[15],虽然彼此间所用的动物品系、给药途径、给药阶段、给药剂量甚至实验室条件有所不同,得到的阳性指标也不尽相同,但这些阳性结果和本研究得到的相关结果均表明了CTX对I段生殖毒性生殖和发育指标影响的可能。鉴于本研究中仍有一些诸如性周期、激素等指标没有得到很明显的阳性结果,因此CTX的给药途径、给药阶段和给药剂量等仍有进一步优化的可能,各实验室间特别是GLP实验室间的比对研究也显得尤为迫切,CTX成为公认的标准化阳性对照受试物,仍然需要进一步的探索研究。

