番茄褪绿病毒TaqMan荧光定量PCR快速检测方法的建立与应用
王吉成, 李 洁, 丁天波, 褚 栋
(青岛农业大学植物医学学院, 山东省植物病虫害综合防控重点实验室, 山东青岛 266109)
番茄褪绿病毒(tomato chlorosis virus, ToCV)是一种植物RNA病毒,属长线病毒科(Closteroviridae)毛形病毒属Crinivirus。1998年首次在美国佛罗里达州的番茄上发现了ToCV (Wisleretal., 1998)。ToCV寄主广泛,可侵染15属30多种植物,侵染植株后造成叶片脉间褪绿黄化,到后期整株黄化枯萎甚至死亡(Wintermantel and Wisler, 2006)。目前,ToCV在热带、亚热带和温带地区对作物均造成危害,已成为一种世界性作物病毒(Barbosaetal., 2008; Dart and Weeda, 2011; Fiallo-olivéetal., 2011)。在我国,2004年ToCV首次在台湾被报道(Tsaietal., 2004),2012年后相继在北京、江苏、山东等地发现,对当地农业生产造成了严重的经济损失(魏可可等, 2018)。
ToCV无法通过种子、汁液等方法进行传播,仅依靠介体烟粉虱Bemisiatabaci、温室白粉虱Trialeurodesvaporariorum、纹翅粉虱Trialeurodesabutilonea等粉虱进行传播(Navas-Castilloetal., 2000)。在我国,烟粉虱MED隐种是ToCV传播的主要媒介昆虫(刘永光等, 2014),与该病毒病的传播与暴发密切相关(代惠洁等, 2016)。传统的检测方式是采集田间已有症状植株进行检测,而ToCV初侵染植株4周内并无明显症状,检测到病毒时往往已延误防治(Fontetal., 2004)。烟粉虱作为ToCV天然的“储存器”与“注射器”(李洁等, 2015),通过烟粉虱进行携毒检测可及时发现田间的ToCV,这对该病毒的及时防控具有重要意义。
现有的病毒检测技术中,常用的方法有血清学检测法、RT-PCR法与逆转录环介导等温扩增法等,但这些方法也存在一些不足。例如,在微量模板上用血清学检测法常出现漏检或误检的情况(陶源和吴兴泉, 2017);常规PCR检测方法与逆转录环介导等温扩增(LAMP)法检测灵敏度较高(Karwithaetal., 2014),但也极易造成样品的交叉污染(Kiletal., 2015)。近年来,由于TaqMan探针实时荧光定量PCR方法(TaqMan RT-qPCR)特异性强、灵敏度高等特点(姚晶等, 2013),该方法在医药卫生、农业科学和生物学等领域得到了广泛应用。目前,还没有利用TaqMan RT-qPCR方法检测单头烟粉虱体内ToCV的报道。
本研究根据ToCV基因外壳蛋白保守区域设计特异引物与探针,建立了能快速检测ToCV的TaqMan RT-qPCR方法,并应用该方法对温室接种以及田间温室大棚内单头烟粉虱体内ToCV携毒情况进行了检测,以期为田间ToCV的防控提供技术支撑。
1 材料与方法
1.1 供试毒源与供试虫源
供试毒源包括ToCV侵染植株、番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV)侵染植株与和番茄斑萎病毒(tomato spotted wilt virus, TSWV)侵染植株。ToCV侵染番茄植株与TYLCV侵染番茄植株于2014年在山东省青岛市城阳区上马镇采集,利用介体烟粉虱对健康番茄植株进行接种,鉴定后在本实验室温室内长期培养。TSWV侵染番茄植株样品于2015年在云南采集,鉴定为TSWV之后于-80℃保存。供试虫源包括实验室温室内ToCV侵染番茄植株上长期饲养的烟粉虱种群和青岛市城阳区上马镇番茄温室大棚内疑似携毒烟粉虱种群。供试植株培养和烟粉虱饲养条件:温度27±1℃,相对湿度60%±5%,光周期16L∶8D。
1.2 TaqMan探针与特异引物设计
根据GenBank公布的ToCV序列(GenBank登录号: KC709510.1),选取ToCV外壳蛋白基因高度保守区域,使用软件Primer Express3.0设计1对特异引物和1条TaqMan探针,通过BLAST对比分析确定其特异性后交由生工生物工程(上海)股份有限公司合成,引物序列如表1所示。
1.3 ToCV标准质粒的构建
采用TRIzol提取法(TRIzol试剂购于Thermo Fisher Scientific公司)提取1.1节中ToCV侵染植株叶片总RNA,使用反转录试剂盒(Prime Script TaqMan RT Reagent Kit with gDNA Eraser, TaKaRa公司)进行反转录得到cDNA;以cDNA为模板,使用ToCV-F和ToCV-R引物(表1)进行常规PCR扩增,PCR反应体系: cDNA模板2.0 μL, rTaq 0.2 μL, 2.5 mmol/L dNTPs 2 μL, 10×Buffer 2.0 μL, 上下游引物ToCV-F/ToCV-R(10 mmol/L)各0.3 μL, ddH2O 补足20 μL。PCR反应条件: 95℃预变性4 min; 94℃变性40 s, 55℃退火40 s, 72℃延伸50 s, 35个循环; 72℃延伸10 min。

表1 本研究中所用引物信息Table 1 Information of primers used in this study
将上述PCR产物进行琼脂糖凝胶电泳检测,选择切下约680 bp处的目的条带,使用凝胶回收试剂盒(TaKaRa Mini BEST Agarose GEL DNA Extraction Kit, TaKaRa公司)进行目的条带的回收纯化,纯化后产物连接到pMDTM18-T Vector(TaKaRa公司),并转化进入大肠杆菌Escherichiacoli感受态细胞JM109(北京全式金生物技术有限公司)中,筛选并提取阳性克隆的质粒,送至上海生工生物有限公司进行测序。将测序正确的质粒使用核酸蛋白浓度测定仪测定浓度,置于-20℃保存备用。运用如下公式(Shirimaetal., 2017)计算该质粒含有的ToCV片段拷贝数:质粒拷贝数/μL=(阿氏常数×C×109)/(重组质粒碱基数×660 dalton/bp)。其中,C为质粒浓度;阿氏常数为6.02×1023。最终计算得到重组ToCV质粒浓度为8.3×1010copies/μL。
1.4 标准曲线的建立
以1.3节获得的ToCV阳性质粒为初始模板,按10倍梯度稀释出9个质粒标准品,浓度依次为8.3×109, 8.3×108, 8.3×107, 8.3×106, 8.3×105, 8.3×104, 8.3×103, 8.3×102和8.3×10 copies/μL。以上述9个梯度质粒标准品为模板,在实时荧光定量PCR仪(qTOWER 2.2 Real-time PCR Thermal Cycler, Analytik Jena, 德国耶拿公司)上进行TaqMan RT-qPCR扩增,得到动力学扩增曲线,然后以PCR扩增循环阈值(Ct值)为纵坐标、以质粒拷贝数的10为底的对数值为横坐标做出标准曲线,获得回归直线方程。TaqMan RT-qPCR反应体系: 模板2.0 μL, 2×Premix ExTaq (Probe qPCR) 10.0 μL, 上下游定量引物ToCV-F6680/ToCV-R6799(10 mmol/L)各0.4 μL, ToCV-probe6724(10 mmol/L) 0.8 μL, ddH2O 补足20 μL。 TaqMan RT-qPCR反应条件: 95℃ 30 s; 95℃ 5 s, 57℃ 30 s, 40个循环。
1.5 常规PCR的灵敏度检测
以1.4节中9个浓度梯度ToCV质粒标准品为模板,使用ToCV-F6680和ToCV-R6799引物进行常规PCR扩增,得到PCR产物后经电泳检测,通过与标准曲线定量结果的比较,分析TaqMan RT-qPCR与常规PCR的灵敏度,同时使用ToCV阳性模板与ddH2O分别作为阳性和阴性对照。PCR反应体系: 模板 2.0 μL, rTaq 0.2 μL, dNTPs(2.5 mmol/L)2 μL; 10×Buffer 2.0 μL, ToCV-F6680(10 mmol/L)0.4 μL, ToCV-R6799(10 mmol/L) 0.4 μL, ddH2O 补足20 μL。PCR反应条件: 95℃预变性4 min; 94℃变性40 s, 55℃退火40 s, 72℃延伸30 s, 35个循环; 72℃延伸10 min。
1.6 引物的特异性检测
选取ToCV cDNA及TYLCV和TSWV的DNA和cDNA为模板,用ToCV的TaqMan RT-qPCR特异引物(ToCV-F6680/ToCV-R6799)进行常规PCR扩增(方法同1.5节)与TaqMan RT-qPCR扩增(方法同1.4节),均设置ddH2O阴性对照,常规PCR产物进行电泳分析鉴定,TaqMan RT-qPCR结果根据其扩增曲线分析鉴定,基于二者结果共同分析引物特异性。其中,TYLCV病毒模板使用天根植物基因组提取试剂盒(天根生化科技有限公司,北京)提取获得,TSWV病毒模板与ToCV病毒提取方法相同,经反转录合成cDNA(方法同1.3节),模板使用前已经经过常规PCR扩增并测序,之后在NCBI上BLAST对比鉴定,TYLCV病毒 GenBank登录号为GU199587.1,TSWV病毒GenBank登录号为ANQ91902.1。
1.7 单头烟粉虱体内ToCV检测
从1.1节中温室内ToCV侵染植株上烟粉虱种群和田间烟粉虱种群中,分别随机选取50头烟粉虱成虫,单头置于1.5 mL无RNase离心管中,在液氮中使用研磨棒将烟粉虱研磨成粉,按照1/5体积TRIzol法提取其RNA,经反转录合成cDNA(方法同1.3节),用于TaqMan RT-qPCR扩增得到相应Ct值,根据1.4节建立的标准曲线计算单头烟粉虱体内的ToCV的病毒拷贝数。
2 结果
2.1 ToCV质粒模板的克隆
如图1所示,以ToCV cDNA为模板,以ToCV-F和ToCV-R为引物进行常规PCR扩增,得到680 bp左右扩增片段,经上海生工测序,NCBI核酸数据库比对,与已报道的ToCV序列(GenBank登录号: KC709510.1)一致性100%。
2.2 标准曲线建立
以8.3×101~9copies/μL浓度梯度的标准质粒ToCV-pMD18-T为模板进行PCR扩增,得到不同浓度标准质粒扩增曲线(图2),Ct值与拷贝对数所构建的标准曲线(图3)。结果表明,标准质粒浓度与Ct值呈线性关系,相关系数R2为0.9957,回归曲线斜率为-3.1232,截距为40.265,扩增效率为98%。标准曲线的线性回归方程为y=-3.1232x+40.265,其中y为Ct值,x为以10为底的标准质粒拷贝数的对数。
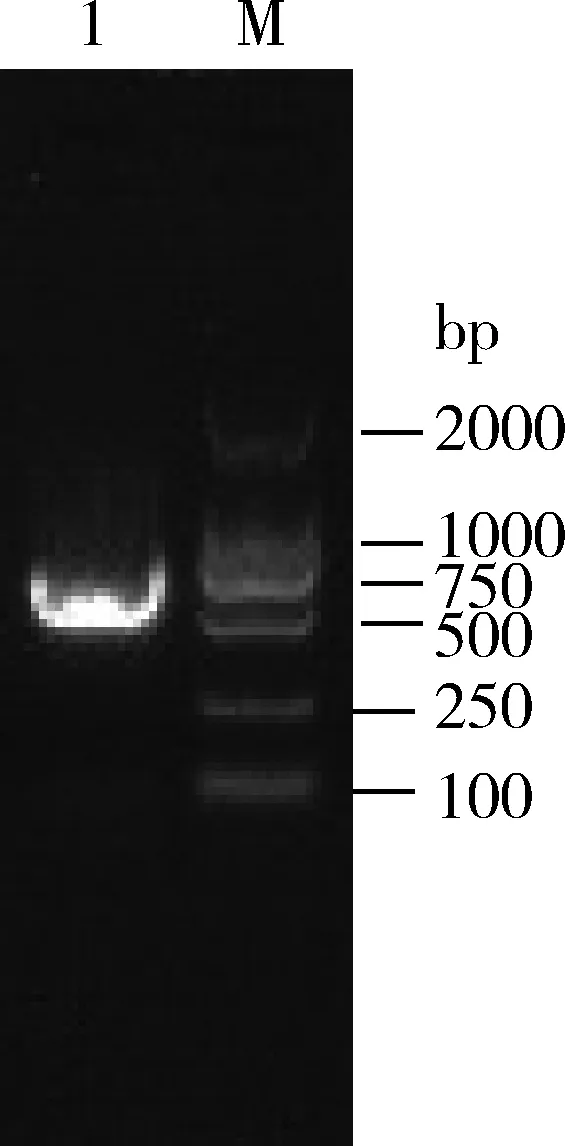
图1 ToCV常规PCR扩增Fig. 1 Conventional PCR of ToCVM: DNA分子量标准 DNA Marker (DL2000); 1: ToCV模板ToCV template.

图2 TaqMan RT-qPCR标准质粒ToCV-pMD18-T扩增曲线Fig. 2 Amplification curve of standard plasmid ToCV-pMD18-T by TaqMan RT-qPCRA-I: 分别为8.3×109, 8.3×108, 8.3×107, 8.3×106, 8.3×105, 8.3×104, 8.3×103, 8.3×102和8.3×10 copies/μL的ToCV-pMD18-T质粒标准品8.3×109, 8.3×108, 8.3×107, 8.3×106, 8.3×105, 8.3×104, 8.3×103, 8.3×102 and 8.3×10 copies/μL standard plasmid ToCV-pMD18-T, respectively.

图3 ToCV的TaqMan RT-qPCR标准曲线Fig. 3 Standard curve of TaqMan RT-qPCR for ToCVEff.: 扩增效率Amplification efficiency. 图中各点从左到右分别表示为8.3×101~9 copies/μL的ToCV-pMD18-T质粒标准品Each point from left to right in the figure is 8.3×101-9 copies/μL standard plasmid ToCV-pMD18-T, respectively.
2.3 常规PCR与TaqMan RT-qPCR的灵敏度比较
TaqMan RT-qPCR与常规PCR的灵敏度检测结果比对表明,基于TaqMan RT-qPCR的ToCV检测方法最低可检出8.3×10 copies/μL 的病毒质粒样品(图2),而常规PCR最低仅能检测到8.3×104copies/μL的病毒质粒样品(图4),TaqMan RT-qPCR检测ToCV的灵敏度是常规RT-PCR的1 000倍。
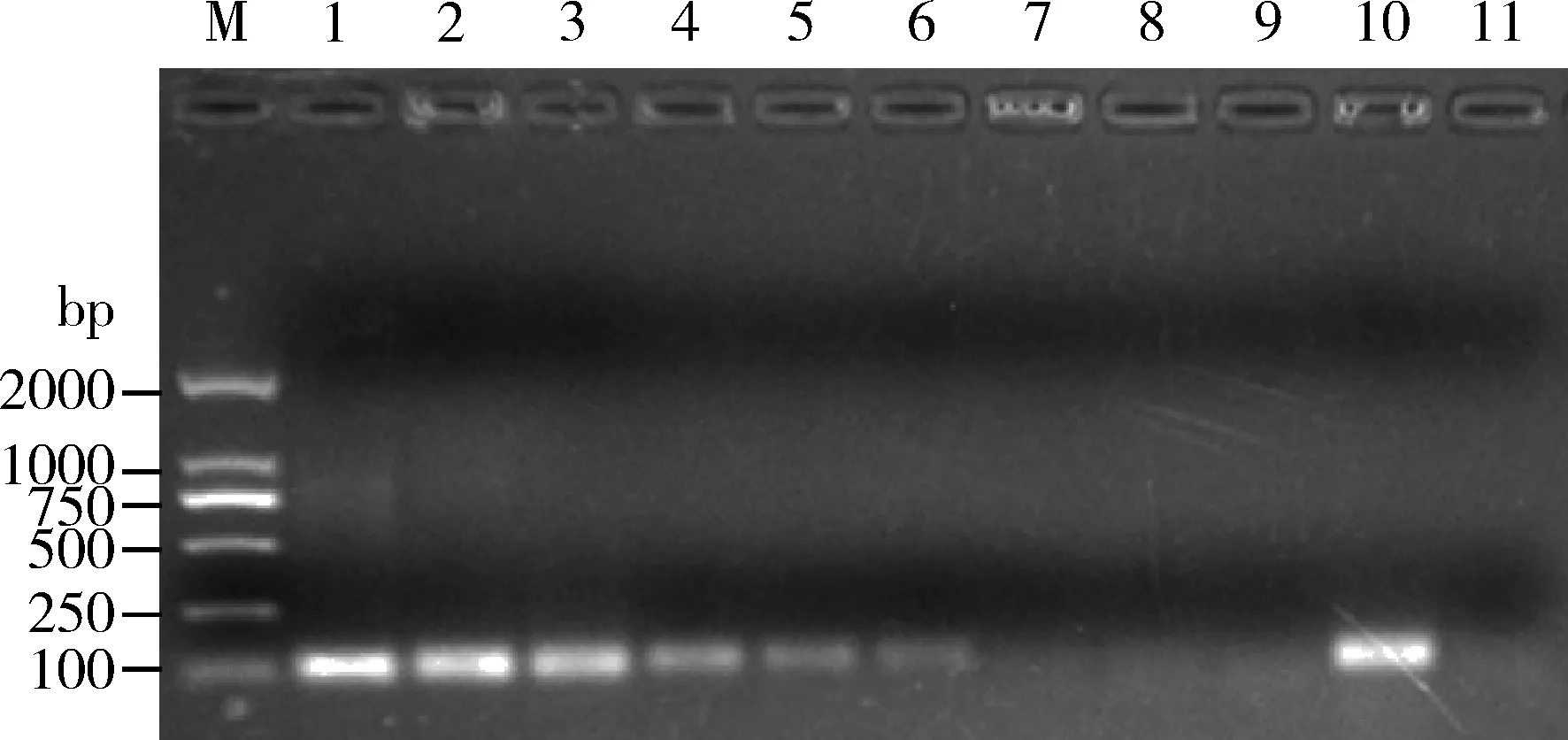
图4 常规PCR检测ToCV的灵敏度Fig. 4 Sensitivity of conventional PCR in detection of ToCVM: DNA分子量标准 DNA Marker (DL2000); 1-9: 分别为8.3×109, 8.3×108, 8.3×107, 8.3×106, 8.3×105, 8.3×104, 8.3×103, 8.3×102和8.3×10 copies/μL ToCV质粒标准品8.3×109, 8.3×108, 8.3×107, 8.3×106, 8.3×105, 8.3×104, 8.3×103, 8.3×102 and 8.3×10 copies/μL standard plasmid ToCV-pMD18-T, respectively; 10: ToCV, 阳性对照ToCV as the positive control; 11: ddH2O, 阴性对照ddH2O as the negative control.
2.4 常规PCR与TaqMan RT-qPCR特异性比较
常规PCR检测结果发现,仅ToCV模板出现119 bp的扩增条带,其他2种供试病毒TYLCV和TSWV的模板均未出现扩增条带(图5),表明所设计引物的特异性好。同时利用TaqMan RT-qPCR检测ToCV, TYLCV和TSWV,只有ToCV检测出较强的荧光信号,Ct值为22.17,检测结果为阳性,通过标准曲线可计算出样品中的ToCV的拷贝数为6.21×105copies/μL,而TYLCV和TSWV未检出荧光信号,与ddH2O为模板的扩增曲线相同,显示为0,重叠在一起(图6),表明该方法具有很高的特异性。
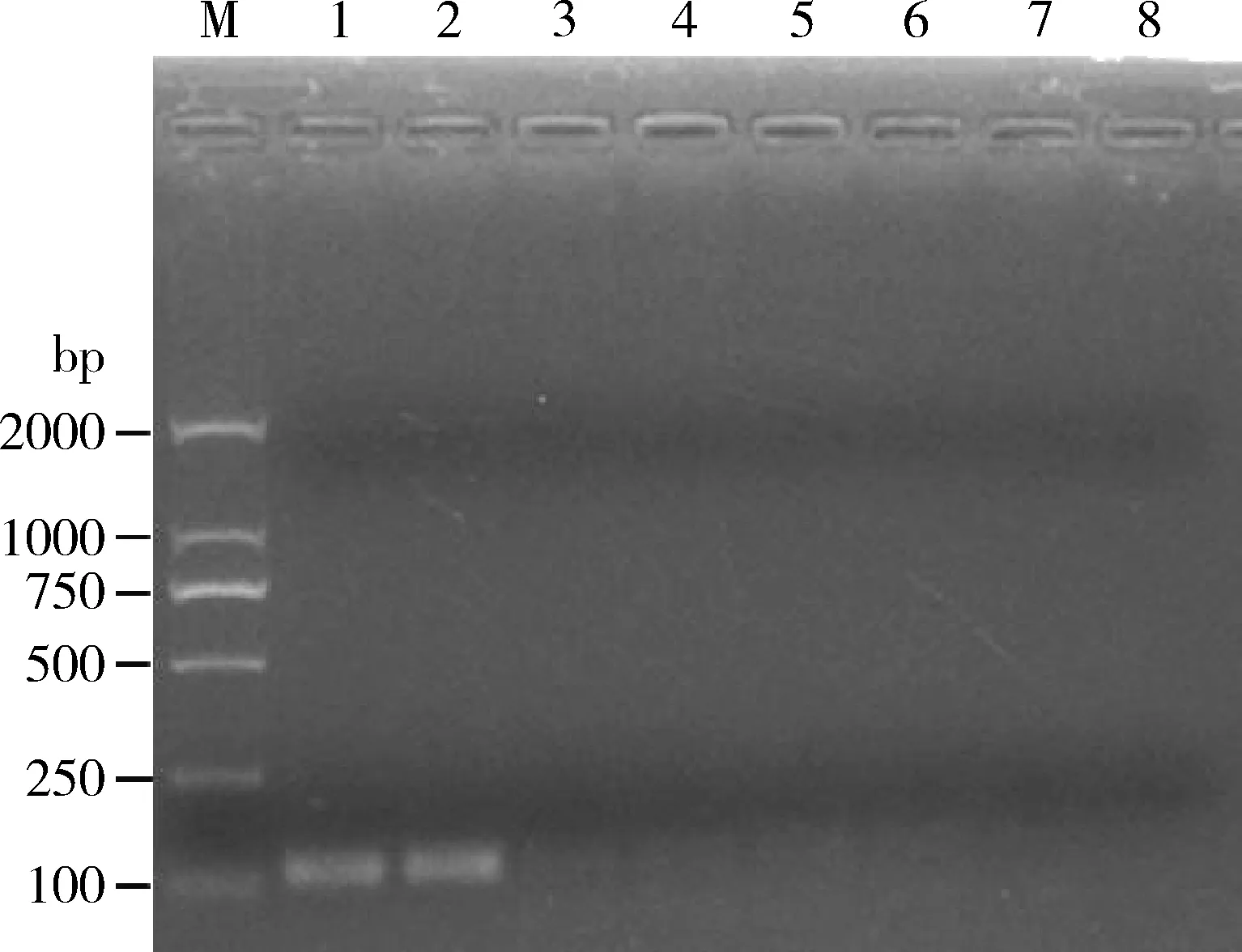
图5 常规PCR检测ToCV的特异性Fig. 5 Specificity of conventional PCR in detection of ToCVM: DNA分子量标准 DNA Marker (DL2000); 1-2: ToCV模板ToCV template; 3-4: TYLCV模板TYLCV template; 5-6: TSWV模板TSWV template; 7-8: ddH2O, 阴性对照ddH2O as the negative control.
2.5 单头烟粉虱体内ToCV的TaqMan RT-qPCR检测
应用TaqMan RT-qPCR方法对实验室温室内携带ToCV的烟粉虱种群和青岛市田间大棚内疑似ToCV感染的烟粉虱种群进行单头定量检测,各随机取50头烟粉虱成虫,结果如表2所示,温室内烟粉虱种群的ToCV携毒率为100%,田间烟粉虱种群的携毒率为30%;所有阳性检测结果的Ct值均低于35;所检测的单头烟粉虱最高携带ToCV的量为4.9×105copies/μL,最低携带ToCV的量为1.4×103copies/μL。
3 讨论
当前对于ToCV的传统检测方法多数针对感病植物组织,主要是常规PCR法、血清学鉴定法和逆转录环介导等温扩增法,这几种方法耗时耗力,在实际检测工作中也不够敏感(Kiletal., 2015; Larrea-Sarmientoetal., 2019),虽然RT-PCR方法与逆转录环介导等温扩增法灵敏度较高,但不能对病毒模板进行定量,这也使其难以符合现在更高标准的检测要求(陈旭等, 2010; Verweij and Stensvold, 2014)。本研究以其传播介体烟粉虱为切入点,基于TaqMan RT-qPCR设计了一种快速、灵敏的检测方法,通过对烟粉虱体内ToCV检测可以对ToCV的流行趋势进行监测。

图6 TaqMan RT-qPCR检测ToCV特异性Fig. 6 Specificity of TaqMan RT-qPCR in detection of ToCV1: ToCV模板ToCV template; 2: TYLCV模板TYLCV template; 3: TSWV模板TSWV template; 4: ddH2O, 阴性对照ddH2O as the negative control.

表2 单头烟粉虱成虫体内ToCV的TaqMan RT-qPCR检测Table 2 Detection of ToCV in a single adult of Bemisia tabaci using TaqMan RT-qPCR
本研究依据ToCV外壳蛋白基因高度保守区域设计的特异引物及TaqMan探针,建立了一种更为精准更为灵敏的荧光定量分析技术,能够对烟粉虱体内的微量病毒模板进行有效地定量检测,灵敏度达到8.3×10 copies/μL,是本研究中常规PCR检测的1 000倍,也是丁天波等(2018)对ToCV荧光定量检测灵敏度的约30倍。该方法利用上下游引物及中间探针使反应的特异性具有双重保证,荧光信号与PCR扩增完全同步,不易造成交叉污染,有着更高的检测灵敏度(蔡骁垚等, 2017; Shahetal., 2017; Ahmad-Nizaretal., 2019)。本研究的引物特异性检测结果亦表明,ToCV的TaqMan RT-qPCR引物对TYLCV与TSWV不表现任何扩增,引物特异性强,可以满足ToCV精准、快速的检测需求。
本研究所建立的TaqMan RT-qPCR方法与常规PCR检测技术相比,从RNA的提取到得到最终检测结果,因无需进行电泳检测而大大缩短了时间。除此之外,本研究所建立的方法还具有高度特异性和灵敏度,因探针可与病毒分子特异性结合而结果可靠,能灵敏地检测出微量模板中的病毒分子,为ToCV病毒植株及介体昆虫的病毒监测与防控提供了可靠依据,填补了国内利用TaqMan探针实时荧光定量方法检测介体烟粉虱体内ToCV的技术空白。
本研究所建立方法对单头烟粉虱携毒检测结果表明这些烟粉虱样品个体携毒量均在103数量级,相较于TaqMan探针可检测到的最低值仍有较大的空间,证明在本研究中涉及的TaqMan RT-qPCR方法具有较好的应用前景,可为ToCV快速诊断、早期预测预报及科学防控提供技术支撑。
致谢感谢青岛农业大学Michael Anthony Keller教授帮助修改英文摘要。

