超声引导胸神经阻滞在乳房肿块切除术中的应用
张南南 周 萍 谢鹏程
乳房肿块切除术局部麻醉下常需静脉辅助镇静、镇痛药物,但这些药物具有呼吸抑制、恶心、呕吐等副作用,增加了患者围手术期的风险。超声引导下神经阻滞具有定位精确、镇痛效果确切等优点,是目前临床上常用的麻醉方法[1]。本组旨在探讨超声引导下胸神经阻滞在乳房肿块切除术中的镇痛效果及并发症的发生情况,观察该种麻醉方法的可行性。
资料与方法
一、临床资料
选取2017 年1 月至2018 年1 月在我院行单侧乳房肿块切除术的患者60 例,年龄28~59岁,平均(42±9)岁;用随机数字表法随机分为神经阻滞组和局部麻醉组,每组各30 例。 两组均排除严重系统性疾病。两组患者一般资料比较差异均无统计学意义。本研究经我院医学伦理委员会批准,所有入选患者签署知情同意书。
二、仪器与方法
患者术前禁食12 h,禁饮8 h。入室后用多功能监护仪心电监护并开放健侧上肢静脉通路。神经阻滞组使用美国Sonosite S 系列彩色多普勒超声诊断仪,探头频率7~12 MHz,在超声引导下行PecsⅡ型胸神经阻滞术。患者取仰卧位,患侧上臂外展,肘部屈曲,手置于肩上,将探头置于前侧胸壁,自第一肋(图1A)逐层向下扫描至第二肋间隙,超声实时引导下在锁骨外侧1/3 胸肩峰动脉附近胸大肌与胸小肌筋膜间隙(图1B),回抽无血无空气后,注射10 ml 0.5%罗哌卡因,在第三肋骨水平前锯肌表面(图1C),回抽无血无空气后,注射10 ml 0.5%罗哌卡因。麻醉起效后进行手术,术中若患者感到疼痛则单次静脉注射芬太尼0.05 mg。局部麻醉组患者采用局部麻醉,沿手术梭形切口逐层注射局麻药1%利多卡因20 ml后手术,术中患者若感到疼痛则单次静脉注射芬太尼0.05 mg。

图1 超声引导胸神经阻滞
以疼痛数字评分法(NRS 评分)评估患者的疼痛程度:0 分无疼痛;1~3 分轻度疼痛;4~6 分中度疼痛;7~9 分重度疼痛;10 分剧痛。当患者NRS 评分≥4 分时需要追加镇痛药。记录两组患者术后2 h、4 h、8 h和12 h的NRS评分,两组术中追加芬太尼病例数,以及发生呼吸抑制、局麻药中毒、神经损伤、恶心、呕吐等不良反应的病例数。
三、统计学处理
结 果
一、两组患者的NRS 评分比较
术后2 h 两组患者NRS 评分比较差异无统计学意义;术后4、8、12 h,神经阻滞组NRS 评分较局部麻醉组明显降低,差异均有统计学意义(均P<0.05)。见表1。
表1 两组患者不同时间点NRS 评分比较(±s) 分

表1 两组患者不同时间点NRS 评分比较(±s) 分
与局部麻醉组比较,*P<0.05
组别神经阻滞组局部麻醉组术后2 h 1.5±0.8 1.6±1.1术后4 h 1.6±0.5*2.7±0.7术后8 h 1.8±0.6*3.7±1.5术后12 h 2.1±0.3*4.2±0.9
二、两组不良反应及追加芬太尼者比较
局部麻醉组有3 例发生术后呕吐,神经阻滞组1 例发生术后呕吐。两组均无呼吸抑制、局部麻醉药中毒等不良反应发生。局部麻醉组追加芬太尼者10 例,显著高于神经阻滞组(1 例),差异有统计学意义(P<0.05)。见表2。
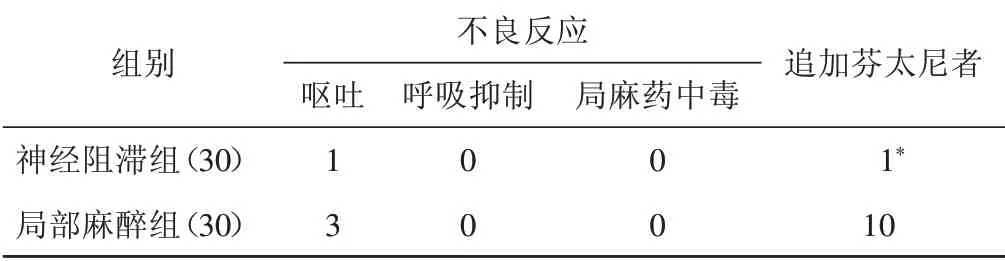
表2 两组患者不良反应及追加芬太尼者比较 例
讨 论
乳房肿块切除手术既往多采用单纯的局部麻醉,但存在阻滞不全、术中患者疼痛剧烈等弊端。为了缓解疼痛,术中常需追加阿片类药物,但该类药物常引起患者发生呼吸抑制和恶心呕吐等不良反应。随着超声技术的发展,在实时动态超声引导下可将需要阻滞的神经充分暴露于视野以内,可清楚分辨神经、血管及周围组织,并能够全程观测穿刺针的进针方向及深度,定位精准[2],此不仅能够有效避免局麻药误入血管引起的局麻药中毒,也能够避免穿刺针损伤胸神经。本组采用了Blanco 等[3]提出的PecsⅡ型胸神经阻滞,该方法是在超声引导下将局麻药注入第二肋下方的胸小肌和前锯肌之间,主要阻滞第2~6肋间神经外侧皮支、肋间臂神经和胸长神经,有较好的镇痛效果。本组结果显示,神经阻滞组追加芬太尼的病例数显著低于局部麻醉组(P<0.05)。神经阻断组较局部麻醉组术后4、8 、12 h 的NRS 评分明显降低(P<0.05),且较稳定。说明神经阻滞更能获得满意的镇痛效果,与赵杰等[4]研究结果相似。超声引导下胸神经阻滞麻醉能够使麻醉药充分包裹神经组织,麻醉效果确切且局麻药持续作用时间更久[5]。
本组结果还发现,神经阻滞组追加芬太尼者少于局部麻醉组(P<0.05),呕吐发生率虽低于局部麻醉组,但差异无统计学意义。与谭敬等[6]研究略有不同,该研究表明,超声引导下胸神经阻滞能够显著降低呕吐发生率(P<0.05),可能与本组样本量少有关;但追加芬太尼用量方面研究结果一致,这可能与有效的神经阻滞能降低患者使用阿片类药物有关。
综上所述,超声引导下胸神经阻滞可用于乳房肿块切除手术的麻醉,该方法可降低术中阿片类药物的使用量,降低患者术后疼痛评分,减少患者术后恶心呕吐的发生率,值得在临床麻醉工作中进一步推广使用。

