PLR与宫颈癌预后的相关性分析
耿敏,陈丽,王书华,李娜
(1.承德医学院,河北 承德;2.保定市第一中心医院妇科,河北 保定)
0 引言
宫颈癌是全球第二大女性恶性肿瘤,据国家癌症中心报道,我国每年新增宫颈癌病例约10.2万,发病率为15.30/10万,病死率为4.57/10万,其中85%以上发生在发展中国家[1],是发展中国家妇女的主要癌症死因[2],肿瘤的生长依赖肿瘤微环境,炎症在肿瘤细胞的发生及发展过程中发挥着巨大的作用,且与肿瘤患者的预后有一定的相关性。[3]炎症在肿瘤的起始、促进、发展、侵袭和转移中起着中心作用[4],外周血细胞可反映肿瘤患者的炎症状态,格拉斯哥预后评分(Glasgow prognostic score,GPS),中性粒细胞与淋巴细胞比率(Neutrophil-to-lymphocyte ratio,NLR),单核细胞与淋巴细胞比率(Mononuclear cell-to-lymphocyte ratio,LMR)和血小板与淋巴细胞比率(Platelet-to-lymphocyte ratio,PLR)等血液学指标,经研究显示与多种恶性肿瘤预后存在相关性[5],如非小细胞肺癌、肝癌、胃癌、胰腺癌、肾癌、直肠癌、宫颈癌等[6,18]。此外,HPV感染可引起机体炎症反应,HPV阳性的宫颈癌细胞分泌IL-16和IL-17会刺激骨髓髓系细胞的增殖,从而增加宫颈癌的发生风险[7],本研究旨在探讨炎症因子中血小板/淋巴细胞(PLR)与宫颈癌预后的关系。
1 材料与方法
1.1 临床资料
本研究回顾性收集北京解放军总医院2008年至2016年宫颈癌患者314例,临床资料包括患者一般资料(年龄、BMI、HPV感染、SCCa、术前诊断、肿瘤分期),(参照2014版 妇产科联盟FIGO分期标准),以及病理组织类型、组织学分级、不同术式、脉管癌栓、淋巴结转移、术后放化疗治疗、以及外周血指标(淋巴细胞、血小板、PLR)等。纳入标准:患者首次行宫颈癌根治术、经病理确诊为宫颈癌、术前7d内有完整的血常规检测报告、临床资料和随访资料完整,排除标准:排除合并感染性疾病急性或慢性期,围手术期死亡、严重肝肾功能损害、自身免疫性系统疾病、血栓及出血性疾病、存在第二肿瘤、曾经接受抗肿瘤治疗及临床资料收集不全、术前15d内有甾体类激素用药史的患者,经筛选后入组资料为314例。患者的随访(电话或门诊)。
1.2 方法
采用真空采血法采集所有宫颈癌患者诊断前24小时的清晨空腹静脉血,(第一次的血常规),送检验科进行血常规检测,通过仪器自动检测对外周血中各类细胞进行计数,计算PLR值,术后病理标本采用10%甲酸稀释液固定后送至本院病理科检查。
1.3 随访情况
患者治疗后随访方式主要通过门诊、电话定期随访的形式,前2年内每3-6月复查1次,第3-5年每半年复查1次,第六年开始每年复查1次,随访终点事件包括总生存时间(overall survival,OS)。OS指诊断第一天至死亡日期或失访患者的末次联系日期的时间。随访截止时间为2019年4月。
1.4 统计学分析
应用SPSS 20.0软件进行统计学分析。通过求得PLR值绘制ROC曲线(受试者工作特征曲线),并通过Youden指数计PLR的截断值。符合正态分布,采用t检验;根据截断值分将PLR分为高低组。率的比较使用χ2检验。COX单因素和多因素分析确定影响预后的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 临床病例资料分析
本研究收集314例宫颈癌患者,通过分析得出患者平均年龄为46岁,其中早期宫颈癌(IA-IIA)278例,晚期宫颈癌(IIB期-IV期)36例,宫颈鳞状细胞癌283例,宫颈腺癌31例,开腹宫颈癌根治术164例,腹腔镜宫颈癌根治术114例,截止到最后的随访时间,患者的平均生存时间为67.6月(20-128月),中位值为50月。以宫颈癌患者的OS(完全生存期)为终点,ROC曲线计算PLR曲线下面积为0.791,灵敏度和特异度分别为0.783,0.76(见图1),根据PLR的最佳截断值,将宫颈癌患者分为高PLR组(>140.25),低PLR组(≤140.25),经t检验或χ2检验分析显示:宫颈癌患者诊断前外周血PLR水平的升高与外周血中血小板计数的升高以及淋巴细胞的减少有关,与分期及手术方式也存在一定的差异,差异有统计学意义(P<0.001)。而PLR的高低与宫颈癌患者年龄、HPV16、18感染、病理类型、病理分化、脉管癌栓浸润、淋巴结转移、术后放疗、术后化疗等因素之间均无相关性,且差异无统计学意义(见表 1)。
2.2 PLR分组临床资料参数与宫颈癌患者的预后分析
Kaplan-Meier生存曲线分析结果显示:高低PLR组别中患者的5年OS生存率分别为72%、90.2%,经χ2检验,差异有统计学意义(χ2=74.82P<0.001 见图 2);
高低PLR组别中开腹宫颈癌根治术患者的5年OS生存率分别为82.5%、93%,经腹腔镜宫颈癌根治术患者的5年OS生存率分别为65%、82%,经χ2检验,差异有统计学意义(χ2=49.808P<0.001见图 3,图 4);
通过Cox单因素及多因素分析显示PLR增高是宫颈癌患者OS的独立预后因素,此外,HPV18感染及脉管癌栓、手术方式也可影响患者的预后(见表2),因此我们可以得出结论:PLR增高是影响宫颈癌患者OS(HR 0.23 :CI 0.136-0.388)的独立危险因素,通过比较高低组PLR中不同宫颈癌根治术式得出:高PLR组患者腹腔镜术式患者的5年生存时间明显低于开腹宫颈癌根治术患者,差异具有统计学意义(P<0.001)。
3 讨论
宫颈癌是女性最常见的妇科恶性肿瘤之一,高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染状态是其主要致病因素,HPV感染可引起机体炎症反应[8]。近年来虽然宫颈癌的治疗效果逐渐提升,然而复发及远处转移仍是困扰患者预后的危险因素。这可能是因为肿瘤在发展过程中逃避了机体免疫检测的程序,从而拮抗、阻断和抑制机体的免疫应答作用,从而有利于肿瘤细胞的生长及转移[9,10]。因此,需要临床工作中更易于获得且安全、经济、有效的预测指标,来预计宫颈癌患者的生存率及预后情况[20]。
目前,全身炎症反应已被证实在肿瘤发生和发展中存在重要的作用,其主要表现为中性粒细胞及血小板数目的增多以及淋巴细胞数目减少[11,12]。Rudlof Virchow 发现在肿瘤进一步发展之前,会首先出现炎细胞的浸润,第一次提出肿瘤起源于慢性炎症反应的部位[13-15]。细胞因子主要来源于血小板,可以结合VEGF、PDGF(Platelet Derived Growth Factor,血小板源性生长因子)、FGF(fibroblast growth factor,纤维母细胞生长因子)和 TGF-β家族蛋白,使血小板能够作为一种储存生长因子,来调节肿瘤血管生成、细胞增殖、迁移和转移,血小板数量的增加与癌症患者生存率的下降有关[17]。Zheng J[12]等的一项研究结果示:中性粒细胞/淋巴细胞和血小板/淋巴细胞在宫颈癌癌前病变鉴别中的应用,确定区分宫颈癌癌前病变和宫颈癌的能力。中性粒细胞释放几种细胞因子和吞噬介质,这些细胞因子和吞噬介质能够诱导细胞DNA损伤,刺激血管生成,阻止细胞凋亡[16]。淋巴细胞,在细胞介导的抗肿瘤免疫应答中起着非常重要的作用。它可以诱导癌细胞的细胞凋亡,导致细胞毒性[5]。因此,淋巴细胞计数偏低可能会导致免疫反应不足,这可能导致多种癌细胞存活,并进一步进展[16]。Oncel M.等[13]一篇文献得出 增加预处理NLR和PLR值可能为预测宫颈癌的分期提供有用的信息。J Oncol.等[11]一项研究示:多变量分析表明,PLR是PFS的独立预测因子,而不是OS。NLR和PLR与宫颈癌的临床特征相关。此外,PLR在宫颈癌根治术患者的PFS有独立的预后价值,与本研究结果相似。Yildirim等的[19]研究表明,PLR似乎是一种区分卵巢肿块的良恶性分化的有用方法,Kose等人的研究表明,高基线PLR也提供了关于宫颈病变侵袭性的有用信息。
综上所诉,目前国内很少研究PLR在宫颈癌预后中的相关价值分析。本研究将HPV18是否感染进行了分层,也可能是HPV感染降低了患者的免疫功能,从而打破了患者抗肿瘤炎症反应与促肿瘤炎症反应的平衡状态,从而影响了宫颈癌患者的预后。由此更加明确了PLR在宫颈癌中的独立预后价值。术前外周血PLR值能够对肿瘤患者治疗方案,生存预后进行有效评估,从而可以指导临床工作中制定个体化治疗方案及后续治疗随访,让患者获益。但是目前关于PLR在宫颈癌不同术式的疗效及预后的预测上,各家研究的结论未曾统一,且在不同瘤种中的研究结论及价值也有争议,PLR能否真正成为预测疗效和预后有价值的因子尚需大量前瞻性研究支持。
4 结论
PLR比值的增高可提示宫颈癌患者的预后不佳,低PLR组开腹宫颈癌根治术患者的5年OS(总生存时间)高于高PLR组腹腔镜根治术患者。故PLR可以作为一个简单预后指标用来指导宫颈癌治疗方式及术后风险评估。
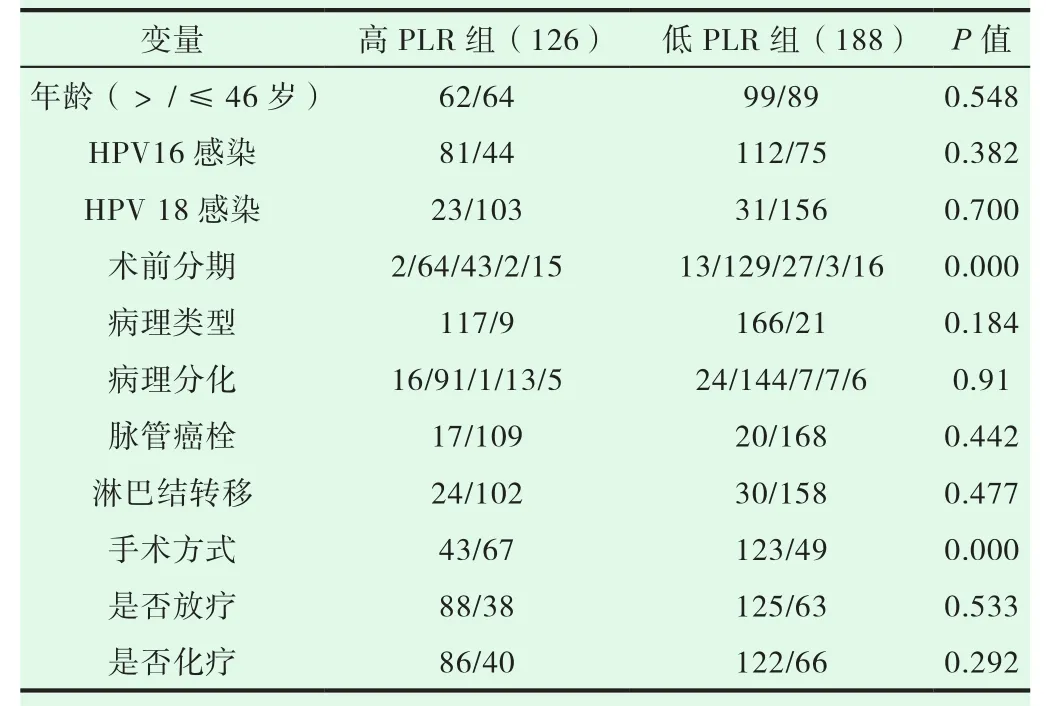
表1 两组宫颈癌患者一般资料比较
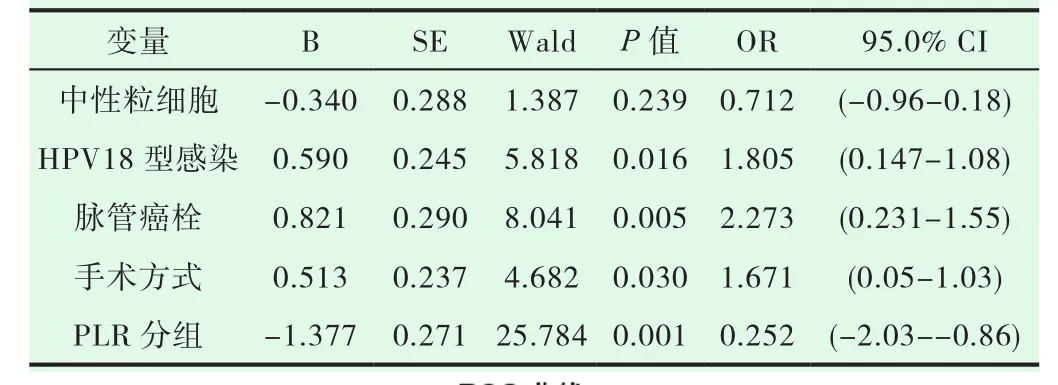
表2 Cox 单因素及多因素分析
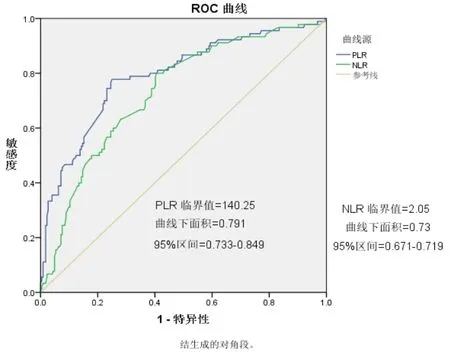
图1 PLR ROC曲线
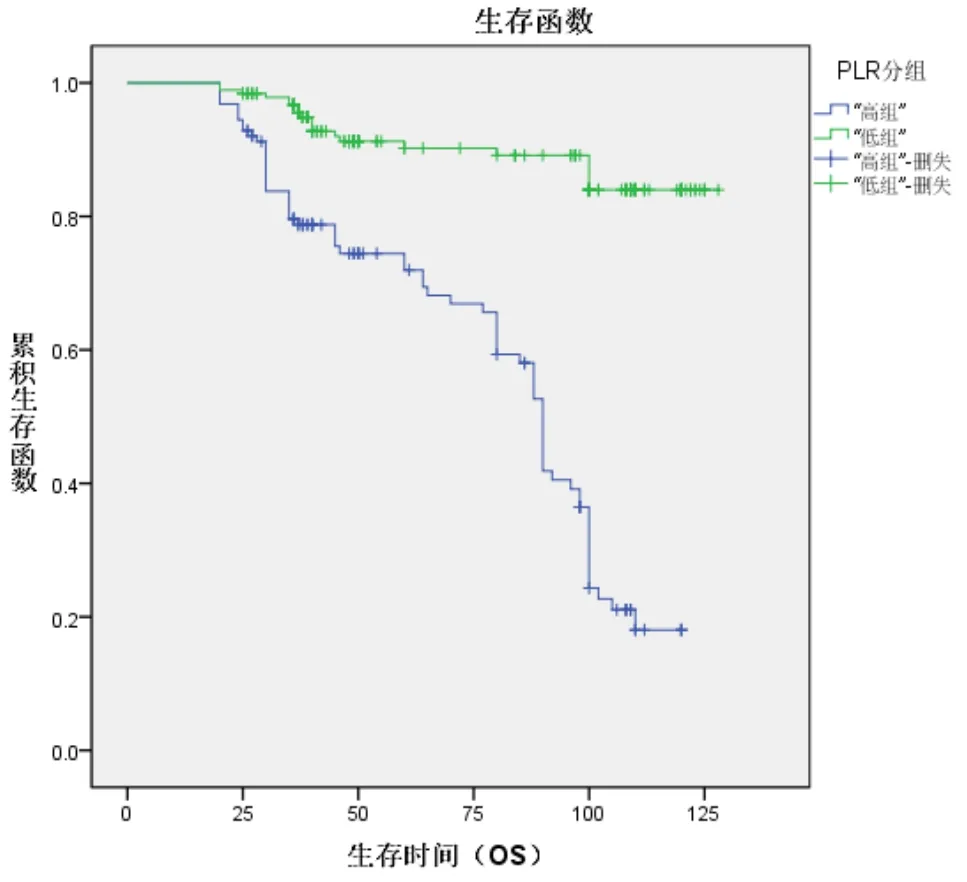
图2 Kaplan-Meier生存曲线
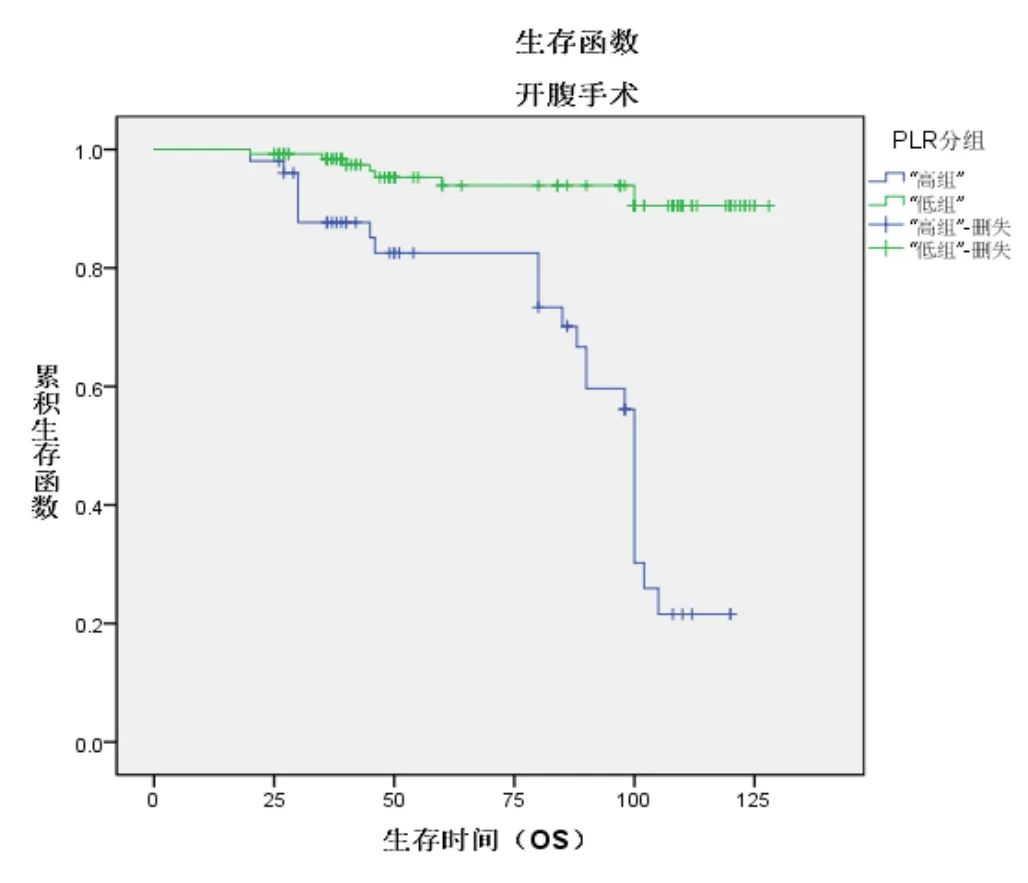
图3 经腹手术生存函数
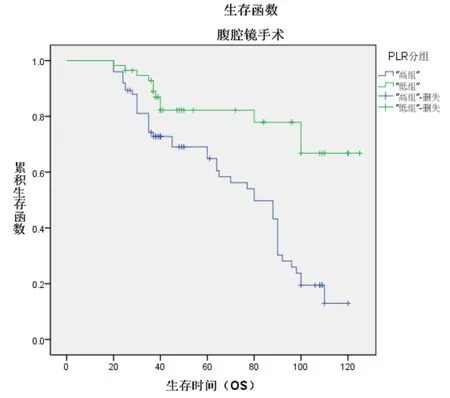
图4 经腹腔镜手术生存函数

