富硒长双歧杆菌优势菌株的高通量选育
张旭东,王 桃,王白鸽,李忠磊,陈代杰,谭 俊*
(1.上海医药工业研究院,上海 201203;2.上海师范大学 生命科学学院,上海 200234;3.上海交通大学 药学院,上海 200240)
硒是人体必需的一种微量元素,对人类健康有非常重要的作用,缺硒会引发多种疾病(如大骨节病、克山病等),严重缺硒还会引起心肌病及心肌衰竭[1-2]。硒元素能参与合成硒代甲硫氨酸、硒代半胱氨酸以及其他多种硒代蛋白(酶),具有抗肿瘤、抗氧化、调节免疫、增强抵抗力等生物学活性[3-6]。双歧杆菌(Bifidobacterium)具有益生作用,是1899年由法国学者TISSIER从母乳喂养的婴儿粪便中分离出的一种厌氧的革兰氏阳性杆菌[7-9],被广泛应用于各种食品(如牛奶、酸乳、婴儿配方奶粉、谷物类食品、奶酪和膳食补充剂等[10-11])中。
根据双歧杆菌的生理代谢特点,通过双歧杆菌的富硒化培养,将培养基中的无机硒转化为菌体内更高生物利用度的有机硒,制成富硒双歧杆菌的活菌制剂,不仅能够利用硒的保健作用,还可以增加双歧杆菌的稳定性与抗氧化能力,提高双歧杆菌的活力[12-14]。世界卫生组织建议每天补充200 μg硒,可有效预防多种疾病的高发。富硒益生菌既可以满足人们对益生菌的需求,又能增加产品有机硒含量,发挥了硒和益生菌的双重功效[15-17]。
双歧杆菌作为用于食品及药品的益生菌,其优势菌株的获得不能诱变,只能通过自然选育,然而传统的菌株选育方法工作量很大,不仅费时费力,且受到通量限制,大部分菌株由于没有筛选机会而被流失了,因此很难筛选到符合要求的优势菌株[18-21]。扩大筛选通量来减少随机筛选的盲目性是一条可以大大提高育种效率的新途径。本研究使用现有的通用低成本仪器设备,采用96孔深孔板微型化培养和酶标仪快速检测,筛选富硒长双歧杆菌优势菌株,通过培养过程中流加亚硒酸钠的方式,提高蛋白硒含量。硒对生命健康有极其重要的作用,开发富硒长双歧杆菌产品,将无机硒转化成毒性低和生物利用度高的有机硒,具有巨大的市场前景。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌种
长双歧杆菌(Bifidobacterium longum)DD98:由上海医药工业研究院实验室提供。
1.1.2 化学试剂
蛋白胨、酵母粉(均为生化试剂):安琪酵母股份有限公司;氯化钠、无水乙酸钠(均为分析纯):连云港冠苏实业有限公司;氢氧化钠(分析纯):济南英出化工科技有限公司;葡萄糖(分析纯):西王药业有限公司;低聚果糖(分析纯):邓州万博食品配料有限公司;L-半胱氨酸盐酸盐(分析纯):河南盛之德商贸有限公司;牛肉浸膏(生化试剂)、亚硒酸钠(分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
斜面培养基:牛肉膏10.0 g/L,酵母粉3.0 g/L,蛋白胨5.0 g/L,D(+)-葡萄糖5.0 g/L,氯化钠5.0 g/L,L-半胱氨酸盐酸盐0.5 g/L,无水乙酸钠3.0 g/L,琼脂粉18.0 g/L,pH 6.8。
种子培养基:牛肉膏10.0 g/L,酵母粉3.0 g/L,蛋白胨5.0 g/L,D(+)-葡萄糖5.0 g/L,氯化钠5.0 g/L,L-半胱氨酸盐酸盐0.5 g/L,无水乙酸钠3.0 g/L,pH 6.8。
发酵培养基:蛋白胨17.0 g/L,D(+)-葡萄糖22.0 g/L,酵母粉16.0 g/L,氯化钠5.0 g/L,L-半胱氨酸盐酸盐0.5 g/L,无水乙酸钠3.0 g/L,低聚果糖4.0 g/L,pH 6.8。
上述培养基均在121 ℃条件下灭菌20 min。
1.2 仪器与设备
BIOTECH-7BG发酵系统:上海保兴生物设备工程有限公司;PB-10酸度计:德国赛多利斯公司;LQ-C30002电子天平:上海瑶新电子科技有限公司;MULTISKAN GO酶标仪:美国Thermo Scientific公司;CONCEPT 400M厌氧培养箱:英国RUSKINN公司;LGJ-22D冷冻干燥机:北京四环科学仪器厂有限公司。
1.3 实验方法
1.3.1 高通量筛选流程
DD98菌株的分离纯化→长双歧杆菌优势菌株的高通量初筛→长双歧杆菌优势菌株的高通量复筛→长双歧杆菌优势菌株的富硒驯化→富硒长双歧杆菌优势菌株的高通量筛选→7 L罐发酵验证→菌株的稳定性考察
1.3.2 菌株DD98的活化
取一支菌株DD98的甘油管,等分至96深孔板各个孔中(每孔装种子培养基1 mL),静置在厌氧培养箱中,37 ℃培养,14 h 后检测各孔OD600nm值,从OD600nm值最高的孔中取出一部分发酵液,梯度稀释后涂布平板。将涂布好的平板倒置于厌氧培养箱中,37 ℃培养24 h,用牙签挑选长势较好的单菌落进行高通量初筛。
1.3.3 长双歧杆菌优势菌株的高通量初筛
用牙签从平皿上挑选尽可能多的单菌落至96深孔板中,静置在厌氧培养箱中,37 ℃培养14~16 h后,用8 道移液器取样(200 μL/孔),进行酶标仪检测(OD600nm值)。
1.3.4 长双歧杆菌优势菌株的高通量复筛
从高通量初筛菌株中挑选OD600nm值最高的24个孔进行复筛。按照5%(V/V)接种量接入已装有1.2 mL种子培养基的96 孔板中,每组4个平行,静置在厌氧培养箱中,37 ℃培养14 h后,用移液器取样(200 μL/孔),进行酶标仪检测(OD600nm值)。
1.3.5 菌株生长曲线的绘制
将菌株DD98与筛选得到的长双歧杆菌优势菌株分别接新鲜斜面,于厌氧培养箱37 ℃培养24 h,将斜面洗下至100 mL发酵培养基中,静置在厌氧培养箱中,37 ℃培养,每隔一定时间取样,稀释涂布,待菌落长出后,活菌计数,绘制菌株生长曲线。
1.3.6 长双歧杆菌优势菌株的传代稳定性考察
将长双歧杆菌优势菌株在新鲜斜面上连续5次传代,将不同传代次数的菌株分别进行摇瓶发酵,并对发酵液进行活菌计数,考察菌种的传代稳定性。
1.3.7 富硒驯化
将复筛获得的长双歧优势菌株进行富硒驯化。首先配制200 mg/mL亚硒酸钠母液,过滤后保存在冰箱,使用时根据浓度设定添加一定体积的亚硒酸钠母液到培养基中,再将培养基分装至96深孔板(每孔装量1.2 mL)或者平皿中。根据实验经验,设计富硒驯化梯度:5.0 μg/mL、10.0 μg/mL、15.0μg/mL、20.0μg/mL、25.0μg/mL、30.0μg/mL。将长双岐优势菌株的甘油管按照0.8%(V/V)接种量接至含有5.0 μg/mL亚硒酸钠种子培养基的96深孔板中(1.2 mL/孔),37 ℃静置厌氧培养20~22 h,用移液枪取样200 μL/孔,酶标仪检测OD600nm值。挑选OD600nm值最高的孔进行10 μg/mL亚硒酸钠浓度驯化,重复上述操作,直到亚硒酸钠添加量达到30.0 μg/mL,挑选OD600nm值最高的孔,稀释涂布到30.0 μg/mL亚硒酸钠平皿上,37 ℃厌氧培养箱培养24 h,待单菌落长出后,用牙签挑取尽可能多的个大且不红的单菌落于96深孔板中,静置在厌氧培养箱中,37 ℃培养14 h后,用移液器取样(200 μL/孔),进行酶标仪检测,OD600nm值高的几个孔,分别接新鲜斜面,37 ℃静置厌氧培养24 h后,用20%的甘油洗下斜面保种,编号并保藏。由于菌种退化问题,必要时菌种要复苏进行第二轮、第三轮驯化。
1.3.8 7 L发酵罐发酵
将富硒长双歧优势菌株与驯化前菌株分别接于新鲜斜面上,培养24 h后分别接种于种子培养基中,37 ℃培养12 h,按照6%(V/V)接种量接至7 L发酵罐(装量6 L)中。发酵罐温度为37 ℃,NaOH调节pH稳定维持在6.5,发酵罐发酵12 h时,放掉3 L,开始进行补料同时补硒,控制流速,24 h补完,亚硒酸钠质量浓度达到12.5 μg/mL,此时放掉部分发酵液,离心收集菌体并冻干,测菌体总硒含量及硒蛋白转化率。留3 L继续开始补料,同时取样进行活菌计数。以同样的速度,补料24h,补料结束时亚硒酸钠质量浓度达到18.5μg/mL,放罐离心收集菌体并冻干,测菌体总硒含量及硒蛋白转化率,同时取样进行活菌计数。
1.3.9 分析检测
(1)活菌计数
将待测样品进行梯度稀释,取100 μL加入固体平板上,用无菌涂棒将菌液涂布于整个平板表面,尽量将菌液涂干,每个稀释度涂至少3个平板,37 ℃倒置厌氧箱中培养,待菌落长出后,计数。原菌液的活菌数(CFU/mL),即每毫升原菌液活菌数=同一稀释度三个平皿菌落平均数×稀释倍数×10
(2)菌株富硒量的测定
根据国标GB 5009.93—2010《食品中硒的测定》测定样品的硒蛋白含量。
1.3.10 数据统计分析
实验中每个处理结果至少重复3次,采用Excel 软件分别对数据结果进行统计学误差分析并作图。
2 结果与分析
2.1 双歧杆菌优势菌株的高通量选育
2.1.1 菌种的活化
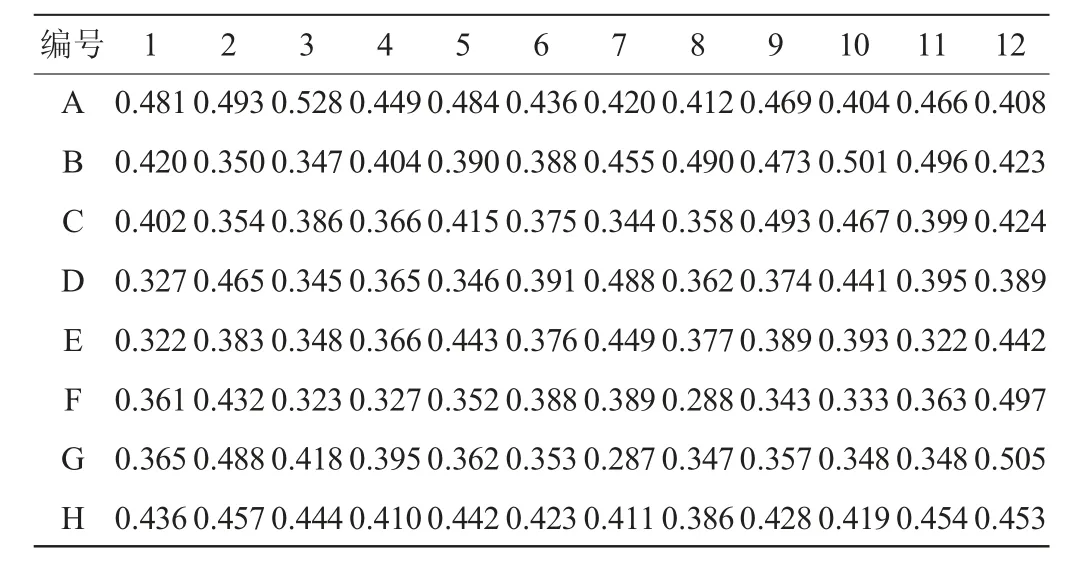
表1 长双歧杆菌DD98活化后的OD600nm值Table 1 OD600nmvalue of Bifidobacterium lonfidum DD98 after activation
由表1可知,各孔菌株生长存在一定差异:甘油管接到96深孔板中,于37 ℃厌氧箱中活化14~16 h后,大部分菌株的OD600nm值都处于0.35~0.45之间,A3孔长势最好,OD600nm值达到0.528,因此,选择A3孔进行稀释涂布,挑选单菌落进行高通量初筛。
2.1.2 长双歧杆菌优势菌株的高通量初筛
高通量初筛结果见图1。由图1可知,挑选的将近800个单菌落中,大部分菌株的OD600nm值处于0.35~0.50之间,只有少数菌株的OD600nm值能够超过0.60。选择OD600nm值最高的48个菌株(0.55~0.70)进行复筛。
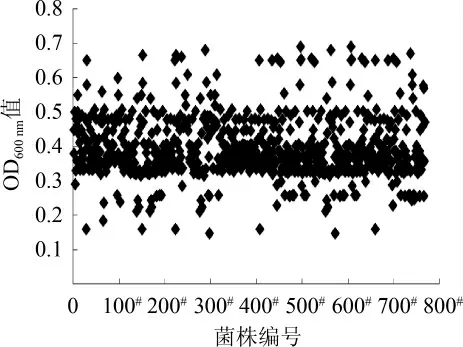
图1 高通量初筛结果Fig.1 Results of high-throughput preliminary screening
2.1.3 长双歧杆菌优势菌株的高通量复筛
高通量复筛结果见图2。由图2可知,11#、12#、24#、48#孔OD600nm值最高,分别为0.650、0.680、0.681、0.678,将这4个菌株分别接新鲜斜面并甘油管保存。
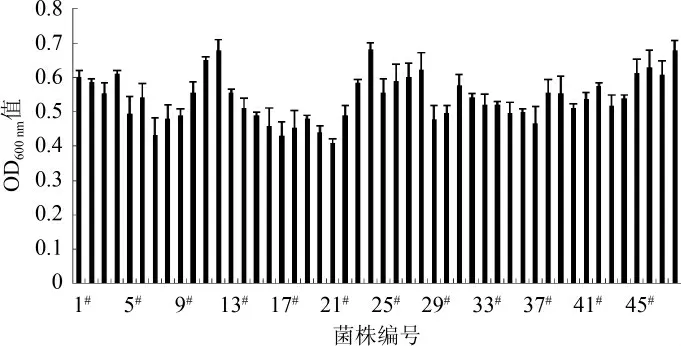
图2 高通量复筛结果Fig.2 Results of high-throughput secondary screening
2.1.4 菌株生长曲线的绘制
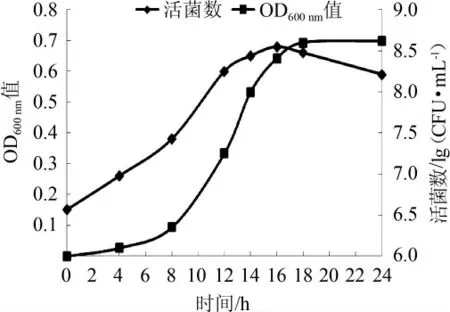
图3 长双歧杆菌DD98生长曲线Fig.3 Growth curve of Bifidobacterium longum DD98
长双歧杆菌DD98的生长曲线见图3。由图3可知,0~12 h活菌数不断增加,OD600nm值与活菌数呈一定对应关系;12~16 h活菌数增长速度减慢,而OD600nm值仍处于快速增长状态;16 h时活菌数达到最大,之后活菌数有所下降,但16 h后OD600nm值则处于一个平稳的状态。因此,选择对数生长中期的14 h,作为高通量取样检测时间。高通量检测方法使得大量样品可同时检测,不仅减少了检测误差,而且大大缩短了检测时间。
2.1.5 发酵培养验证
将11#、12#、24#、48#这4株优势菌株与DD98菌株进行摇瓶发酵比较,结果见图4。由图4可知,12#菌的活菌数最多,由7.4×108CFU/mL 提高至5.73×109CFU/mL。经过5次传代,活菌数仍稳定在5.0×109CFU/mL。因此,选择12#优势菌株进行富硒驯化,并编号为XBL-01。

图4 摇瓶发酵活菌数检测结果Fig.4 Determination results of the viable cells number in shake flasks
2.2 富硒长双歧杆菌优势菌株的高通量选育
2.2.1 富硒驯化及高通量筛选
对菌株XBL-01进行5.0 μg/mL、10.0 μg/mL、15.0 μg/mL、20.0 μg/mL、25.0 μg/mL、30.0 μg/mL的亚硒酸钠富硒驯化,每一次驯化完挑选OD600nm值最高的孔进行下一轮的富硒驯化,直到亚硒酸钠添加浓度达到30.0 μg/mL,挑选OD600nm值最高的孔,稀释一定梯度后,涂布到30.0 μg/mL 亚硒酸钠平皿上,37 ℃厌氧培养箱培养24 h,待单菌落长出后,尽可能多的挑取个大且不红的单菌落于装有培养基的96深孔板中,37 ℃静置厌氧培养20 h,酶标仪检测。结果见图5。

图5 高通量筛选结果Fig.5 Results of high-throughput screening
由图5可知,绝大部分菌株的OD600nm值处于0.30~0.50之间,只有少数菌株的OD600nm值能够达到0.60以上。选择长势最好的菌株,编号为XBL-30接新鲜斜面,甘油管保藏,用于7 L罐富硒发酵培养。本研究建立的微型化培养方法,将传统的摇瓶初筛和摇瓶复筛缩小在96孔深孔板中进行,先筛选出具有明显生长优势的混合菌群,再进一步从菌群中分离单菌落,然后结合高通量检测筛选到优势菌株,大大增加了筛选通量,提高了工作效率。
2.2.2 富硒长双歧杆菌优势菌株的稳定性考察
将富硒长双歧优势菌株XBL-30于新鲜斜面上连续传代5次,分别进行摇瓶发酵验证,活菌计数分别为1.57×109CFU/mL、1.76×109CFU/mL、1.52×109CFU/mL、1.69×109CFU/mL、1.55×109CFU/mL,菌株XBL-30具有较好的遗传稳定性,可用作下一步7 L罐发酵,同时也证实了高通量筛选方法具有可行性。
2.2.3 7 L罐富硒发酵培养
富硒长双歧优势菌株XBL-30与未富硒驯化的XBL-01菌株,通过流加补硒的方式,发酵结束后,分别离心收集菌体,冻干成富硒菌粉,测定菌粉的活菌数及硒蛋白含量,结果见图6。

图6 菌株XBL-30及菌株XBL-01 7 L罐发酵结果对比Fig.6 Comparison of fermentation results of strain XBL-30 and XBL-01 in 7 L fermentor
由图6可知,未富硒驯化的XBL-01菌株活菌数为1.12×109CFU/mL,硒蛋白转化率为60.9%;而富硒长双歧优势菌株XBL-30活菌数为4.94×109CFU/mL,硒蛋白转化率提高到85.3%。此结果也进一步证实高通量筛选方法具有可行性。
3 结论
本研究采用96深孔板微型化培养方法,先筛选出具有生长优势的混合菌群,再进一步从菌群中分离单菌落,然后结合高通量检测筛选出优势菌株,大大降低了筛选工作量,减轻育种工作者的负荷。此外,采用梯度压力驯化结合高通量筛选的方法,成功筛选到富硒长双歧杆菌优势菌株XBL-30,并对其进行7 L发酵罐富硒培养,在亚硒酸钠添加质量浓度为18.5 μg/mL时,硒蛋白转化率达到85.3%。本研究建立的高通量筛选方法具有可行性,对其他益生菌等菌株的大规模筛选具有重要的参考价值。

