鄱阳湖南矶湿地22种植物根系碳氮及其化学计量研究
崔 浩,张前前,陈明月,吴 琴,*,冯 哲,汪 琴,胡启武,2
1 江西师范大学地理与环境学院, 南昌 330022 2 鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022
生态化学计量学反映元素之间的平衡与耦合关系,为探讨生态系统结构、功能与稳定的维持机制提供了新思路[1]。近十年来,国内外学者从不同时空尺度、不同生态系统类型开展了大量的相关研究[2- 6],但多集中于生态系统地上部分,地下根系的研究则相对不足[7-8]。根系作为植物的重要功能器官,不但为植物吸收养分和水分,而且通过呼吸和周转消耗光合产物并向土壤输入有机质。植物生物量的20%—70%被分配至地下根系[9],如果忽略根系的生产、死亡和分解,土壤有机质和养分元素的周转将被低估20%—80%[10]。因此,加强根系碳氮及其化学计量关系研究,不仅有利于阐明元素化学计量关系的垂直分异,而且对于进一步揭示地下生态过程与机理,以及地下与地上部分的相互作用机制具有重要意义[7,11]。
以往涉及根系的研究中多以直径<2 mm作为粗细根的划分标准。然而根系在发育过程中形成明显的分枝结构,具有高度的形态异质性[11-12],这种异质性综合反映了根系之间生理、化学组成以及寿命上的差异[13-14]。由于不同植物根系中相同根序的根具有相似的功能,基于根序进行相关研究已显得十分必要[15-16]。鄱阳湖是中国最大的淡水湖,年内、年际水位波动剧烈,干湿交替频繁,形成了典型的湖泊湿地生态系统。本研究沿水位梯度自湖滨高滩地草甸植被带至低滩地湿沼生植被带采集了22种常见湿地植物,基于根序分析了根系C、N浓度及其化学计量关系,以探讨不同根序、不同物种以及不同生境对于根系化学组成及其计量关系的影响,为进一步阐明鄱阳湖湿地C、N养分循环及其机理提供基础数据。
1 材料与方法
1.1 研究区域概况
研究区设置在鄱阳湖湿地分布最为典型的区域—赣江三角洲前缘地带的南矶湿地国家级自然保护区(图1)。保护区地理坐标(28°52′05″—29°06′50″ N,116°10′33″—116°25′05″ E),区内除南山岛和矶山岛2个居民点占据4 km2面积之外,其余为洲滩和水域,总面积约330 km2。湖滨洲滩淹没于水下的时间视高程及当年具体水文情势一般在2—5个月不等,其余时间则出露于水面。多年平均气温17.6 ℃,平均降水量为1450—1550 mm。洲滩植被按高程划分主要为高滩地草甸植被带和低滩地湿沼生植被带,优势植物群落包括蒌蒿(Artemisiaigniaria)、芦苇(Phragmitesaustralis)、南荻(Triarrhenalutarioriparia)、灰化苔(Carexcinerascens)、菰(Zizanialatifolia)等,土壤类型分别为草甸土和草甸沼泽土。
图1 研究区位置图Fig.1 The sampling location of study area
1.2 样品采集与处理
于2017年4月在研究区沿水位梯度设置长度约3000 m宽度约500 m的样带,对湿地常见植物群落进行样方调查,并进一步将样带划分成4个采样小区,随机在其中的3个小区中进行常见植物的重复采样(即每个物种3个重复),共计采集了22种植物(表1)。在每个小区采用S型多点混合采样方法采集某一物种的混合样品作为一个重复。具体如下:对于某一物种,在S型线路上挖取3—5个保持地上植株与地下根系相连接的30 cm长×30 cm宽×40 cm深大小的土块,整体装入贴有标签的保鲜袋,并将保鲜袋装入冷藏箱带回实验室,再用去离子水小心清洗掉每个土块中根系表面的土壤和杂质,最终在每个重复样中获取10—20株完整根系,以密封袋进行冷冻(<-10 ℃)保存,取样及清理过程中尽量避免末端根系的损失,保证根系构型的完整性。根据Pregitzer等[12]的根序分级方法,每个完整的植物根系分成3级,最远端的根尖(根系末梢)定为一级根,两个一级根交汇处为二级根,依次类推到三级根,每一份重复样本中的一级根不少于100个;二、三级根不少于50个。22种植物中除菰、水田碎米荠和附地菜分至二级根外,其余19种植物分至三级根,将收集好的每一级根分别装入小号牛皮纸样品袋并做好标签,放置于65 ℃烘箱中烘干48 h至恒重,利用球磨仪将烘干的根系样品粉碎,利用意大利欧维特元素分析仪(EA3000)测定全C、全N浓度。
1.3 数据处理
运用SPSS 19.0以及Excel 2016对数据进行分析处理。利用多因素方差分析不同生境下物种及根序对根系碳氮及化学计量关系的影响;利用T检验比较两类生境之间根系的差异。利用Pearson相关系数分析不同根序间碳氮之间的关系,文中显著性水平设置为α=0.05。
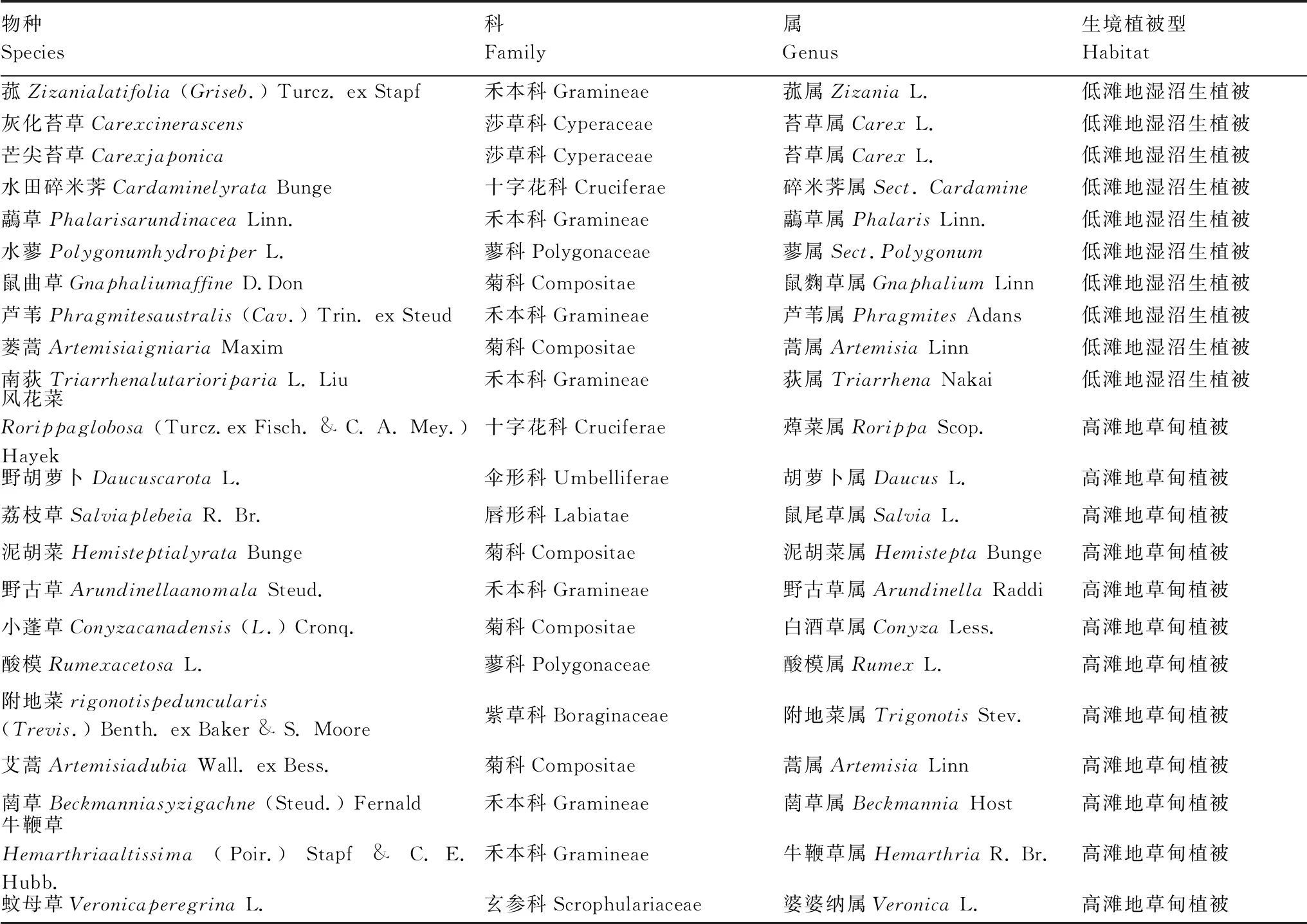
表1 南矶湿地22种植物的基本信息
2 结果与分析
2.1 根系全C浓度
22种植物一级根C浓度变化范围为304.56—412.16 mg/g,平均值为(363.57±26.00) mg/g,变异系数为7.15%。一级根平均C浓度最大值为芦苇(388.27 mg/g),最小值为艾蒿(315.07 mg/g)。二级根C浓度变化范围为322.7—417.02 mg/g,平均值为(373.77±24.70) mg/g,变异系数6.61%;二级根平均C浓度最高与最低的物种与一级根一致。三级根C浓度变化范围为267.15—423.22 mg/g,平均值为(378.68±27.48) mg/g,变异系数为7.62%,三级根平均C浓度最大值为鼠曲草(413.76 mg/g),最小值为野古草(328.89 mg/g)。22种湿地常见物种根系平均C浓度总体随根序等级升高而增加(图2),不同根序间(F=6.578,P<0.01)、物种间(F=10.910,P<0.01)全C浓度均表现出显著的差异性。不同根序间C浓度的相关分析表明,一级根与二级根间存在极显著相关性(r=0.789,P<0.01),但三级根C浓度与一级根、二级根相关性均不显著(表3)。
以生境类型来划分,高滩地草甸植被带1—3级根平均C浓度分别为(348.56±25.64)、(359.23±20.35)、(367.86±29.21) mg/g;低滩地湿沼生植被带1—3级根平均C浓度分别为(376.23±19.34)、(385.61±20.86)、(390.17±20.03) mg/g。1—3级根碳浓度均表现为低滩地湿沼生植被显著高于高滩地草甸植被(t=8.160,P<0.01)。此外,两种生境下的多因素方差分析结果均表明根序、物种及二者间的交互作用显著影响根系C浓度(表2)。
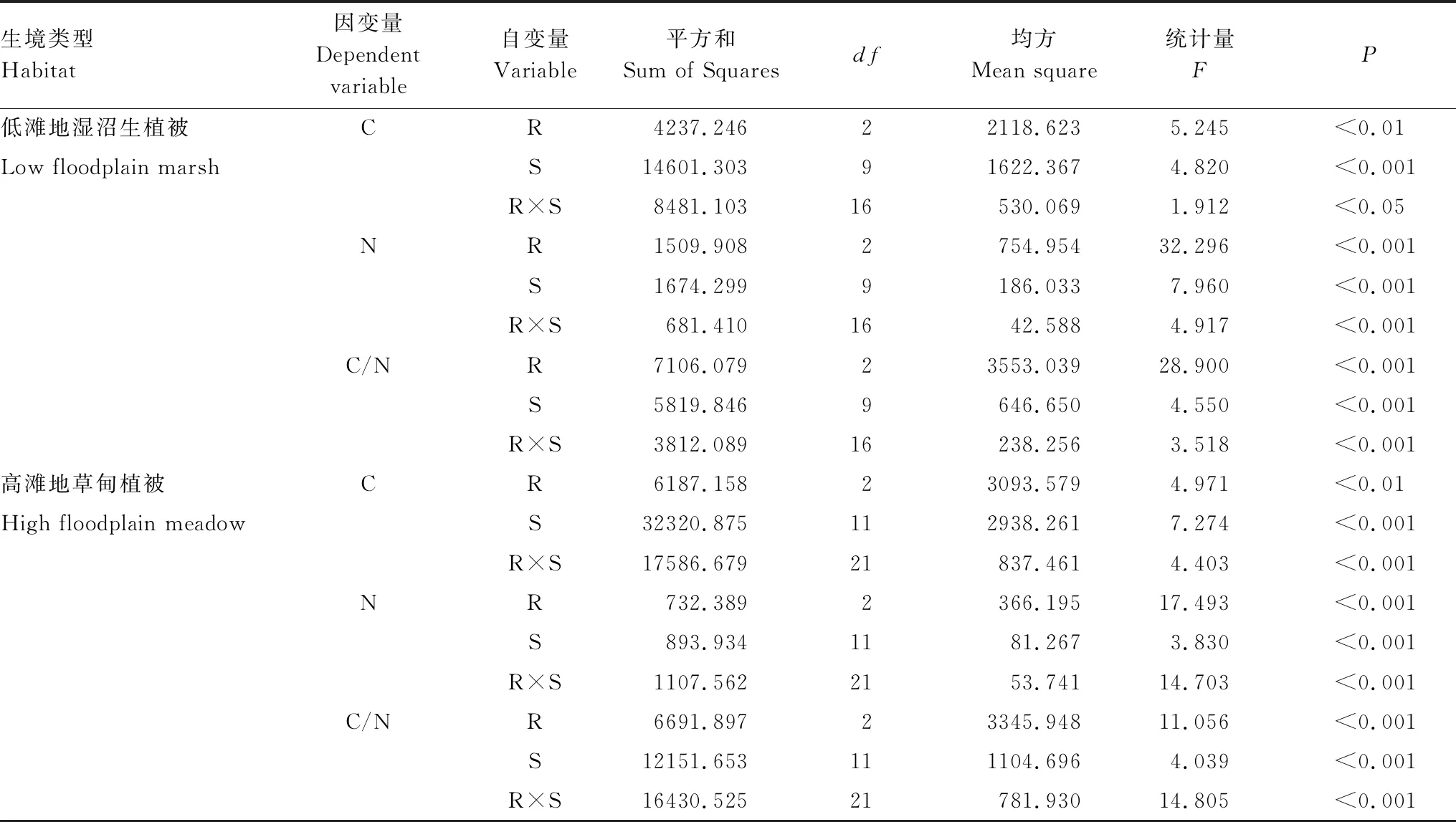
表2 两种生境条件下物种(S)与根序(R)对根系C、N浓度及其化学计量比影响的GLM分析
2.2 根系全N浓度
根系全N浓度表现出随根序升高而降低的规律(图3),22种植物一级根全N浓度变化范围为8.45—31.05 mg/g,平均值为(18.21±5.29) mg/g,变异系数28.53%,平均N浓度最大和最小分别为水蓼(26.22 mg/g)和灰化苔草(9.16 mg/g);二级根全N浓度变化范围为3.98—27.04 mg/g,平均值为(13.76±5.00) mg/g,变异系数为36.35%,平均全N浓度最大为水田碎米荠(25.24 mg/g),最小为菵草(4.28 mg/g);三级根N浓度变化范围为2.22—17.52 mg/g,平均值为(10.61±3.65) mg/g,变异系数为34.39%,平均N浓度最大为荔枝草(17.24 mg/g),最小值为野古草(3.58 mg/g)。与全C类似,根序(F=49.197,P<0.01)和物种(F=5.596,P<0.01)显著影响着全N浓度,并且一级根与二级根全N浓度存在极显著相关关系(r=0.615,P<0.01),但与三级根之间不相关(表3)。
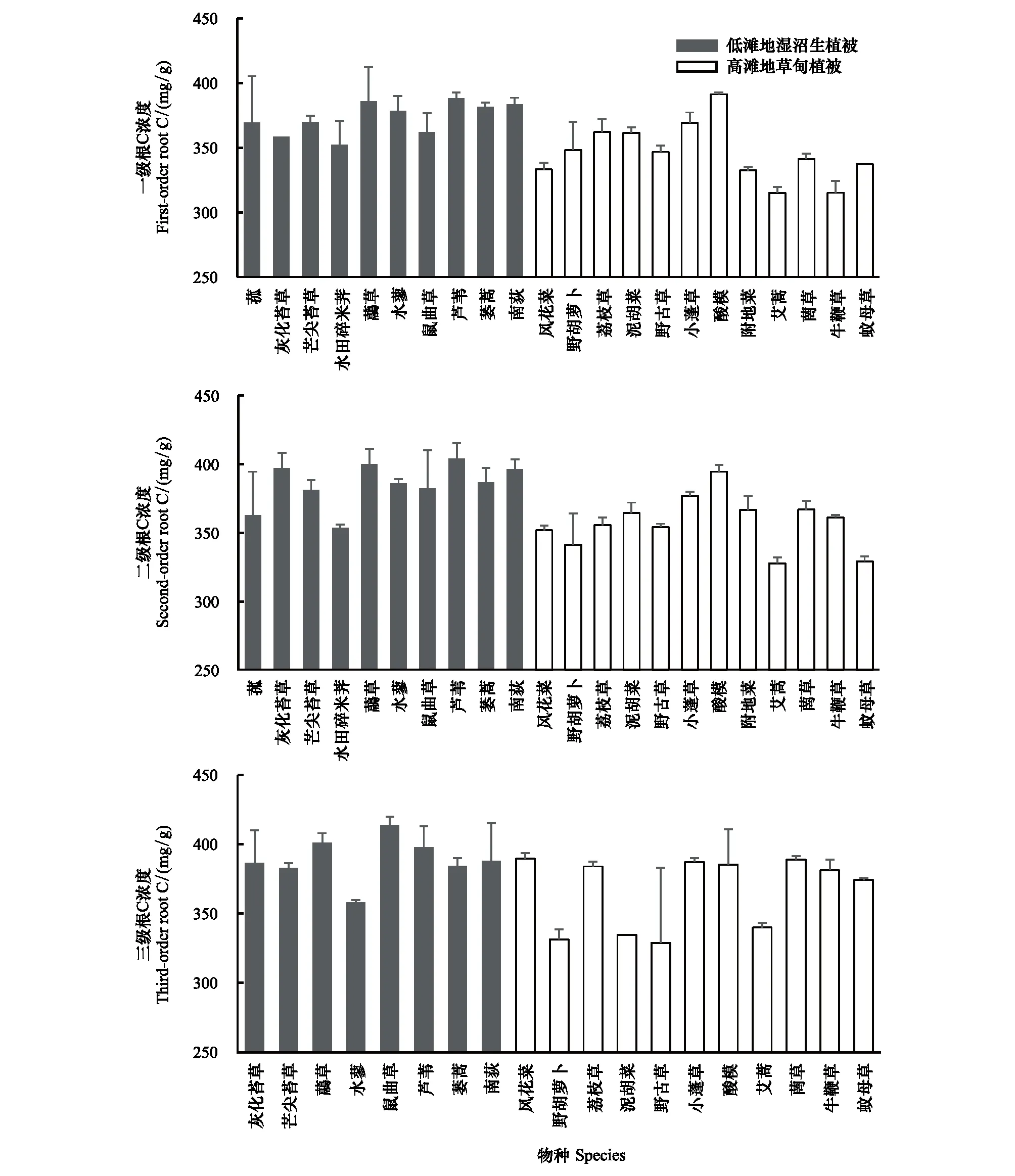
图2 不同物种各根序全C浓度Fig.2 Carbon concentration of different root orders of 22 species in Nanji wetlands
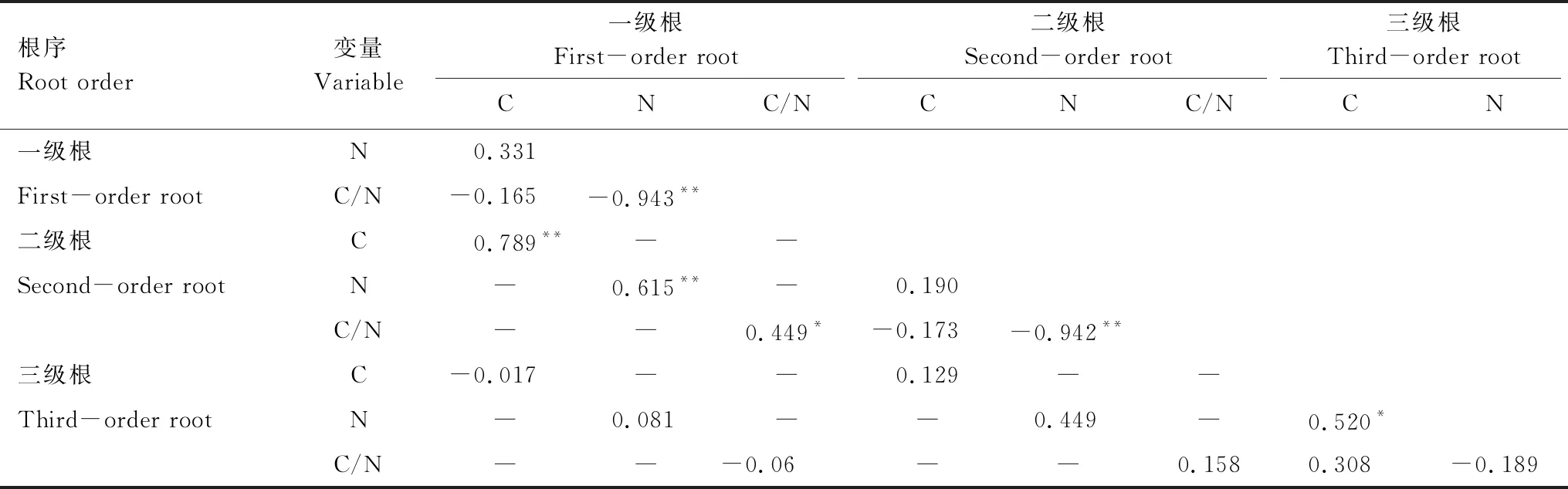
表3 根序间C、N浓度及C/N之间的相关系数
*表示P<0.05,**表示P<0.01
根系全N浓度在低滩地湿沼生植被带((15.00±5.96) mg/g)和高滩地草甸植被带((13.94±5.25) mg/g)两种生境水平上未表现出显著差异(t=1.408,P=0.160),其中低滩地湿沼生植被1—3级根平均N浓度分别为(19.15±5.80)、(14.31±4.88)、(10.28±2.99) mg/g,高滩地草甸植被1—3级分别为(17.51±4.20)、(13.04±5.10)、(11.08±4.26) mg/g。但在两种生境类型内部,根序、物种及其交互作用仍然显著影响着根系全N浓度(表2)。
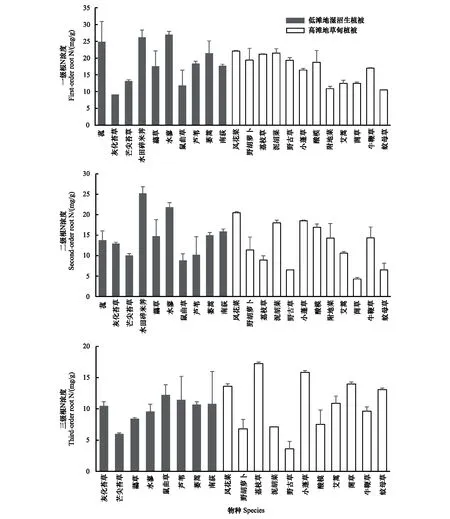
图3 不同物种各根序全N浓度特征 Fig.3 Nitrogen concentration of different root orders of 22 species in Nanji wetlands
2.3 根系C/N化学计量比
根系C/N总体随根序升高而升高(图4),一级根C/N值变化范围为10.96—41.99,灰化苔草最大(39.12),水田碎米荠最小(13.43±0.46);二级根变化范围为13.18—94.08,菵草最大(86.25±8.05),水田碎米荠最小(14.05±0.82);三级根变化范围22.10—120.34,最大、最小分别为野古草(96.57±21.55)和荔枝草(22.27±0.17)。方差分析结果表明不同根序(F=33.417,P<0.01)、不同物种(F=4.261,P<0.01)间C/N差异显著。相关性分析表明,一级根与二级根C/N值显著相关(r=0.449,P<0.05),其他各根序间相关性均不显著(表3)。
两种生境间C/N差异不显著(t=0.641,P=0.522),低滩地湿沼生植被1—3级根平均C/N分别为(21.82±10.34)、(30.56±12.74)和(41.23±12.34);高滩地草甸植被分别为(21.13±5.50)、(33.79±18.74)和(40.86±23.43)。不同生境下根序和物种及其交互作用均对C/N具有极显著影响(表2)。

图4 不同物种各根序C/NFig.4 Variation of C/N ratios of different root orders of 22 species in Nanji wetlands
3 讨论
3.1 鄱阳湖湿地植物根系C、N浓度及其C/N与其他地区比较
与大尺度研究结果相比,鄱阳湖湿地植物根系C浓度明显低于全球(436.9 mg/g)[17]和中国(473.9 mg/g)[18]植物的平均值。造成这种差异的原因可能是多方面的,如大尺度研究中的样本通常来自于不同生态系统类型,包括了不同的植物生活型。例如,木本植物的全C浓度通常要高于草本植物。此外,根系区分方法也是引起差异的原因之一。不同于全C浓度,鄱阳湖湿地植物根系全N浓度(14.46 mg/g)高于全球和中国的平均值,这一方面可能与湿地植物较高的生长速率对氮的需求有关;另外一方面,湿地土壤的N素水平往往高于陆地生态系统,从而增加了植物根系的氮素供应(表4)。由于本研究中的22种植物均为草本植物,通过与一些草本植物相关研究结果的比较发现:鄱阳湖湿地植物根系C浓度(371.63 mg/g)低于内蒙古温带草原(437.20 mg/g)、黄土高原荒漠草地(红砂524.3 mg/g,白刺548.43 mg/g)和美国密歇根州两种草本植物(水叶苔草417.35 mg/g,毛堇菜 426.35 mg/g)的细根C浓度(表4)。全C浓度与根系形态关系密切,粗根系需要更多的C构建[19],相比于湿地生态系统,草地生态系统植物可能具有更发达的粗根系;全N平均浓度(14.46 mg/g)低于美国密歇根州的测量结果,高于其他两个区域(表4)。此外,若不考虑根系区分方法,与其他地区湿地生态系统相比较,闽江湿地芦苇和短叶茳芏群落(378.33 mg/g)[20]、双台河口湿地翅碱蓬群落(379.20 mg/g)[21]与鄱阳湖南矶湿地植物根系全C浓度差异不大,而南矶湿地植物根系全N浓度则高于上述两区域(9.00、6.8 mg/g)。本研究中根系C/N(31.01)值明显低于上述全球与中国植物的平均值,但与各区域的草本植物差异较小,这可能与草本植物具有相似的养分分配策略有关。
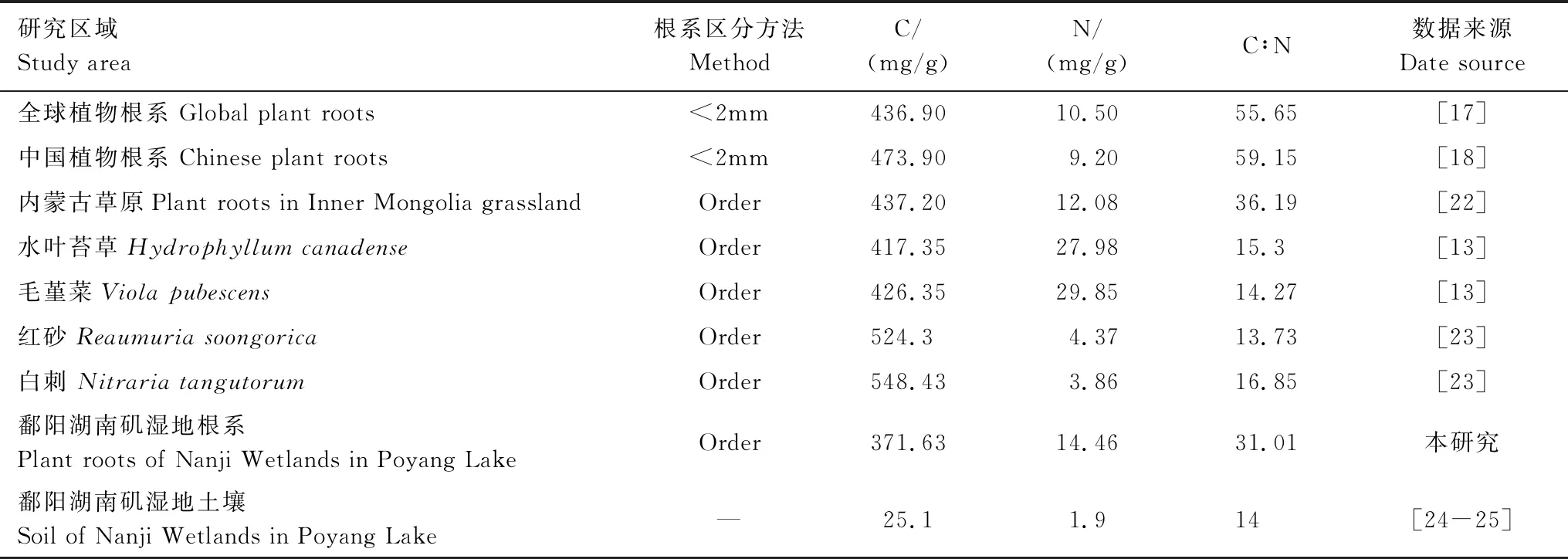
表4 不同研究区植物根系碳、氮及其化学计量比
Order:表示采用根序分级方法
3.2 根系碳氮及其化学计量关系的影响因子
多因素方差分析表明根系的C浓度同时受到根序、物种及生境条件的显著影响,而N浓度与C/N则主要受根序与物种差异的显著影响。根系C、N浓度与C/N随根序的变化与生长速率假说[26]相符,且与现有研究结论一致[12,17,27],即低级根序为满足其快速生长需要更多的N,因此表现出较低的C/N,也表明了不同根序的异质性特征。这种变化规律可从多个方面解释,首先,从光合碳分配、根系解剖结构及其生理功能上分析。植物光合产物分配受同化物传输、呼吸作用和同化物的存储等一系列生理过程的共同影响[28]。此外,功能平衡假说认为,植物光合产物向不同器官的分配由各自功能之间的相互平衡达到。一级根主要由初生组织构成,皮层组织发达,大量的皮层细胞主要吸收养分和水分[29],导致该级根系N浓度高,也使得一级根具有较高的生物量。随着根序升高,皮层组织退化,维管束逐渐发达,木质化程度升高,养分吸收速率降低,因此,三级根主要以运输和储藏功能为主,C浓度较高。相关性分析表明一级根与二级根在养分浓度和养分利用方面显著相关,但二者与三级根不存在显著相关关系,也表明了三级根与一、二级根之间存在异质性。其次,从代谢角度分析,低级根序是整个根系中最活跃的部分,根尖细胞分裂旺盛,呼吸速率较快[13],因而对N需求量大。同时,一级根在生长和养分吸收、运输也要消耗大量的C,同样也导致了N浓度的升高[19,29]。
C/N反映植物吸收营养元素时所能同化碳的能力和对营养元素的利用效率,较低的C/N也证明了低级根序具有较高的养分利用效率。Pregitzer等[12]在对北美植物细根研究中提出,植物细根C/N的变化可能与根N浓度直接相关,这在本研究中也得到证实。一、二级根C/N与相应各级根的N浓度极显著相关,说明鄱阳湖湿地植物根系C/N主要受根系全N的影响,这与细根功能和代谢过程密切有关。而高级根序作为主要运输和存储器官,并不是养分吸收和代谢过程的主体,因而与其根N浓度之间没有显著相关性(表3)。细根周转是养分循环的主要过程之一[30],每年有高达30%的NPP用于细根的生长和周转[31],Pregitzer通过对木本植物根系研究表明,根系死亡顺序与发育顺序相反,低级根序较高级根序拥有更短的生命周期[12]。本研究中低级根序C浓度较低、N浓度较高,随着根序升高,C浓度增加、N浓度下降,C/N不断增加,不同根序间存在显著差异。因此,进一步的湿地根系周转研究中引入根系分级显得十分必要。
化学计量内稳性(stoichiometric homoeostasis)是生态化学计量学存在的基础。Elser等[32]认为尽管C、N、P化学计量关系具有较大的时空变异,但生物有机体仍保持极高的化学计量内稳性。化学计量内稳性通过调节生物对环境因子的响应,成为生态系统结构、功能和稳定性维持的重要机制[1]。本研究中的22种植物分属于湖滨高滩地草甸植被带和低滩地湿沼生植被带(表1),两种生境下的土壤水分、养分均存在显著差异[26]。个体水平的比较结果表明,不同物种间根系C/N存在显著差异。但是从两种生境(代表2种植被型)来看,未发现两种植被型之间存在C/N化学计量关系的显著差异。这一方面表明生态系统的化学计量内稳性程度很可能随着尺度的上升而增加,与相关文献报道一致[2]。另一方面也表明,随着水分的变化,湿地植被由中生性草甸植被演替至湿、沼生植被,尽管物种及其化学元素组成发生变化,但整体化学计量关系并不发生显著变化。此外,灰化苔草、南荻、芦苇、菰、水蓼、虉草、蒌蒿等是南矶湿地最优势的物种,其他物种多为群落伴生物种。进一步地分析发现这7个优势物种的平均C、N浓度与伴生种的C、N浓度差异显著(P<0.01),但C/N差异不显著。表明尽管受种间竞争影响,优势物种需要更多的C、N促进根系发育以保证在群落中的优势地位,但二者在C/N化学计量关系上保持相对一致。这很可能是鄱阳湖湿地植物群落在高动态水情变化下维持结构、功能与稳定性的重要机制之一。
4 结论
对鄱阳湖湖滨高滩地草甸植被带和低滩地湿沼生植被带的22种植物进行根系C、N的分级研究表明:根序、物种及其交互作用均显著影响根系全C、全N及其化学计量关系。全C、C/N随着根序的升高而增加,全N随根序升高而降低,在湿地植物根系周转及养分化学计量关系研究中引入根系分级十分必要。此外,研究区植物根系C/N化学计量关系的稳定性群体水平高于个体水平。
致谢:感谢中国科学院地理科学与资源研究所李亮博士和马泽清博士对植物根系分级给予的帮助。

