宫内感染与新生儿肺部感染性疾病的相关性
刘慧,汪丽
(陆军军医大学大坪医院儿科,重庆 400042 )
宫内感染对母胎均可产生影响,尤其是对胎儿和新生儿的影响巨大,一旦病原微生物进入胎儿黏膜即被模式识别受体识别,激活转录因子,引发局部炎症反应,甚至出现全身炎症反应,可导致胎死宫内、早产、感染、严重后遗症等,甚至新生儿死亡[1]。新生儿生后出现进行性加重的呼吸窘迫,进而发展为呼吸衰竭是引起新生儿死亡最常见的临床危重症。胎肺作为最易受损的脏器之一,宫内感染与生后新生儿肺部感染性疾病有重要关系。有研究报道,孕产妇羊膜腔感染发生率约为3.1%,母亲患有绒毛膜羊膜炎(chorioamnionitis,CA)的新生儿病死率是不患CA的2~3.5倍,新生儿生后呼吸窘迫、肺部感染、需要机械通气的发生率也显著升高[2]。新生儿肺部感染性疾病是新生儿感染的最常见形式及最主要的死亡原因,而与宫内感染有关的围生期感染性肺部疾病占新生儿肺部感染的大部分,各种炎症介质刺激将导致不同程度的肺组织受损,继而出现呼吸窘迫,甚至呼吸衰竭,但具体的发病机制尚不清楚[3-4]。现就宫内感染与新生儿肺部感染性疾病的相关性予以综述。
1 宫内感染
宫内感染通常指CA,是病原微生物进入羊膜腔引起羊水、胎膜(即羊膜、绒毛膜)、胎盘的感染,包括临床型和亚临床型。临床型CA表现为孕妇发热、白细胞升高、母亲或胎儿心动过速、子宫压痛、羊水恶臭等,但临床型CA仅占CA总数的10%左右,大部分CA是亚临床感染,即组织学CA[1,5];每10例胎膜完整的早产儿中就有1例合并有羊膜腔感染,且绝大多数为亚临床感染,仅凭临床表现难以识别[6]。因此,临床中常由于母亲为亚临床CA未及时察觉而未予以早期处理,胎儿长时间暴露在炎性环境中,这一类患儿出生后出现感染进行性加重,甚至发生包括呼吸衰竭在内的多器官功能衰竭等严重并发症。
引起宫内感染的途径包括:①下生殖道上行感染;②血源性;③羊膜腔穿刺、经皮采取脐带血、胎儿镜检查或其他侵入性操作;④从腹腔经输卵管逆行种植。其中经下生殖道上行感染是最常见的感染途径[1]。胎膜早破(premature rupture of membranes,PROM)后,病原微生物可上行感染至宫腔,刺激机体产生炎症反应,释放大量炎症因子。有研究表明,PROM时间长、羊水指数低(<5 cm)的孕妇,新生儿生后阿普加评分1 min及5 min更低,住院时间及插管时间更长,新生儿败血症发病率及新生儿病死率更高[7]。PROM作为引起宫内感染的重要原因[8],每年大约影响着150 000名的孕妇,约3%的孕妇有PROM,1/3的早产由PROM引起,其与孕产妇及新生儿的病死率有重要关系[9]。因此,在临床工作中,对于不明原因早产、PROM、保胎时间长等具有CA潜在可能性的产妇,应进行脐带、胎盘组织病理学检查。
羊膜腔感染后病原微生物可进一步向胎儿入侵,可通过羊水的流动进入胎儿的呼吸道(呼吸)、消化道(吞咽)、皮肤、结膜和耳内等[1],促发局部炎症反应,甚至可导致免疫系统、胸腺、心脏、肺、脑、消化道、皮肤等多脏器损伤[8,10-11],严重者可导致胎死宫内。宫内感染对新生儿的影响包括早发型败血症、新生儿肺部感染性疾病、新生儿坏死性小肠结肠炎、脑室内出血等。因此,有宫内感染高危因素的孕妇选择合适的分娩时机尤为重要。从理论上讲,期待治疗可延长胎龄,降低早产及新生儿病死率,但也存在相应的风险,如脐带脱垂、胎盘早剥、围生期感染、脐带压迫、胎儿死亡等。期待何时终止妊娠,一直是产儿科医师关注和争论的焦点。美国妇产科学会推荐:对于有明确分娩指征(如胎儿情况不乐观、临床型CA、重度胎盘早剥)的孕妇,应尽快终止妊娠;对于伴有PROM、无孕妇或胎儿禁忌证、胎龄<34周的孕妇,可考虑期待治疗;而对于伴有PROM、胎龄≥34周的孕妇进行期待治疗反而会增加感染的风险,推荐终止妊娠[12]。所以,对于有宫内感染高危因素的孕妇,应严密监测各项指标及胎儿情况,必要时终止妊娠。
2 宫内感染与新生儿肺部感染性疾病
病原微生物侵及胎儿或新生儿肺部后,将造成胎儿或新生儿肺组织不同程度受损,发生相应病理变化,最终导致新生儿出生后发生不同程度的肺部感染性疾病。据报道,因宫内感染导致的新生儿肺部感染性疾病发病率为58.5%,是新生儿肺部感染性疾病总发病率(14.6%)的4倍[11,13-14]。此外,患儿因严重呼吸道感染、呼吸衰竭而缺氧,支气管肺发不良、脑室内出血、脑室周围白质软化及脑瘫等的发生率也随之增加[14-15]。临床上最常见的新生儿肺部感染性疾病主要包括新生儿肺炎、新生儿急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)(胎粪吸入综合征归入新生儿ARDS)、新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)合并新生儿ARDS(常见于早产儿)。
2.1新生儿肺炎 新生儿肺炎在新生儿感染性疾病中最常见,也是引起新生儿死亡的主要原因之一,每年因新生儿肺炎死亡的儿童占全球5岁以下儿童因感染性疾病死亡的4%~9%[16]。常见临床表现为气促、呻吟、发绀、呼吸困难、体温不稳定;肺部体征多样,可为呼吸音粗、减弱或闻及湿啰音。新生儿肺炎包括先天性肺炎、早发型肺炎(出生1周内)和晚发型肺炎(出生后2~4周)。先天性肺炎主要是通过绒毛膜羊膜上行感染和经胎盘血源性感染,早发型肺炎主要是由于围生期病原微生物的暴露,包括宫内及分娩时。宫内感染与围生期感染性肺炎(生后1周内)有重要关系,CA是引起早发型感染的重要因素[3-4]。围生期感染性肺炎占新生儿肺炎的大部分,是最常见的新生儿肺炎,病死率高达5%~20%[4]。
胎儿通过呼吸将胎肺暴露于炎性环境中,病原微生物可直接与胎儿呼吸道黏膜接触,其后果可能导致出生后急性肺炎,严重者可发展为新生儿ARDS。有研究表明,伴有宫内感染的新生儿肺炎的发生率较对照组显著升高[14]。Latino等[17]对流产胎儿胎肺尸检发现,伴有肺炎的胎儿90.9%合并CA,证实了CA对胎肺早期持续性损伤。Hooven和Polin[3]在死胎肺及死于早发型肺炎的新生儿肺中发现了母源性白细胞及吸入的羊膜碎片。这一结论在宫内感染动物模型中也得到了证实,有研究发现,新生大鼠肺及胎肺组织中有大量炎症细胞浸润,肺泡泡囊结构及数目减少,肺泡间隔增厚,表面活性蛋白A、表面活性蛋白B及表面活性蛋白C表达下降,而白细胞介素(interleukin,IL)-1β、IL-6及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子呈高表达[18]。
2.2新生儿ARDS 传统观念认为,NRDS是导致患儿出现呼吸窘迫甚至呼吸衰竭的主要疾病,其病因是肺表面活性物质(pulmonary surfactant,PS)不足,主要见于早产儿,胎龄越小,发病率越高,而晚期早产儿和足月儿(胎龄≥34周)的发病率较低[19]。近年来,晚期早产儿/足月儿呼吸窘迫的发病率(>7%)显著上升[20],且具备不同于早产儿的呼吸窘迫综合征(respiratory distress syndrome,RDS)的临床特征,其病因、发病机制及防治办法受到新生儿科医师的广泛关注。
宫内感染是否会导致RDS的发生目前尚存在争议。一些学者认为,宫内感染对RDS具有保护作用,炎症因子刺激会诱导胎肺成熟,促进PS的合成、分泌,降低RDS的发病率[21-22]。但有学者认为,CA并不能促进胎肺成熟,反而会增加RDS的发病率[8,23]。推测这种不一致的结论可能是由于早期新生儿科医师对感染引起的呼吸窘迫与NRDS认识不足,将部分因感染所致的呼吸窘迫归为了NRDS。直到2017年新生儿ARDS蒙特勒诊断标准的提出,将先天性PS缺乏所导致的NRDS与感染等因素导致的新生儿ARDS进行了区分,在早期新生儿科医师将与RDS临床表现相似的疾病统统归因于原发性PS缺乏,事实上,新生儿ARDS和NRDS的病因及病理生理并不相同[24],这一争论在很长一段时间限制了新生儿科医师对新生儿ARDS的认识。新生儿ARDS和NRDS均可表现为进行性呼吸困难及严重低氧血症。各种肺内外因素均可引起新生儿ARDS的发生,如感染、窒息、胎粪吸入、呼吸机所致的肺损伤等[25],且常发生于晚期早产儿及足月儿[26],但与因早产、肺表面活性蛋白A/B基因突变、妊娠期糖尿病等有关的原发性PS分泌不足所致的NRDS不同,新生儿ARDS是由于各种原因(如胎粪吸入、先天性弥漫性肺炎等)促发了炎症反应,释放大量炎症因子,从而导致肺泡毛细血管内皮细胞损伤、肺泡毛细血管通透性增加、渗出性肺水肿形成,继而Ⅱ型肺泡上皮细胞受损、PS破坏/失活(继发性损伤)[27-28]。
新生儿ARDS是常见的临床危重症之一,其病死率为30%~40%[29]。有研究报道,约26.5%的ARDS患儿母亲合并CA/PROM[30]。宫内感染/CA作为引起新生儿ARDS的最常见病因之一,以形成大量肺部炎症反应和PS分解代谢为特征,进而导致不同程度的呼吸窘迫,甚至死亡[24]。肺水肿是ARDS主要肺组织病理学改变,肺水肿的发病机制主要包括肺液生成过多和肺液清除障碍两方面。大量临床和动物实验均表明,许多炎症因子(TNF-α、IL-1β、IL-8、IL-18、IL-33、IL-6、IL-10、中性粒细胞等)表达升高在ARDS的发病机制中扮演着重要角色[31-34]。这些炎症因子除可能介导炎症反应导致肺泡上皮细胞受损、坏死而减少PS的分泌和降低活性外,还可能通过增加肺泡内炎性渗出和影响肺液的清除而导致肺水肿的发生[35]。一方面,在呼吸道炎症反应作用下,肺泡毛细血管内皮细胞损伤,毛细血管通透性增加,蛋白渗出到肺泡,肺泡内炎性渗出过多,引起肺水肿;另一方面,为了避免肺水肿的发生,肺淋巴系统及上皮钠水通道可将血管外的水回泵,其中肺泡上皮细胞钠水转运系统中的α-上皮钠离子通道(α-epithelial sodium,α-ENaC)在肺液清除中发挥关键作用,任何影响α-ENaC表达量或活性的因素都可能通过影响肺液清除导致肺水肿的发生[32]。有研究报道,TNF-α等炎症因子可通过影响肺泡上皮钠通道中的α-ENaC表达或功能而在肺水肿的发生机制中发挥双重作用,一方面,炎症因子表达增加可下调α-ENaC在肺泡Ⅱ型上皮细胞中的表达,从而抑制肺液清除;另一方面,炎症因子表达抑制能够改变肺微血管床的结构而导致肺水肿的发生;通过对TNF-α构象进行深入剖析发现,TNF-α凝集素样区域可促进肺液吸收,而与之成对角关系的TNF-α受体结合位点可抑制肺液吸收[35]。在宫内感染影响新生儿肺液吸收最终导致肺水肿的发病机制中,哪些炎症因子发挥主要作用以及具体的调控机制目前尚不清楚。
ARDS病死率高,是致残、致死的主要原因之一,严重影响患儿的生命质量。因此,能协助早期预测及诊断ARDS的生物标志物对临床具有重要意义。近年来,炎症因子与ARDS发病的关系受到广泛关注,多种炎症介质对协助诊断和预测ARDS进展具有重要的指导意义。IL-6、IL-8和血栓调节蛋白升高的ARDS患者,机械通气时间显著延长,这些炎症因子与ARDS的不良结局有关[32]。一项荟萃分析显示,血浆TNF-α、IL-1β、IL-6、IL-8、IL-4和 IL-2等炎症因子与ARDS的病死率显著相关[36]。ARDS患者的支气管肺泡灌洗液中TNF-α、IL-1β、IL-6和IL-8水平也显著升高,且死亡者较存活者更高[32],预示这些炎性指标可协助诊断ARDS及预测预后。IL-17在急性肺损伤中也扮演着重要角色,并能预示疾病的进展及严重程度。研究发现,在ARDS患者及动物模型中,肺泡灌洗液及外周血IL-17水平显著升高,给予IL-17阻断剂能有效改善急性肺损伤的严重程度[37]。Phung等[38]发现,肺源性ARDS患者γ干扰素水平显著升高,死亡者较存活者升高显著,且不受病毒、细菌或真菌感染的影响,表明γ干扰素可预测ARDS致命性结果。部分炎性指标与ARDS的关系总结见表1。目前炎症因子与ARDS的相关性报道主要见于儿童及成人,而与新生儿ARDS的相关性研究报道较少。
2.3NRDS合并新生儿ARDS 新生儿ARDS的诊断不受胎龄及体重限制,早产儿亦可发生ARDS[24]。NRDS合并新生儿ARDS常见于早产儿,因胎龄小,在原发性PS缺乏的基础上,同时因宫内感染导致继发PS破坏/失活。国内有研究报道,极早期及早期早产儿(胎龄<32周)新生儿ARDS的发生率占全部新生儿ARDS的29.9%,且病死率较晚期早产儿及足月儿高[30]。这部分患儿大多可能合并NRDS,由于NRDS与ARDS的临床表现相似,对于此类患儿在早期诊断NRDS合并ARDS中仍存在一定困难。因此,在临床上对宫内感染产妇分娩的早产儿,出生后出现进行性加重的呼吸窘迫甚至呼吸衰竭,外源性PS治疗效果欠佳,不应单纯考虑NRDS,这类患儿往往同时合并新生儿ARDS,相对于单纯因PS缺乏所导致的NRDS,患儿治疗较困难,病死率也显著升高[30]。
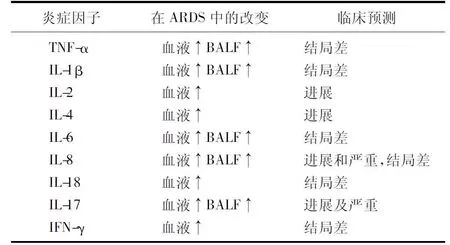
表1 炎症因子与ARDS的关系
3 小 结
宫内感染对胎儿/新生儿影响巨大,但绝大多数CA为亚临床型,仅凭临床表现难以识别。因此,对于不明原因早产、PROM等具有CA潜在风险的产妇,应进行胎盘组织病理学检查。宫内感染与新生儿肺部感染性疾病有重要关系,TNF-α、IL-6等促发的炎症反应可引起肺部一系列病理改变,继发PS破坏/失活,导致新生儿生后出现不同程度的呼吸窘迫甚至呼吸衰竭。多种炎症因子可协助早期预测及诊断ARDS,但目前就炎症因子与新生儿ARDS的相关性研究报道较少,尚待一系列基础和临床试验进一步探索。

