ROC曲线评估MRI联合血清NGAL、CA125诊断子宫内膜癌的价值分析*
1.陕西中医药大学第二附属医院妇科一病区 (陕西 咸阳 712000)
2.陕西中医药大学第二附属医院超声诊断科 (陕西 咸阳 712000)
王 莹1 高卫华1 赵春幸1吴参伟2
子宫内膜癌(endometrial carcinoma,EC)是原发于子宫内膜的上皮性恶性肿瘤,约占女性生殖系统恶性肿瘤的20%~30%,好发于围绝经期和绝经后期女性,其发病率位于全世界范围内常见恶性肿瘤的第七位,位居我国女性生殖道恶性肿瘤的第二位,仅次于宫颈癌,已成为威胁女性健康的重要疾病之一[1]。EC患者的预后与肿瘤分级、分期等病理特征关系密切,肿瘤分期越高,往往预后越差,患者生存率越低[2]。因此,早期诊断、正确分期是改善患者预后的关键,EC目前的常用的诊断方法是结合患者临床症状、体征、既往病史,通过MRI检查、糖类抗原125(carbohydrate antigen 125,CA125)检测、子宫内膜活检等方法来辅助诊断,最终以病理结果为确诊依据[3]。本研究拟探讨ROC曲线评估MRI联合血清中性粒细胞明胶酶相关脂质运载蛋白(neu-trophil gelatinase-associated lipocalin,NGAL)、CA125诊断EC的临床价值,现报告如下。
1 资料与方法
1.1 一般资料 选取2015年6月~2018年6月我院妇科接诊的65例EC患者为EC组,纳入标准:①符合EC的诊断标准[4];②首次确诊;③经术后病理证实为EC;④术前未接受过激素治疗、免疫治疗或放化疗;⑤术前均行盆腔MRI检查和血液检查;⑥临床、病理资料完整。排除有手术禁忌症、合并其他原发性恶性肿瘤者。患者年龄35~68岁,平均(49.72±7.38)岁;已绝经30例,未绝经35例。选取70例子宫内膜增生患者为良性组,年龄36~69岁,平均(50.65±7.48)岁。60例同期体检健康妇女作为对照组,各项检查均正常,无严重躯体疾病,年龄35~67岁,平均(50.21±7.33)岁;已绝经27例,未绝经33例。两组基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 MRI检查:选择GE Signa CV/i 1.5T MRI检查仪及盆腔线圈,扫描参数:层厚5mm,层间距1mm,矩阵256×256。先行常规平扫,包括横断面和矢状面自旋回波(SE)序列T1WI、快速自旋回波(FSE)序列T2WI。增强扫描对比剂钆喷替酸葡甲胺(Gd-DTPA),应用高压注射器经上肢静脉以2.5mL/s的流速注入,剂量为0.1mmol/Kg,行矢状面、横轴位动态增强脂肪抑制T1WI扫描。
1.2.2 标本采集及检测:采集对照组和EC组术前空腹外周静脉血3mL,4℃静置1h,3500r/min离心15min,分离血清,存于-80℃冰箱待测。采用酶联免疫吸附法检测血清NGAL、CA125水平,试剂盒购于上海瓦兰生物科技有限公司。
1.3 判定标准
1.3.1 血清NGAL、CA125水平判定标准:血清NGAL水平>190 pg/mL为阳性,血清CA125>35U/mL为阳性。
1.3.2 MRI评价:采用双盲法,由两名经验丰富的MRI医师独立完成阅片,分析EC的MRI表现。观察肿瘤部位、形态、内膜厚度、信号异常、肿瘤浸润肌层、宫颈基底膜是否完整、宫颈腺体/间质是否受侵、是否存在淋巴结转移或远处转移等,并参照FIGO分期标准于术前对所有病例进行影像评估。
1.3.3 联合应用:联合应用中任何一项结果为阳性即判定为阳性。
1.4 统计学分析 采用SPSS 20.0软件进行数据分析,服从正态分布的连续型资料以()表示,组间比较行成组t检验,非正态分布数据以M(P25,P75)表示,组间比较行非参数检验;分类资料以[n(%)]表示,组间比较行χ2检验,绘制MRI、NGAL、CA125单独应用与联合应用诊断EC的ROC曲线,计算曲线下面积(AUC),P<0.05表示差异有统计学意义。
2 结 果
2.1 术前MRI诊断与术后病理分期对照 术后病理诊断Ⅰa期41例,Ⅰb期12例,Ⅱ期4例,Ⅲ期7例,Ⅳ期1例;术前MRI诊断Ⅰa期43例,Ⅰb期9例,Ⅱ期7例,Ⅲ期4例,Ⅳ期2例,其诊断准确率为72.31%(47/65)。见表1。
2.2 EC组与对照组血清NGAL、CA125水平比较 EC组、良性组血清NGAL、CA125水平显著高于对照组(P<0.05),EC组血清NGAL、CA125水平显著高于良性组(P<0.05)。见表2。
2.3 MRI、NGAL、CA125单独应用与联合应用对EC的诊断价值 ROC曲线分析结果显示,三项联合应用诊断EC的曲线下面积(AUC)、灵敏度、特异度、准确率分别为0.963、96.88%、95.77%、96.30%,联合应用的AUC、灵敏度及准确率均高于三者单独应用。见表3。见图1。
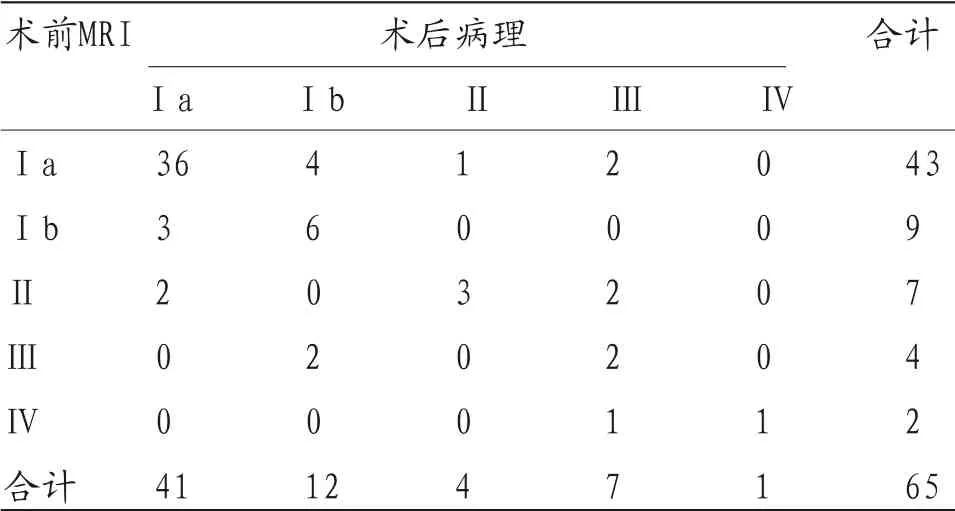
表1 术前MRI诊断与术后病理分期对照
表2 EC组与对照组血清NGAL、CA125水平比较()
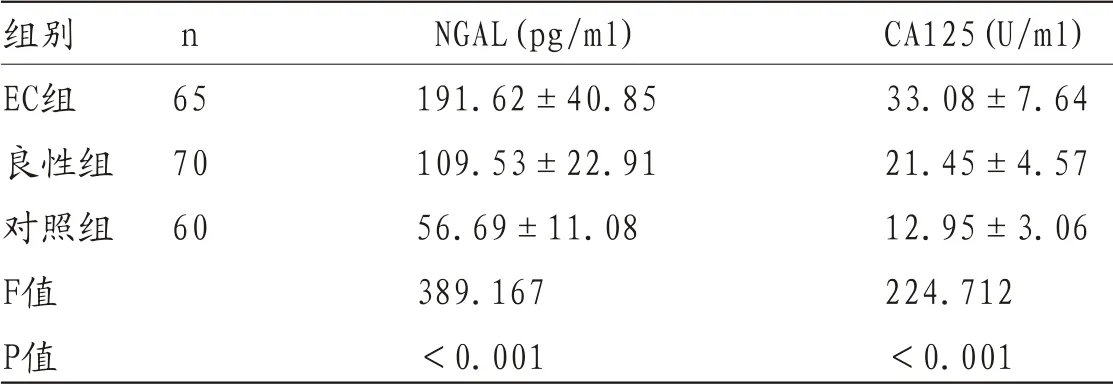
表2 EC组与对照组血清NGAL、CA125水平比较()
组别 n NGAL(pg/ml) CA125(U/ml)EC组 65 191.62±40.85 33.08±7.64良性组 70 109.53±22.91 21.45±4.57对照组 60 56.69±11.08 12.95±3.06 F值 389.167 224.712 P值 <0.001 <0.001
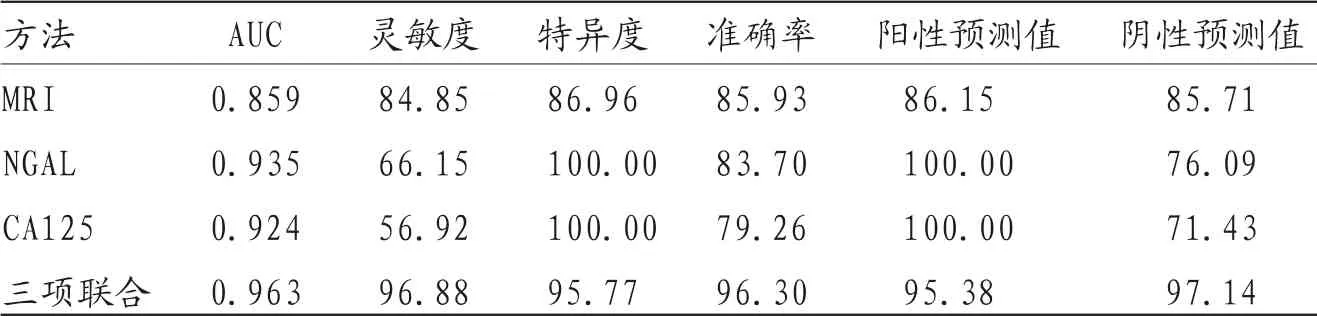
表3 MRI、NGAL、CA125单独应用与联合应用对EC的诊断价值
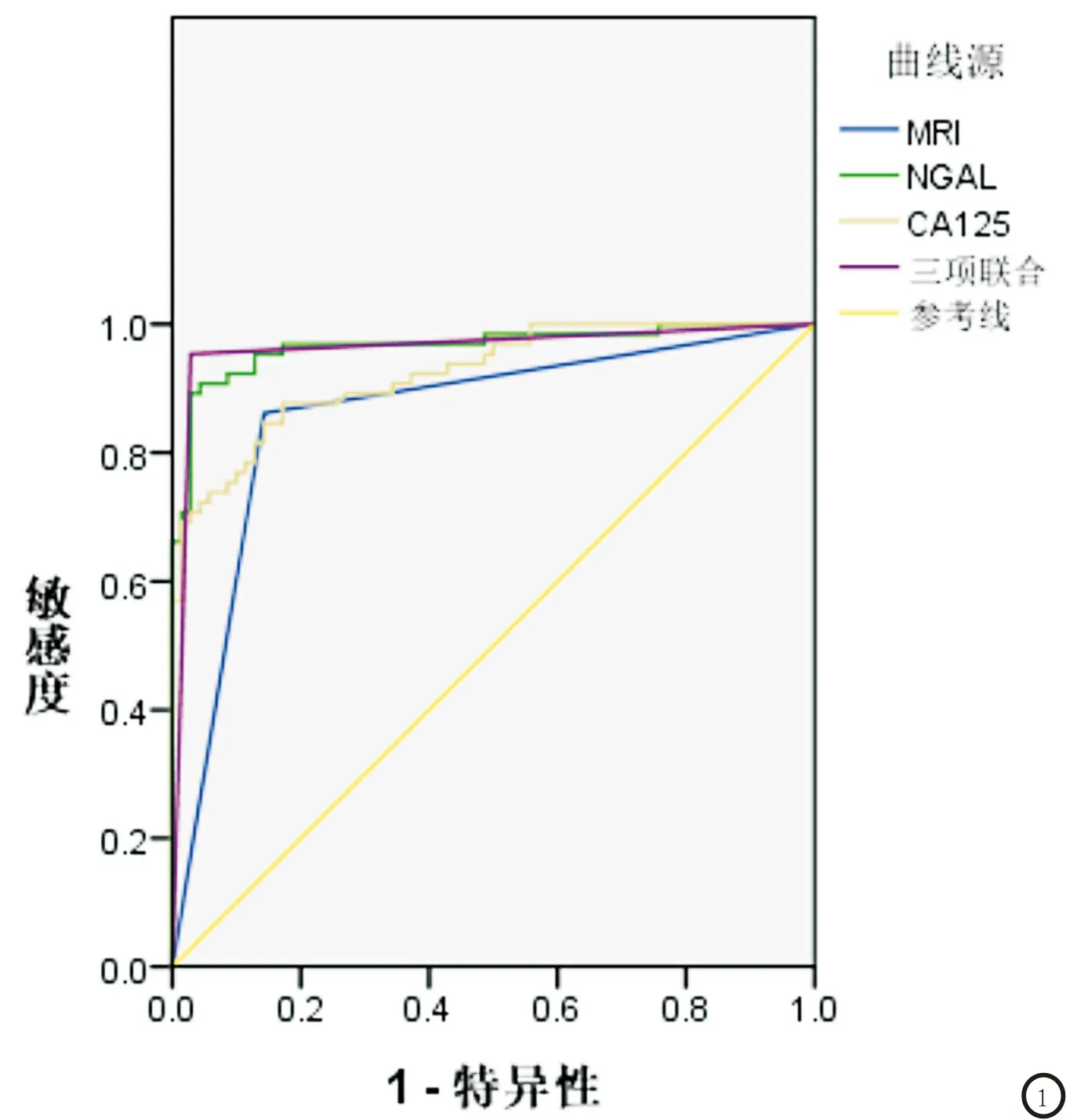
图1 MRI、NGAL、CA125单独应用与联合应用的ROC曲线
3 讨 论
EC是女性生殖系统恶性肿瘤,据统计,我国每年新发EC病例8.6万,每年死于EC的人数1.9万,其发病率在近几十年内明显上升,且呈年轻化趋势[5]。EC主要的临床症状为异常阴道流液和阴道出血,绝经后阴道出血者占65-70%,40岁以下年轻EC患者表现为月经紊乱或月经过多[6]。目前,临床中以宫颈管搔刮或分段诊刮术、子宫内膜活检,病理组织学检查为EC的确诊依据,应用宫腔镜检查、超声、MRI等方法辅助诊断[7]。影像学检查是简单便捷的无创性检查手段,被广泛应用于EC的术前筛查和术后随访中,但也存在漏诊率较高的弊端[8]。迄今为止,EC还未检测到特异性较高的肿瘤标志物,能否联合多种检测手段进行EC诊断和分期,为EC提供更准确的治疗方案,是我们一直以来想解决的。
MRI在评估EC肿瘤大小、宫颈有无受累、肌层浸润深度、有无淋巴结转移等方面具有明显优势,是目前评价EC有无肌层侵犯及侵犯深度最准确的技术,还能评价病变是否侵犯宫颈[9]。正常结合带局部中断是子宫肌层受侵犯最可靠的MRI征象;宫颈受侵犯表现为T2W1序列上稍高信号的病灶生长至宫颈管,或宫颈间质的低信号带被肿瘤破坏中断;宫外肿瘤浸润则表现为子宫肌层信号横贯性中断,浆膜面不规则及膀胱、直肠壁、阴道的肌层低信号中断[10]。大量研究证实,MRI是迄今为止认可度较高的EC诊断和分期影像学检查方法[11]。本研究结果显示,术前MRI诊断EC分期的准确率为72.31%,尤其对Ⅰ期EC的诊断准确率较高。
CA125是正常子宫内膜分泌的一种糖类抗原,是公认的肿瘤相关性抗原,是诊断上皮性卵巢癌最常用的指标之一,在EC患者血清中也表现为异常升高[12]。但1%的正常健康女性可出现血清CA125身高,3%良性卵巢疾病患者也会出现CA125身高,故CA125特异性较低、不能作为EC的单一诊断指标,常与其他指标联合应用[13]。NGAL是一种分泌性蛋白,多表达于支气管上皮、胰腺小导管等具有分泌功能的细胞,可以单体或同源二聚体的形式存在,也能与基质金属蛋白酶-9(MMP-9)形成MMP-9/NGAL复合体[14]。国内外研究发现,NGAL参与了肿瘤的发生、发展,其高表达与恶性肿瘤的增殖、迁移、侵袭有关,逐渐被用于恶性肿瘤的辅助诊断[15]。本研究中,EC组、良性组血清NGAL、CA125水平显著高于对照组,EC组血清NGAL、CA125水平显著高于良性组;ROC曲线分析结果显示,三项联合应用诊断EC的AUC、灵敏度及准确率均高于三者单独应用;提示三者联合应用能提高对EC的诊断价值。
综上所述,肿瘤的发生、发展是一个非常复杂的病理过程,与NGAL、CA125的表达可能密切相关,MRI诊断EC的准确率较高,与血清NGAL、CA125联合应用有助于提高EC诊断的灵敏度和准确率,有助于临床医师制定更准确的治疗方案。

