ADIPOQ基因调控猪脂肪沉积的研究进展
程 娜,赵桂英
(云南农业大学动物科学技术学院,云南 昆明 650201)
我国是全球最大的猪肉生产及消费国,据2014年美国农业部(USDA)统计,我国猪肉消费总量占世界的50%以上。近年来随着人们生活质量的提高,对猪肉品质的要求也有很大程度的改变。猪肉品质受非常多的因素影响,遗传和营养这两大因素对肉质的作用最为明显[1]。当猪肉肌肉内含2%~3%脂肪含量时,肌肉呈现大理石花纹,并且肌间脂肪与肉质口感呈正相关[2],所以控制猪脂肪沉积,提高猪肉口感以满足消费者需求成为当前待解决的问题。已知脂肪酸结合蛋白(FABPs)基因、脂蛋白脂肪酶(LPL)基因、激素敏感脂肪酶(HSL)基因、黑素皮质素4受体(MC4R)、肥胖相关基因(FTO)以及瘦蛋白(OB)基因这几类基因对猪的脂肪沉积具有明显作用[3-5]。随着分子生物学的不断深入,科研人员希望从育种的角度找到更多影响脂肪沉积的基因,从而选育出更符合现代人们对猪肉营养与口感的双重要求。
脂联素(Adiponectin)是由Scherer等首次在小鼠脂肪组织中发现并将其命名为脂肪细胞补体相关蛋白[6],在其他研究成果中也被称为ADIPOQ、GBP28、apM1、ACRP30和ADPN。ADIPOQ是由脂肪组织特异性分泌的并且具有生物活性的激素,连同抵抗素(RSTN)、瘦素(LP)、白细胞介素(IL-6)、肿瘤坏死因子(TNF)、酰化刺激蛋白(ASP)、纤溶酶原激活物抑制剂(PAI)和血管紧缩素原(AGT)统称为脂肪细胞因子。ADIPOQ除了由脂肪细胞分泌外,还可以由肝实质细胞、肌细胞、上皮细胞、成骨细胞等分泌[7]。ADIPOQ是一种对肥胖成负性调节的脂肪特异性蛋白质,主要与ADIPOQ受体1(AdipoR1)、受体2(AdipoR2)和T-黏钙蛋白结合发挥作用,当动物机体过度沉积脂肪时,ADIPOQ基因的表达量以及血液中ADIPOQ水平都会相应下降[8]。
1 ADIPOQ基因结构
ADIPOQ基因在人体内属于单拷贝基因,包含2个外显子和2个内含子[9],全长约为17 kb,其拷贝DNA序列长为732 bp,共可编码244个氨基酸[10]。人的ADIPOQ基因包括一个NH2终末端高度可变区,接着是胶原螺旋区和一个羧基终末C1q样的球状结构域。在循环中,ADIPOQ形成低分子量的三聚体(67 kDa)、六聚体(140 kDa)以及一个至少由18个单体组成的高分子(300 kDa),另外由球状结构组成的较小形式的ADIPOQ也存在于血液中,其含量可以忽略不计。猪的ADIPOQ基因定位于第13号染色体上[11],与人的ADIPOQ基因存在两个氨基酸的差别,共可编码242个氨基酸(见图1)。
2 ADIPOQ基因对脂肪代谢的调控
ADIPOQ在调节脂肪代谢中有重要意义,主要通过与受体结合,作用于靶组织而发挥生物学作用。ADIPOQ受体1(AdipoR1)认为与球状区域的ADIPOQ优先结合,是球形脂联素的高亲和受体及全长脂联素的低亲和受体,多数在骨骼肌细胞表达,通过腺苷酸活化蛋白激酶(AMPK)和丝裂原活化蛋白激酶(MAPK)通路发挥作用。受体2(AdipoR2)与全长脂联素结合,主要在肝细胞表达,通过过氧化物酶体增殖物激活受体(PPARα)通路发挥作用。T-钙黏素主要是与心脏、肌肉和血管等组织里的ADIPOQ结合调节机体,通常在内皮细胞及平滑肌中表达。
2.1 ADIPOQ对AMPK的调节
腺苷酸活化蛋白激酶(AMPK)是AMP依赖的蛋白激酶,以一种异源三聚体复合物的形式存在。AMPK通过调节葡萄糖平衡、脂肪酸氧化分解等调节机体能量稳态。ADIPOQ主要通过增加细胞内AMPK浓度进而起到调节作用,目前人们尚未探究到它的具体机制,目前猜测是AMPK浓度升高后与腺嘌呤核苷酸活性或线粒体解偶联有关。AMPK作为一种重要的蛋白激酶是机体内代谢调节的关键分子,被称为状态传导器,机体内AMP/ATP的值升高时AMPK将被激活。Tomas等[13]通过ADIPOQ作用于大鼠的趾长伸肌发现ADIPOQ可使AMPK的活性大幅度提升,且ACC磷酸化水平也增强。一般情况下,ADIPOQ可使AMPK活性域内172位的苏氨酸残基磷酸化来激活AMPK信号转导,进而使线粒体内脂肪酸的氧化提高。AMPK一定程度上是作为p38-AMPK上游的激活激酶,但在ADIPOQ活化p38-AMPK信号过程中的具体作用仍需深入探究。
2.2 ADIPOQ对PPARα的调节
过氧化物酶体增殖物激活受体(PPARα)通过提高脂蛋白脂酶基因的表达水平,从而促进甘油三酯水解为甘油和脂肪酸,也可提高动物体内脂肪酸的跨膜转运。有实验证实如果小鼠体内缺乏PPARα,那么其血清中的自由脂肪酸含量也会升高。Tabandeh等[14]发现ADIPOQ受体1、受体2的蛋白质水平在人参皂苷Rb1激活ADIPOQ信号转导的过程中明显增高,这可能与PPARα的参与有一定关系。Yamauchi等[15]通过ADIPOQ干预C2C12细胞得到相似的结果,即PPARα的活性明显提高,脂肪酸的氧化分解和葡萄糖摄取利用也显著提升。Barger等[16]通过对原代乳鼠心肌细胞的提取实验,从而得出p38-MAPK使PPARα发挥作用的重要机制,主要是磷酸化PPARα的N-末端丝氨酸的残基,PPARα可作为p38-MAPK通路下游一种极其重要的转导因子。Yamauchi等[17]以肥胖自发突变的纯合小鼠为实验对象,用Apo-E基因敲除小鼠,发现控制PPARα的效能可以减少脂肪细胞发生肥大的概率。而且下调肿瘤坏死因子(TNF)、抵抗素及游离脂肪酸(FFA),同时上调ADIPOQ及瘦素(Leptin)可使肝脏和肌肉组织中的甘油三酯水平下降,这可以很大程度上缓解机体对胰岛素抵抗作用。Chedid等[18]在研究脂联素调控巨噬细胞氧化反应的实验中,用特定的沉默细胞干扰AdipoR1使其不能发挥作用,结果显示gAcrp30依赖的PPAR-A活性明显降低,葡萄糖的利用脂肪酸的氧化增加,ADIPOQ依赖的这种效应无明显变化。当同时抑制AdipoR1和AdipoR2时,ADIPOQ以及gAcrp30依赖的PPARα活性、脂肪酸的氧化及葡萄糖的利用都将被消除。可以看出,PPARα是在脂联素信号通路中作为一种重要的介导因子。ADIPOQ依赖的脂肪酸氧化及葡萄糖利用可以被p38MAPK抑制物DN-AMPK抑制,同样SB203580作为一种竞争性的抑制剂也可以选择性的阻断上述过程[19]。如果使C2C12肌细胞内的AdipoR1表达作用增强,那么脂肪酸的氧化及葡萄糖的利用也相应提高。在这个反应中,DN-AMPK与SB203580也可以起到抑制作用。综上所述,ADIPOQ可能通过活化PPARα途径发挥减少脂肪沉积等效应。
3 ADIPOQ基因对猪脂肪沉积的影响
近些年,国内外众多学者对猪脂联素基因的表达量和多态性位点进行了关联分析,阐述了ADIPOQ影响脂肪沉积的作用机理与机制。
3.1 表达量不同对猪脂肪沉积的影响
李祥[20]采用荧光定量技术,检测了荣昌猪和长白猪体内的ADIPOQ基因在其脂肪和肌肉组织中的表达变化,分析了表达量的差异对脂肪沉积性状的影响。结果显示:荣昌公猪除背最长肌以外的九种组织基因表达量均高于荣昌母猪,ADIPOQ基因的表达量和腹部皮下脂肪差异极显著,与背部皮下内层脂肪基因差异显著。陈其美[21]采用实时荧光定量PCR技术,以体重均为114 kg的莱芜猪、鲁莱黑猪和大白猪各12头去势公猪为实验对象,研究了ADIPOQ基因在这3个猪种的背最长肌、背膘以及肝脏中的表达差异,并与肌内脂肪(IMF)和背膘厚(BFT)进行关联分析,结果显示:鲁莱黑猪和莱芜猪的背膘、背最长肌和肝脏3个组织中,除背最长肌外,ADIPOQ基因在其他两个组织中的表达量均小于长白猪。Cirera[22]等在哥本哈根大学动物研究所饲养杜洛克与约克夏猪至体重220 kg屠宰,测定背最长肌、背部脂肪、肝脏3个组织中ADIPOQ基因的表达量,结果显示:两个猪种间3个组织的ADIPOQ基因表达量无显差异但杜洛克猪略高于约克夏猪(表1是综合AdipoQ基因表达量差异对脂肪沉积的影响)。
3.2 ADIPOQ基因的发育差异对脂肪沉积的影响
ADIPOQ基因的表达会随着猪的不同生长阶段发生变化,进而对猪脂肪沉积产生影响。苗志国等[23]以45日龄、135日龄和的180日龄健康生长的长白猪和淮南猪为实验对象,对其体内血清中的ADIPOQ含量和肌肉脂肪含量进行了检测。结果表明:同种猪日龄越大肌内脂肪含量越多,两个猪种均以180日龄时表现出高脂肪沉积能力。不同品种不同日龄的淮南猪肌肉脂肪含量明显高于长白猪。研究同一品种猪ADIPOQ基因的表达量可以减少猪种差异对猪ADIPOQ基因表达量的影响,进一步阐述ADIPOQ基因影响猪脂肪沉积的作用机理。
3.3 ADIPOQ基因多态性位点对脂肪沉积的影响
基因多态性现象在生物群体中非常常见,是指在一个群体中,同时或经常存在两种及其以上的变异类型或基因型并存的现象,且每种变异类型的频率要大于1%,也称为遗传多态性。从分子生物学角度来讲,遗传多态性就是一种孟德尔单基因遗传性状,其原因为同一群体同一基因位点上有多种等位基因。对于个体而言,其碱基顺序不发生改变,并且世代遵循孟德尔遗传规律,但如果有同义和异义突变发生在编码区,则相关性状可能发生改变。罗琴等[24]利用PCR-SSCP技术,以陆川猪、广西巴马小型猪、杜洛克猪、长白猪和大约克猪为对比研究对象,检测了5个品种ADIPOQ基因两个内含子的多态性。结果显示:内含子2内出现AG、GG和AA 3种基因型。其中,大约克猪和长白猪只含有A等位基因型;而以G等位基因作为优势基因的陆川猪和广西巴马小型猪3种基因型都含有。凌飞等[25]利用PCR-RFLP基因分型方法对大白猪、长白猪、杜洛克猪、蓝塘猪和大花白猪5个品种猪的ADIPOQ基因启动子区的多态性进行了检测分析。发现ADIPOQ基因的5′侧翼区1 010 bp存在(GA)的单核苷酸多态性位点,并且GG基因频率本地猪种要显著高于引进猪种;在394 bp处蓝塘猪和大花白猪的基因型分布较为多样,引进猪种没测出CC基因型,T等位基因频率较高。结果表明:该基因转录水平的改变可能是由于ADIPOQ基因上游1 010 bp(G/A)的单核苷酸多态性位点突变导致的,而猪体内脂肪沉积与394 bp(T/C)的单核苷酸多态性位点可能无关。Zhang等[26]检测了400头三元杂交猪ADIPOQ基因的单核苷酸多态性位点,并把检测结果与肌肉的多汁性、滴水损失、肉色、剪切力、蒸煮损失、味道和总体评分7个性状进行了关联分析,结果表明:三元杂交猪的ADIPOQ基因对肌肉的剪切力、味道和总体评分3个性状有明显作用,因为导致肌肉风味不同的主要原因是脂肪内所含挥发性脂肪酸,所以这很可能是由于ADIPOQ基因影响了肌间脂肪的沉积所导致的结果。吴芸等[27]利用PCR及测序技术对30头剑白香猪和三元杂种猪ADIPOQ基因进行了检测。结果表明:三元杂种猪178位点和1 165位点发生A/G碱基间的替换,且在两个位点都表现出多态性;剑白香猪178位点发生在第2外显子内, 基因型只有AA型,在1 165位点只有dd型。综上所述,ADIPOQ基因在许多猪种中存在着单核苷酸多态性位点,但是与脂肪沉积相关性状进行关联分析的较少,有待进一步研究。
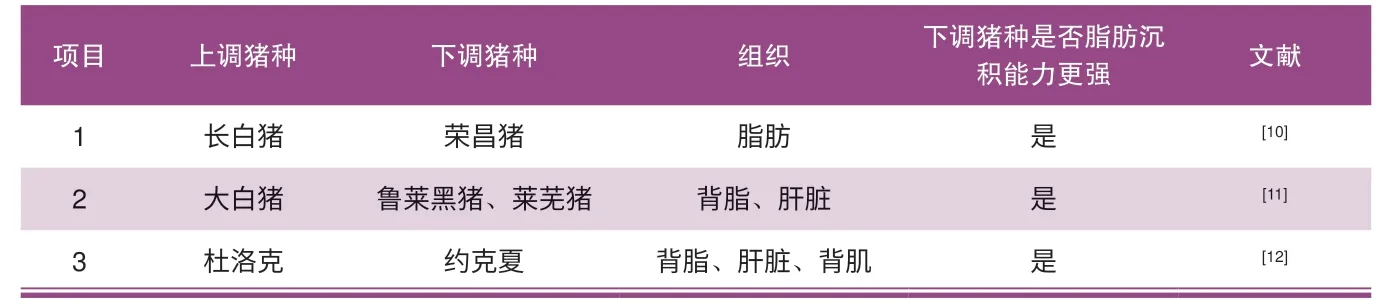
表1 AdipoQ基因表达量差异对脂肪沉积的影响
3.4 ADIPOQ基因甲基化对脂肪沉积的影响
为了更深入探究ADIPOQ基因的表达调控,凌飞等[28]采用实时荧光定量PCR技术与甲基化特异性PCR技术检测了蓝塘猪和长白猪的ADIPOQ基因的表达及其对启动子区的甲基化状况进行了分析。结果显示: 在骨骼肌中长白猪与蓝塘猪ADIPOQ基因的表达存在差异,具体为蓝塘猪随日龄增长脂肪沉积逐渐增加,长白猪脂肪沉积在发育前期增加较快,成年期反而降低。90日龄时,长白猪83%去甲基化,蓝塘猪明显少于长白猪仅有33%去甲基化;成年时蓝塘猪全部高度甲基化,长白猪有1/3去甲基化。ADIPOQ基因在肌肉组织中以高度甲基化状态为主这一结果与该基因在肌肉组织中表达量相吻合,同时也证实了ADIPOQ基因确实可以影响猪脂肪的沉积。
4 总结与展望
ADIPOQ通过与受体AdipoR1和AdipoR2结合来发挥作用,主要是促进脂肪酸氧化分解,降低脂肪及类脂合成,从而调节动物机体脂代谢。动物的品种、不同的生长期与组织部位以及生理条件等都会影响ADIPOQ对脂代谢的调节,进而影响动物机体内的脂肪沉积。目前ADIPOQ基因对动物机体脂代谢调控的分子机制已有大量的研究,但还有很多问题需要进一步深入探究

