肝细胞癌癌前病变的诊断和治疗多学科专家共识(2020版)
《中华肝脏病杂志》编辑委员会, 中华医学会肝病学分会肝癌学组
近年来,我国癌症发病率和死亡率总体仍呈上升趋势。在癌症诊疗的历程中,临床和基础研究均认识到癌前病变的诊断及早期治疗的重要性。比如慢性萎缩性胃炎、子宫颈慢性炎症、结直肠多发性腺瘤性息肉和乳腺囊性增生病等癌前病变的确立,以及规范而有效的干预措施,对降低部分癌症的发病率起到了显著的作用[1-3]。我国是肝病发病率较高的国家,有上亿的人群罹患肝脏疾病。每年因肝炎、肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)导致死亡的病例达数十万之多。我国HCC的发生过程大多遵循“乙型肝炎—肝硬化—肝癌的三部曲”模式。由于起病隐匿,大多数病例发现时已届晚期,失去了外科根治的机会。因此,肝癌的五年总生存率目前仅为12.1%,名列17种常见恶性肿瘤总生存率的倒数第二位[4]。统计数据表明我国每年的HCC发病率和病死率非常相近,这表明现有的诊疗策略和措施对降低HCC的五年总死亡率非常有限,因此探索新的HCC诊疗策略极其迫切。借鉴其他肿瘤对癌前病变诊疗的成功经验,我们邀请了国内肝病内科、感染病、肝脏外科、影像诊断和病理学领域的知名专家共同研讨,提出了HCC诊疗策略前移的设想。经专家组查阅国内外大量文献并结合临床实践经验反复研究,对HCC癌前病变的概念、临床诊断标准、筛查、治疗和随访等给出了初步的界定和建议。由于目前该领域的临床和基础研究成果尚不够充分,该共识的制定在我国还是一个探索性和阶段性的工作,仍有待于将来参照新的研究成果逐步补充和完善。
1 HCC癌前病变的定义
癌前病变的概念最早由Reed教授于1948年提出,随着研究的深入,其定义为某些比正常黏膜或其他良性病变更容易发生癌变的病理学变化,包括上皮内出现细胞形态分化异常和组织结构异型性的病变,这种病变以后可能会在不同程度上发展成侵袭性癌[5]。近年来,美国国立卫生研究所(NIH)制定了癌前病变的五条标准,内容如下:(1)该癌前病变与相应的癌发生率增高有关;(2)当癌前病变进展到癌时,所发生的癌应产生于该癌前病变中的细胞;(3)癌前病变应不同于其发生的正常组织;(4)癌前病变与相应的癌在分子和表型特征上有部分相似,但又有明显区别;(5)该癌前病变应有一种方法可以诊断[6]。
我国HCC的发生大多基于慢性乙型肝炎相关肝硬化的基础之上。肝脏异型增生结节(dysplastic nodules,DN)常在肝硬化的背景下发生,根据细胞的异型程度可分为低度异型增生结节(low-grade dysplastic nodules,LGDN)和高度异型增生结节(high-grade dysplastic nodules,HGDN)。HGDN 可以 “结节内结节”的方式进展为HCC[7]。从DN到早期HCC是一个多步骤的渐进过程,一项随访研究显示有HGDN的患者发展为HCC的危险性较无HGDN患者高4倍。而LGDN发展为恶性的几率则明显较HGDN低。HGDN虽无确切的恶性组织学依据,却具有明显的结构异型性和细胞异型性,因而通常被认为是HCC的癌前病变。肝硬化结节患者的自然病程随访结果表明其1、2、3和5年的恶性转化率分别为3.5%、15.5%、31%和 48.5%,其中HGDN是恶性转化的独立危险因素[8]。目前病理学上对HCC癌前病变的认识通常为:在慢性乙型肝炎等肝病背景下,肝组织出现一定的组织结构和细胞形态上的异型性,形成具有潜在恶变风险的异型增生结节,常见病理类型包括LGDN和HGDN,两者的恶变风险依次增加。此外,糖原贮积病相关肝细胞腺瘤和(非)酒精性脂肪性肝炎相关肝硬化等病变也有发生HCC的报道,因而通常也被视为HCC癌前风险病变,需要引起高度重视[9]。
2 HCC癌前病变的筛查
早期发现HCC癌前病变,是患者阻断其发生和获得根治可能的关键。筛查有助于HCC癌前病变的早发现、早诊断和早治疗,对提高HCC的整体疗效将起到积极的作用。
2.1 筛查人群 流行病学调查显示我国HCC大部分发生于有乙型肝炎病毒(hepatitis B virus,HBV)感染的人群,因此建议对于HBV感染,年龄≥20岁,有肝硬化表现的人群应当定期筛查[10]。对HCC风险人群,应当进行分层认定,根据不同的风险采用不同的筛查手段。特别对于HCC高风险人群,应当及早开始筛查工作,包括:慢性乙型、丙型肝炎患者及病毒携带者,40岁以上男性或50岁以上女性,有长期酗酒和糖尿病者,有肝硬化者,有HCC家族史者。
2.2 筛查方法 首先通过病史回顾的方式确立高风险人群,对高风险人群发现直径≤2 cm的肝内结节或病灶,推荐行超声造影及肝胆特异性对比剂钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriaminepentaacetic acid,Gd-EOB-DTPA)增强MRI。尤其是EOB-MRI对于鉴别LGDN、HGDN和早期HCC具有重要的临床价值。当然,肝内结节的活组织病理学检查仍然是HGDN诊断的金标准,但检查前需评估血小板、凝血象和腹水等临床指标。
2.3 筛查流程 初筛应针对所有HBV感染的成年人,通过病史调查确立高危人群,初筛后人群可采用较为经济易行的方法。如无肝内结节及病灶,腹部彩色超声定期半年筛查;对发现肝内结节的患者再行超声造影及EOB-MRI检查,对无法确定病变性质,但高度怀疑肝癌患者,可考虑行肝穿刺活组织学检查(肝活检)进一步明确诊断。对于再生结节(regenerative nodule,RN)和LDGN患者建议筛查时间为3~6个月,目的是监测其大小的变化和影像学特征的改变,且6个月左右应做一次EOB-MRI检查[11]。
3 HCC癌前病变的诊断
由于HCC癌前病变的直径多小于2 cm,目前早期诊断仍然较困难,临床上术前缺乏可靠的检测手段及依据,实际的检出率较低,大部分多在术后切除标本中明确。目前HCC癌前病变的诊断主要依靠影像学、病理学及分子诊断学技术。
3.1 病理诊断
病理学仍然是诊断HCC癌前病变的金标准。临床上术前病理诊断的意义重大,但受肝活检局限性的影响,术前病理组织的获取较为困难。因此对于高危人群,发现可疑病灶,但影像学技术均难以鉴别,且AFP未达到临床诊断HCC标准的人群,建议行肝活检做出病理诊断。但需要注意的是:(1)粗针穿刺肝活检的阳性诊断率要明显高于细针穿刺抽吸肝活检;(2)由于增生结节的内部病变在分布上存在异质性,因此当肝活检诊断为阴性时则不能完全排除临床诊断,仍需密切随访或适时再次肝活检;(3)当肝内出现多发结节性病灶时,其中一个结节的病理诊断并不能反映或代替其他结节的病变性质和演变阶段。
HCC癌前病变的病理学特点主要来自于术后切除标本的病理分析,主要有以下几种表现,根据以下特点可对癌前病变做出相应临床病理诊断[12]。
3.1.1 异型增生灶(dysplastic foci,DF) 在显微镜下发现的小于1 mm 的异型肝细胞病灶,主要由小细胞样改变和铁染色阴性的肝细胞团构成。
3.1.2 异型增生结节(dysplastic nodules,DN) 与周围肝组织在形状、颜色和质地上有所不同,结节大小多在数毫米至2 cm以内,可以是单个或多个结节。DN通常出现在具有肝硬化背景的肝组织内,包括LGDN和HGDN。
(1)LGDN:以大细胞异型增生(large cell dysplasia,LCD)成分为主,排列密度轻度增加(<1.3倍),轻度异型性,存在汇管区结构,无孤立性小动脉和假腺管,组织学上因实际鉴别诊断困难,因而通常将肝硬化大再生结节归纳到LGDN。一般认为LGDN 具有低度恶变风险。但有学者发现LGDN的动态网络生物标志物(DNB)模型得分显著高于肝硬化、HGDN和早期肝细胞癌(eHCC)阶段,因此认为LGDN是肝硬化向HGDN演变进程中的基因变异转折点。
(2)HGDN:以小细胞异型增生(small cell dysplasia,SCD)成分为主,有中-重度的细胞异型性和结构异型性,排列密度增加(高于周围肝组织1.3~2倍以上),可见少许孤立性动脉,伴有膨胀性生长,发生局部癌变时称为结节内结节。HGDN具有高度癌变风险,有研究[13]显示,LGDN和HGDN的恶变风险比(HR)分别为2.96和16.8。
3.1.3 HGDN与eHCC的病理鉴别诊断 HGND和 eHCC之间鉴别诊断的病理参数主要包括细胞形态、异型程度、细胞密度、肝窦毛细血管化、孤立性小动脉、假腺管结构、网状支架完整性以及间质浸润等。需要指出的是,对HGDN与eHCC的组织病理学特征的理解和掌握与病理医师的认识和经验有关,带有一定的主观性。如西方病理学家诊断的HGDN常被日本病理学家诊断为分化好的eHCC,因而特别需要注意在实践中积累肝脏专科病理诊断经验[14]。
3.1.4 免疫组织化学诊断与鉴别诊断 对于常规病理切片下难以明确病变性质时,需要借助免疫组织化学(免疫组化)进行诊断和鉴别诊断。磷脂酰肌醇蛋白聚糖-3(Glypican-3,GPC-3)是一种细胞表面硫酸肝素蛋白多糖,在正常肝细胞中不表达,在大多数HCC中过表达。有研究显示,当HGDN发生癌变时GPC-3的表达会相应增强,因而是HGDN癌变风险的一个预警信号。热休克蛋白(HSP)70是热休克蛋白家族中的重要成员,在正常肝细胞中阴性表达,在大多数HCC中过表达。谷氨酰胺合成酶(GS)是位于小叶中心区域肝细胞的主要能量来源,在HCC细胞中呈弥漫强阳性表达。有研究[15]显示,GPC-3+HSP70+GS联合诊断,其中任何两种标志物阳性对诊断HCC的敏感度和特异度分别为72%和100%。Jin等[16]提出,SUOX+AKR1B10+CD34标志物组合对高分化HCC诊断的敏感度和特异度分别为93.8%和 95.2%,有助于对HGDN的鉴别。
CD34免疫组化染色在鉴别肝细胞性肿瘤的性质中也很有帮助。在从LGDN-HGDN-eHCC的多阶段发生和发展过程中,肝窦内皮毛细血管化的程度及CD34染色的强度逐渐增加,从DN的局灶或斑片状毛细血管分布特点直至eHCC出现弥漫均匀的微血管分布特征[17]。中国《原发性肝癌规范化病理诊断指南(2015年版)》[18]提出了CD34+GPC-3+GS+HSP70的免疫组化诊断标志物谱推荐方案,对于肝细胞性良恶性肿瘤具有很好的辅助诊断价值。
Llovet等[19]通过RT-PCR方法对伴有肝硬化患者的异型增生结节和eHCC的候选基因转录谱进行筛选,发现12个基因在eHCC中表达有显著差异性。Luo等[20]发现,在LGDN-eHCC的发展过程中,白血病抑制因子受体(LIFR)表达降低,CD34表达增强,LIFR和CD34联合检测对eHCC的敏感度和特异度分别为93.5%和90.5%。端粒酶逆转录酶(TERT)启动子突变频率在LGDN(6%)、HGDN(19%)、eHCC(61%)逐渐升高,可作为一种预测癌前病变转化风险的标志物。上述研究为将来对HCC癌前病变的分子诊断做了有益的探索。
3.2 影像诊断
在缺少病理标本的现状下,影像学检查是临床诊断HCC癌前病变的主要方法,包括腹部彩色超声、超声造影(CEUS)、计算机断层成像(computed tomography,CT)及磁共振成像(magnetic resonance imaging, MRI),近年国内外已积累了较多的相关经验。
3.2.1 常规超声 主要作为筛查方法,可观察结节大小、回声强度、回声是否均匀等情况,癌前病变可表现为肝脏内低回声或高回声结节,与早期HCC难以鉴别。
3.2.2 超声造影(CEUS) CEUS可观察常规超声显示的内容,另可根据造影后血管增强模式的改变,进一步区分LGDN、HGDN 和HCC。在造影剂注入后,LGDN主要以“慢进等出”增强模式为主,多表现为等增强。HGDN表现多样,可以表现为持续低增强,也可表现为早期动脉相低增强,随后等增强,还可以表现为动脉相高增强,门静脉相和(或)延迟相轻度低增强,与早期HCC的超声造影表现类似。CEUS获取的TIC曲线形态与结节病灶内的血管数量、组织结构和分布特点等有一定关系,HCC表现为“快进快出”型,而DN主要表现为“慢进慢出”型[21]。
3.2.3 X线计算机断层成像 CT虽是诊断HCC的常规方法,但在HGDN的诊断上较为困难,在一些报道中敏感度仅为10%。组织学上DNs可能比背景肝含有更多的铜和(或)铁,动脉血供少,在CT平扫和多期增强上相对于周围肝实质呈等密度。通常HGDN在CT平扫中可表现为稍低或等密度的结节,其密度较均匀,边界欠清,增强扫描动脉期、门静脉期无明显强化,延迟期轻度强化,程度接近或稍低于周围肝实质。少数HGDN因肝动脉供血,动脉期即出现明显强化,表现和富血供HCC相类似。经动脉门静脉造影CT(CTAP)和肝动脉造影CT(CTHA)可以检测到肝癌早期改变,但因其为侵入性检查方法,且受设备限制,目前国内不常采用[22-24]。
3.2.4 磁共振成像(MRI) 与CT相比,MRI无辐射,软组织对比分辨率高,多参数、多方位成像,常规序列之外的多种技术如动态增强动脉三期扫描,动脉期同层减影技术,弥散加权成像(DWI),磁敏感加权成像(SWI)等的综合应用,被认为是诊断和鉴别诊断DN相对敏感的影像学检查方法。因结节内含铁、铜、锌、糖原、脂肪,增强前信号多变,T1WI常呈稍高信号,T2WI呈等或低信号;当病灶内铁含量较多时,T1WI、T2WI均呈低信号;病灶内富含脂肪时,T1WI呈高信号,反相位信号丢失。与HCC相比,DN细胞密度低,类似周围肝实质,DWI呈等信号,可因局部活动性纤维化或梗塞呈轻微高信号。从RN、LGDN、HGDN发展到eHCC和HCC的过程中,门静脉供血逐步下降,动脉供血逐步增加,且孤立动脉占动脉总数的比例也逐步增加。LGDN仍主要由门静脉供血,其信号在动态增强所有扫描期相均与正常肝背景相似。而HGDN由于动脉不完全毛细血管化、门静脉血流减少,动脉期呈等或稍低信号,延迟期呈低信号。因此动态增强扫描有助于鉴别DN和HCC[25-26]。与细胞外对比剂不同的是,EOB-MRI不仅提供结节的血供变化,还提供肝细胞的功能信息,多项研究证实了EOB-MRI在HCC诊断中的有效性,被认为是可以客观描绘肝癌发生过程中的最敏感手段,对HCC及其癌前病变的诊断具有较高的敏感度,已被许多东方国家列入诊疗指南中的一线检测方法[27]。在HCC发生和发展过程中,细胞膜表面有机阴离子转运多肽(organic anionic transporting polypeptide,OATP)表达逐步减少。LGDN中OATP表达与周围正常肝细胞类似,甚至出现过度表达,肝胆期(hepatobiliary phase, HBP)呈等或高信号,而HGDN中OATP表达明显减少,HBP呈低信号,文献报道结合HBP低信号、少血供、DWI不受限,诊断HGDN的敏感度为94.7%,特异度为99.3%。T2WI高信号、DWI高信号、门静脉期低信号是鉴别HGDN和eHCC的重要征象[28-29]。许多回顾性研究发现少血供、HBP低信号的HGDN可以发生富血供恶性转化,如果不经过治疗,1年内15%~77.3%发生癌变。发生恶性转化的高危因素包括:少血供病变≥(10~15)mm,结节体积倍增时间≤18个月,T2WI、DWI高信号[30-32]。动脉期血供增加是结节随访过程中提示癌变和eHCC的最重要征象,推荐常规使用动脉期同层减影技术[33]。不同结节的各序列表现参见表1。
3.2.5 数字减影血管造影(digital subtraction angiography,DSA) 因DSA为侵入性检查方法,不推荐其用于HCC癌前病变的诊断和鉴别诊断。
3.2.6 正电子发射计算机断层成像(positron emission tomography/CT,PET/CT) 碳-11标记的乙酸盐(11C-acetate)或胆碱(11C-choline)PET显像可提高对高分化肝癌诊断的敏感度,与EOB-MRI有互补作用。不推荐采用氟-18-脱氧葡萄糖(18F-FDG)PET/CT诊断HCC癌前病变。

表1 MRI检测肝内不同结节的各序列表现
注:LGDN,低度异型增生结节;HGDN,高度异型增生结节;eHCC,早期肝细胞癌;HCC,肝细胞癌;DWI,弥散加权成像。
3.3 血清学诊断 甲胎蛋白(AFP)为肝癌诊断中最常用的血清肿瘤标志物,但其敏感度与特异度有待提高。根据其与小扁豆凝集素不同的结合程度,可将AFP分成三种亚型:AFP-L1、AFP-L2和AFP-L3。在上述三种亚型中,AFP-L3 是肝癌细胞特有的,且其比例随着癌变程度的增加相应升高,因此也可作为原发性肝癌的检测指标。研究[34]报道AFP-L3检测能够在慢性乙型肝炎患者及肝硬化等高危人群中发现直径<2 cm的肝癌,AFP-L3 比影像学可以提前9~12个月发现肝癌的存在。
异常凝血酶原(DCP)为维生素K缺乏/拮抗诱导蛋白,是伴随HCC 特异产生的异常凝血酶原。肝癌癌变发生后,癌细胞中凝血酶原前体合成异常,导致其羧化不完全产生大量的DCP,DCP作为肝癌肿瘤标志物已进入临床应用阶段。
GPC-3是一种硫酸类肝素蛋白多糖,具有调控细胞生长、增殖、分化、迁移及黏附的作用,通常在少数器官组织中低水平表达。已有研究表明GPC-3在正常肝组织中不表达,在良性肝病组织中极低量表达,而在绝大多数肝癌组织中高表达。GP73是一种Ⅱ型高尔基体跨膜蛋白,在健康人肝细胞中GP73表达量很少;肝细胞中GP73在机体出现肝炎时表达有所升高;而肝癌细胞中GP73水平在机体发生肝癌时表达显著升高。有研究[35-36]发现,GPC-3在HCC中阳性率为69.4%,在良性肝组织中阳性率为0,故GPC-3应用于诊断HCC与良性肝脏病变有一定价值。
骨桥蛋白(osteopontin,OPN)是一种多功能的磷酸糖蛋白,在多种实体肿瘤中均呈高表达,部分释放入血致使血浆中OPN的表达水平升高,一项meta分析也评价了 OPN在肝癌诊断中的准确性,结果表明:OPN和AFP诊断肝癌的灵敏度分别是88%和68%,特异度分别是87%和 97%。提示 OPN 有望成为肝癌早期诊断及预后判断的分子标志物[37]。
综上所述,肝癌的癌变过程中可能伴随着一种或多种血清肿瘤标志物的升高。单项检测或多项联合检测可显著提高肝癌诊断的阳性率,同样也可在癌前病变的诊断中提供借鉴。
4 HCC癌前病变的治疗
HCC癌前病变的治疗目前临床研究国外文献报道较少,国内也仅有少量病例的回顾性分析。一是其进展为HCC的时间间隔较长,甚至可超过5年,干预时机难以把握;二是是否会导致过度治疗的问题[38-39]。
4.1 随访监测 加强对肝硬化患者的监测,是降低HCC发病率和提高HCC根治率及总生存率的重要方法。监测可使癌前病变或HCC被识别于早期阶段,使根治成为可能。直径小于1 cm的LGDN或DF,可采用随访监测,推荐半年一次的随访间隔。美国肝病研究学会(AASLD)、欧洲肝病研究学会(EASL)和亚太肝病研究学会(APASL)均推荐感染丙型肝炎病毒(HCV)及其他因素引起的肝硬化患者半年定期随访。
4.2 局部消融治疗 一项针对HGDN行射频消融(radio frequency ablation,RFA)治疗的预后模型分析表明:HGDN进展为HCC的风险较高,及时行RFA治疗组的5年总生存率优于对照组,对照组为随访至HCC确诊并及时行肝切除的患者。对HGDN与早期分化好的HCC两组,匹配行RFA治疗后,HGDN组在1年内的治疗有效率、肿瘤局部进展,1、3、5年的总体生存率均优于HCC组[40-41]。因此对于临床明确诊断或高度疑似的HGDN,可推荐行RFA治疗,治疗的适应证:(1)单发或多发,未临近肝内一级血管、胆管分支,肝功能Child-Pugh A、B级;(2)HCC外科切除术后新发病灶,无法耐受手术切除,肝功能Child-Pugh A、B级;(3)合并HCC,无法耐受手术的患者。禁忌证:(1)意识障碍;(2)合并全肝弥漫型HCC;(3)心、肺、肝、肾等主要器官功能衰竭;(4)胆系感染、败血症;(5)不可纠正的凝血功能障碍。
4.3 手术切除 根据HCC癌前病变的自然病程研究结果,HGDN其1年内的恶性转化率达到30%~40%,恶变率高于其他病变,因此对确诊HGDN的患者行手术治疗,是以达到根治性治疗目的为原则。制定相应的适应证及禁忌证,可有效降低HCC发病率及复发风险,同时又可避免过度治疗的问题。结合术前影像、分子标志物及病理学评估,对诊断为HGDN的患者,手术适应证为:肝功能Child-Pugh A级,病灶直径≥1 cm,单发,或多发但局限于某一段或某一叶,或多发弥散但根治切除后剩余肝脏体积足够的患者。手术方式可为局部切除,肝段、肝叶或半肝切除。
4.4 其他治疗 其他治疗可包括TACE、分子靶向治疗等。目前TACE治疗HGDN的临床报道极少,其治疗的效用仍需大量前瞻性临床实验来评估,目前推荐TACE治疗的适应证:(1)多发或弥漫发生的HGDN,无法行根治性治疗,无肝肾功能严重障碍;(2)无法耐受手术治疗,病灶位于某些特殊部位,无法行RFA治疗。同时,对于HBV并伴有肝硬化的患者必须行核苷类似物等抗病毒治疗,且应尽可能使病毒量降低到不可检测。
5 HCC癌前病变治疗后随访监测
在治疗后的第1年,推荐每3个月复查一次,后续每半年复查一次。如有可能应做EOB-MRI检查。对于术后病理发现伴有局灶癌变的患者,应按照肝癌的随访原则进行。肝癌癌前病变的诊治流程见图1。
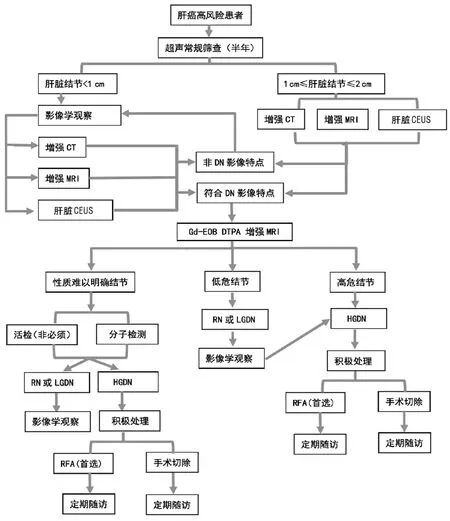
注:DN,异型增生结节;RN,再生结节;LGDN,低度异型增生结节;HGDN,高度异型增生结节;RFA,射频消融。
图1肝癌癌前病变的诊治流程
顾问:陈孝平
执笔:夏锋、李雪松
组织编写:《中华肝脏病杂志》编辑委员会、中华医学会肝病学分会肝癌学组
编写专家组成员(按姓氏汉语拼音排序):蔡萍、丛文铭、冯仕庭、冯晓彬、郭荣平、韩风、黄志勇、李滨、李靖、李秋、李锐、李晓武、李雪松、刘斌、刘秀峰、龙莉玲、罗燕、马宽生、毛先海、毛一雷、潘耀振、彭宝岗、彭涛、冉海涛、沈文、孙宇航、唐红、王志明、文宇、吴泓、吴力群、夏锋、谢传淼、许乙凯、张大志、赵心明、周杰、周开伦、周伟平、左石
利益冲突:所有作者均声明不存在利益冲突

参考文献见二维码

