动态增强磁共振成像对肾功能的评价*
么喜存 杨 芹 孙浩然
1 天津医科大学总医院滨海医院,天津市 300480; 2 天津医科大学总医院
利用钆基造影剂(Gadolinium based contrast agent,GBCA)做动态增强MRI(Dynamic contrast enhanced MRI,DCE-MRI)来评价肾功能,已得到了很多年的关注。在此之前,临床上反映肾功能的指标很多,如血清肌酐浓度(SCr)和血尿素氮(BUN)、内源性肌酐清除率(Ccr)、肾小球滤过率(GFR)、有效肾血浆流量(ERPF)等。然而,SCr和BUN被认为是晚期肾功能不全的标志,不能早期发现实质性的、不可逆的肾损害[1],也不能用于评价单肾功能。Ccr对于反映肾脏血流和排泄也很重要,但是由于检查过程复杂所以不常被应用。SPECT肾脏造影是目前评价包括GFR和ERPF在内的肾脏功能的主要影像技术,但缺乏良好的空间分辨率,不能准确反映形态学改变。超声微泡造影检查技术的准确性比较依赖于操作者的水平,检查费时、敏感性较低,且一次测量的扫描范围有限,不能同时获得双侧肾脏的血流信息。而且微泡超声造影检查结果容易受到微气泡的大小及稳定性、组织深度的影响[2]。DCE-MRI技术能够对肾脏的泌尿功能做更为复杂的建模,以更廉价的费用、更少的时间获得eGFR及没有辐射的MR肾图(MR renography,MRR)。
1 DCE-MRI的基础概念
DCE-MRI是通过静脉注射钆基造影剂和连续断层扫描目标组织,得到时间—信号强度曲线(Time signal intensity curve,TIC)来进行成像的技术。与组织相关的参数可以通过使用基于模型的或无模型的方法分析曲线来计算。通过连续监测造影剂通过皮质、髓质和收集系统的传递,得到TIC并加以分析,便可以确定临床上重要的单个肾脏参数,如肾血流量、GFR和皮质髓质血容量[3]。
2 DCE-MRI的采集
2.1 序列选择 理想的脉冲序列应具有较大的T1加权、良好的信噪比(Signal noise ratio, SNR)、速度要快、信号变化与GBCA的浓度应呈线性关系[4]。根据脉冲序列是使用自旋回波还是使用梯度回波来形成信号,脉冲序列可分为两大类。为了达到更快的速度和更高的信噪比,一般选择DCE成像的2D或3D GRE序列。目前快速3D采集已逐渐取代2D方法。一方面,GBCA缩短了T1和T2弛豫时间,对T1弛豫时间的影响更大;另一方面,弛豫速率与GBCA浓度呈线性关系。合理的T1加权可以使用具有短回波时间(TR)、相对高翻转角(45°~90°)和短回波时间(TE)[5]的GRE(SPGR)序列来完成。在DCE-MRI中,为了减小T2*效应,选择TE值应接近其最小值。
2.2 对比剂量 避免使用高剂量GBCA有两个原因:一个是T2*效应,另一个是肾脏的高灌注。在静脉注射造影剂期间,当肾脏和腹主动脉中的浓度超过序列的动态范围时,信号将达到饱和状态并且不再对变化敏感[6]。在文献中没有最佳剂量的一致性,Yamamoto等[7]表明,在健康人中钆剂的使用浓度约为0.02mmol/kg,而肾功能下降的患者约为0.025mmol/kg,但较少的剂量会降低对比噪声比(Contrast noise ratio,CNR)。在动物研究中,对比剂剂量使用范围在0.025~0.05mmol/kg,这取决于所用序列和MR系统获得的信噪比水平。
2.3 采集容积 有一些研究是通过双肾的一个中间层面来测量GFR值的,然后依此值推断到全肾体积而得到一个总的GFR值。这种方法是比较简单的,有较高的时间分辨力,但是这种方法忽视了肾皮质内滤过功能可能存在的不均匀性。同样,当处理患肾时,只凭单层是不能准确地代表全肾状况的。随着扫描设备的不断发展,使得采用多层或3D采集序列以覆盖每个肾的全部肾实质成为可能,这样能够更加精准地得到患肾的GFR值。
2.4 运动校正 运动效果可在扫描和后处理中进行校正,可以使用呼吸门控或导航回波来确保在呼吸周期中总是在同一时间点获取图像,并且可以应用饱和准备序列来消除磁化。但是这些方法将降低时间分辨率和信噪比。在后处理步骤中,可以采用图像配准算法[8]来解决移动。Shehata等人[9]提出的基于三维DCE-MRI数据的肾脏三维非刚性图像配准新算法及Boer等人[10]提出的双回波采集改进的Dixon重建是目前具有最佳应用前景的技术。
3 用于肾功能研究的数学模型
目前广泛应用的两室或三室模型将肾脏描述为血管室与一个或多个管状室的组合。GFR通过从血管腔到管腔的流动来识别。除了3C-IRF模型外,所有的模型都假设每个隔室内对比剂是瞬时混合的,而且造影剂渗漏到间质空间被忽略,静脉室也被忽略。除了下面描述的Baumann-Rudin模型外,所有的模型都需要一个动脉输入函数(AIF)来补偿注入血液中的非瞬时团注。
3.1 二室模型
3.1.1 Baumann-Rudin模型:由Baumann和Rudin提出的模型描述了造影剂最初从皮质(与血管腔一致)流入髓质,髓质流出被忽略。BR模型是唯一不需要测量AIF的模型。BR模型不直接计算GFR,只计算与GFR呈正比的指数kcl,清除指数kcl被定义为从皮层到髓质的单向流动的速率常数(公式1)。 Cx(t)代表肾脏皮质对比剂摄取量; Med(t)代表肾脏髓质对比剂浓摄取量。
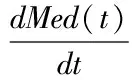
3.1.2 Patlak-Rutland模型:它是基于忽略了对比剂从管状室流出的两室模型,同时也忽略了团注药丸在肾血管中的分散,认为近似于主动脉血浆中的浓度。该模型得到两个参数,血管隔室A的体积分数wa和GFR(公式2)。K(t)代表肾脏对化剂摄取量;Aop(t)代表腹主动脉的对比剂浓度。

在一定条件下,单肾信号强度的净增加量与其内钆剂的总含量呈正比,在固定时间内进行扫描成像,单肾的信号强度和面积通过在每个扫描图像的层面上描绘感兴趣区域(Region of interest, ROI)测量出来。根据著名的Patlak曲线进行计算[11],然后再根据血细胞比容校正后就得出了所谓的“清除率”。动态扫描用于描绘主动脉密度曲线以得到更多的数据点。
主动脉衰减曲线是用Patlak曲线测定GFR时必须描绘出来的。该曲线包含四个部分图像的数据,分别是弹丸触发、动脉期、动态扫描、实质期的图像,这些图像的数据分别通过在主动脉腔内圈画一个环形的ROI来测得。因为动态扫描的次数有限,缺失的部分以线性插值法补充。ROI应尽可能靠近血管内壁,如有明确的血管壁钙化,要除外钙化区域[12]。
3.1.3 考虑肾小管造影剂流出的两室模型:分为忽略团注药丸在肾血管中分散的两室模型(2C)和考虑团注药丸在肾血管中分散的两室模型(2CD)。Buckley等人[13]针对2C以及Sourbron等人[14]针对2CD模型注意到PR方法相对低估了GFR,并将这种低估归因于PR方法中忽略了肾小管造影剂的流出。所得参数:血管隔室A的体积分数wa、GFR、肾小管隔室T流出率(公式3)。A(t)代表肾血管隔室A的对比剂摄取量;wa代表血管隔室的体积分数。
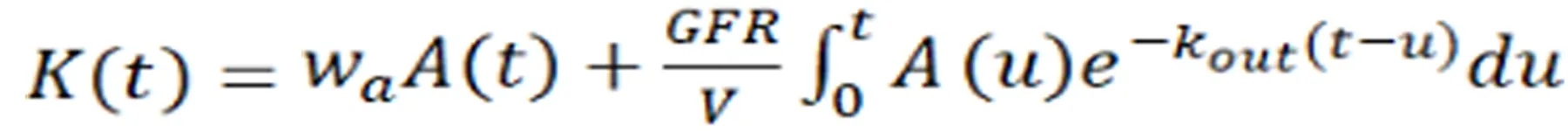
公式3
在2C模型中:A(t)=Aop(t)
3.2 三室模型 包括考虑团注药丸在肾血管中分散的三室模型(3CD)和脉冲保持式三室模型(3C-IRF)。Lee等人[15]最早提出的三室模型(3CD)将皮质和髓质描述为三个连续连接的室的组合:皮质和髓质共享的血管室(A)、仅在皮质中包含的近端小管(P)和仅在髓质中包含的髓袢(L)。同时拟合皮质和髓质浓度可以得到5个参数,包括RPF、GFR、皮质和髓质血管体积以及近端肾小管和髓袢中的水分再吸收分数。Zhang等[16]的3C-IRF模型结构与3CD模型相同,假设由于路径的分布,对比剂需要一个最小通过时间从一个隔室进入另一个隔室,在通过之前,每个隔室都表现为一个无流出系统,对比剂通过时才变成一个流进—流出系统。3C-IRF模型包含9个参数:RPF、GFR、皮层血管体积分数、三个隔室的最小通过时间、三个隔室的流出常数(公式4~8)。
Cx(t)=waCxA(t)+wpP(t)
公式4
Med(t)=waMecJA(t)+WlL(t)
公式5
公式6
公式7
公式8
4 存在的问题
DCE-MRI是研究肾脏功能的新兴检查方法,然而对于GFR的估计仍然在摸索研究当中,因为一些原因,目前临床应用仍存在很多困难。首先,由于呼吸运动及周围肠管导致的磁化率伪影,难于从全肾获得准确及可重复的信息;其次,在观察到的MR信号变化与对比剂浓度之间的复杂关系,导致定量分析困难;第三,所提出的用于经MRI数据计算GFR的不同动力学模型仍需要被验证是有效且可重复性好的;第四,对于需要AIF的方法,主动脉增强的变化对建模结果有很大影响,是GFR测量结果不确定性的主要来源;第五,近十年学者们虽然一直围绕这些技术进行探索,尽管改良的数学模型不断被提出[17],但是现有模型的准确性仍没有达成广泛共识。
综上所述,DCE-MRI技术在多方面存在挑战,未来还需找到更加可靠、容易获得、且临床上可应用的精确定量模型。令人欣喜的是,基于近些年DCE-MRI对GFR定量与核素显像的相关性研究[18],表明了DCE-MRI具有成为无创性肾功能检查方案的潜力,在研究肾血管性病变、肾积水、肾小管坏死、糖尿病肾病和急、慢性肾脏弥漫性病变及移植肾功能异常等疾病[19]方面具有较广阔的应用前景。

