颌骨牙源性黏液瘤螺旋CT和MRI表现
赵 雪,王晶波,陶晓峰
(上海交通大学医学院附属第九人民医院放射科,上海 200011)
牙源性黏液瘤(odontogenic myxoma, OM)系起源于牙源性间叶组织的良性肿瘤,临床少见,约占牙源性肿瘤的0.2%~17.7%,其发病率仅次于成釉细胞瘤和牙源性角化囊性瘤,在牙源性肿瘤中居第3位[1-3]。OM无包膜或包膜不完整,具有局部浸润性,保守治疗后易复发[2]。X线摄影术(口腔全景片等)是显示和诊断颌骨病变的基本影像学方法,OM表现呈多样性,为单房或多房,呈特征性“网球拍状”“火焰状”表现,易与其他牙源性肿瘤及非牙源性肿瘤混淆,或被误诊为恶性肿瘤[4]。CT可清楚显示OM病变范围、边界和骨质破坏等[5],MRI可显示软组织及病变内部成分。既往OM多见于个案报道[6]。本研究分析40例OM的CT和MRI资料,观察其影像学特征,以期提高临床及放射科医师对颌骨OM的认识。
1 资料与方法
1.1 一般资料 收集2013年11月—2018年4月40例于上海交通大学医学院附属第九人民医院确诊的颌骨OM患者,男18例,女22例,年龄10~66岁,平均(33.5±13.5)岁,其中23例20~40岁。纳入标准:①影像学资料完整;②OM原发于颌骨;③经手术病理确诊。排除标准:①治疗后病灶;②复发性病变。
1.2 仪器与方法 对40例患者均进行CT检查,对其中11例行CT增强检查;5例行平扫MR,2例行MR增强检查。CT检查采用Philips Brilliance 64排螺旋CT仪,管电压120 kV,管电流50 mA,层厚5 mm,间距5 mm,矩阵512×512。对比剂采用碘佛醇,剂量70~80 ml,注射流率2.50 ml/s;重建层厚1 mm。MRI采用Philips Ingenia 3.0T MR扫描仪,头颈联合线圈,扫描序列及参数:横轴位 T1W(TR 615 ms,TE 18 ms),横轴位 T2W(TR 2 700 ms,TE 70 ms),横轴位抑脂增强T1W(TR 745 ms,TE 8.2 ms),冠状面增强T1W(TR 550 ms,TE 8.8 ms);其他参数相同:矩阵256×256, FOV 260 mm×260 mm,层厚 5 mm,层距1 mm。对比剂为钆喷酸葡胺,注射流率2.0 ml/s,剂量0.1 mmol/kg体质量。
1.3 数据处理与分析 将所有原始CT数据传入Philips Extended Brilliance Workspace工作站,由1名具有3年头颈部影像学诊断经验的住院医师采用工作站自带软件行后处理,包括多平面重组(multiplanar reformation, MPR)和容积再现(volume rendering, VR)。MPR包括冠状面和与下颌骨走行一致的斜矢状面,层厚1 mm。由另外2名分别具有5年和7年头颈部影像学诊断经验的主治医师阅读所有CT及MRI,意见不一致时经共同探讨确定。
2 结果
40例OM中,35例临床表现为颌骨缓慢增大的无痛性肿块(35/40,87.50%),2例鼻塞(2/40,5.00%),1例下唇麻木(1/40,2.50%),2例(2/40,5.00%)于口腔检查时偶然发现。CT及MRI示病灶最大6.0 cm×8.5 cm×5.0 cm,最小1.0 cm×0.5 cm×0.8 cm;11例(11/40,27.50%)位于上颌骨,29例(29/40,72.50%)位于下颌骨;最多见于下颌后牙区(19/40,47.50%),累及下颌骨体部、角部、升支;1例累及双侧下颌骨。CT平扫均呈膨胀性骨质破坏,其中1例呈“日光放射状”改变(图1),8例(8/40,20.00%)骨皮质中断。病灶内常见多房伴与病灶周边垂直或成角的分隔(表1),24例(24/40,60.00%)呈多房型,其中3例(3/40,7.50%)见直线、弯曲状纤细分隔(图2);16例(16/40,40.00%)单房型,其中8例(8/40,20.00%)见纤细骨小梁。40例中,2例累及上颌窦(图2),2例见埋伏牙。40例病灶CT值0~58 HU,平均(24.34±12.06)HU,其中36例(36/40,90.00%)病灶呈低密度(图1),4例(4/40,10.00%)呈等密度。11例CT增强扫描病灶边缘均强化,内部无明显强化(图1)。5例MRI示病灶与周围软组织边界清楚,4例病灶位于下颌骨、1例位于上颌骨;4例位于后牙区,1例位于前牙区。3例T1WI呈均匀等信号(图3A),2例呈均匀稍高信号;5例T2WI均呈高信号,内部见低信号线样分隔(图3B)。其中2例增强后周边强化而内部无明显强化(图3C)。
3 讨论
OM是口腔颌面部少见的良性肿瘤,于1947年首次报道[7],目前其病因尚不明确,GONZALEZ-GAL等[8]认为可能与破骨细胞生成相关的细胞核因子κ因子活化受体(receptor activator of NF-κB, RANK)、细胞核因子κB因子活化受体配体(receptor activator of NF-κB ligand, RANK-L)和骨保护因子(osteoprotegerin, OPG)活化有关。组织学上,OM边界不清,无包膜或包膜不完整;肉眼见病灶位于骨内时,肿瘤细胞可能已经侵及病灶周边骨小梁结构[9]。镜下可见大量黏液样组织,内有疏松排列的星型细胞、梭形细胞,以长胞浆突起相连[10]。
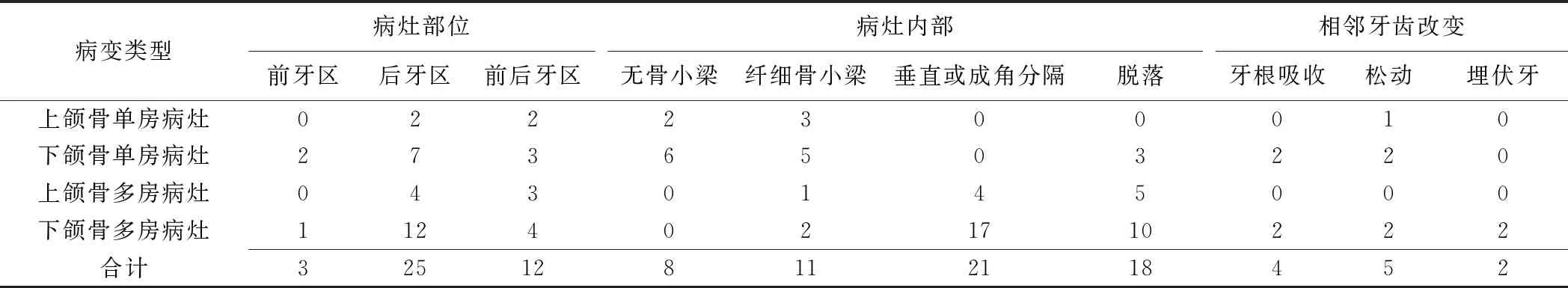
表1 颌骨OM的CT表现(例)
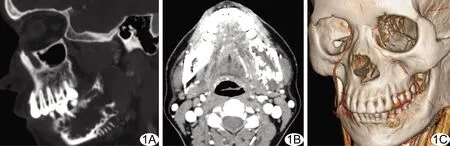
图1 患者女,46岁,左侧下颌骨OM A.CT斜矢状位重建示下颌骨下缘骨性分隔垂直于病灶周边; B.CT增强图像示病灶局部骨质破坏呈“日光放射状”改变,病灶内部未见强化; C.VR示左侧下颌骨OM

图2 患者女,32岁,右上颌骨OM A.CT平扫骨窗图像示右上颌骨病灶内部纤细分隔,与病灶周边垂直或成角; B.CT冠状位重建图像示病灶向上突入上颌窦; C.VR示右侧上颌骨OM

图3 患者男,18岁,左下颌骨OM A.轴位T1WI示左下颌骨后牙区均匀等信号; B.冠状位T2WI示病灶呈不均匀高信号,内见线状低信号; C.T1WI增强示病灶周边明显强化,中心未见明显强化
OM好发于青年,以20~40岁高发,患者多以颌面部缓慢增大的无痛性肿块就诊,肿瘤侵及牙槽突时,可致牙齿松动或脱落,压迫下牙槽神经可致下唇麻木等感觉障碍[1,7]。本组40例中,35例(87.50%)以无痛性肿块就诊;24例(60.0%)存在多房型病灶,其中12例(32.5%)位于下颌后牙区;18例牙齿脱落,与KHEIR等[1,7]研究结果一致,而与SIMON等[10]报道的52.38%牙根吸收发生率(11/21)略有差异。
CT扫描辅以MPR和VR、尤其斜矢状位重建图像,可提供三维解剖信息、骨组织及邻牙受累等空间情况,显示直线、弯曲状纤细骨小梁或分隔,与肿瘤周边垂直或成角。本组21例(52.5%)OM可见垂直或成角的特征性分隔,11例(27.5%)病灶内见纤细骨小梁,与既往研究[11-13]结果相符。本组36例(90.0%)OM为低密度灶,与KHEIR等[1]关于OM中,等、低密度灶各占50%的结果略有差异。GOEL等[14]报道1例OM呈"日光放射"改变,本组中1例见此征象,可能与肿瘤反应性新生骨呈放射状并侵犯周围软组织有关。MRI的软组织分辨率极高,具有可多参数、多平面成像,无电离辐射,不受碘过敏限制等优势。KAWAI等[15]发现OM于T1WI和T2WI均呈中等信号,增强T1WI示肿瘤周边明显强化,内部无明显强化,与其组织学成分相对应:肿瘤周边胶原纤维成分与强化部分相对应,内部无强化区则对应内部黏液成分。本组5例MRI均显示OM呈纤维与黏液混合病灶,病灶周边强化,内部无明显强化,肿瘤边界均清楚可见,与KAWAI等[15]的结果基本一致。
OM应与其他颌骨肿瘤相鉴别。肿瘤内见骨小梁或分隔时,应与成釉细胞瘤鉴别,后者是颌骨最常见良性肿瘤,其分房呈肥皂泡或蜂窝状,增强后边缘强化或实性部分结节状强化;而OM的分隔呈“网球拍状”或“火焰状”,与肿瘤周边垂直或成角,增强后边缘强化。此外,当患者出现疼痛、麻木等侵袭性症状时,需与颌骨骨肉瘤鉴别:OM病灶内线样分隔与骨肉瘤的瘤骨骨针相似,但OM病程进展缓慢,骨肉瘤病程进展快,伴明显疼痛、麻木感。
综上所述,OM较为少见,临床表现不典型,易与其他颌骨肿瘤混淆。当CT示病灶内纤细分隔与周边骨皮质垂直或成角,MRI示病灶内囊性成分伴低信号分隔时,提示OM可能性大。两者联合诊断颌骨OM具有重要意义。本研究样本例数少,有待进一步完善。

