拓扑DNA在壳聚糖纳米粒子中的固定化负载
Annang Elsie Odua,张亚青,Chiteme Tafadzwa Evangelista,柳 永,2,3,刘士旺,2,3
(1.浙江科技学院 生物与化学工程学院,杭州 310023;2.浙江省农产品化学与生物加工技术重点实验室,杭州 310023;3.浙江省农业生物资源生化制造协同创新中心,杭州 310023)
脱氧核糖核酸(deoxyribonucleic acid,DNA)是生物遗传信息的携带者,同时也是一种功能多样的生物高分子。双链DNA(dsDNA)的解链构象-单链DNA(ssDNA),既是基因编辑的重要靶标物[1],也是DNA材料研究的常见原料[2]。ssDNA在体外常温下倾向于互补配对形成部分双链结构,这对常温下研究ssDNA生物学活性和操作ssDNA材料造成了阻碍。已知dsDNA在受热情况下,能够解链形成并保持ssDNA结构。如能将高温下的ssDNA结构固定化,则将为常温下研究ssDNA的生物学功能和ssDNA基功能材料研发提供有益参考。
壳聚糖(chitosan,CS)是天然阳性多糖,已被大量研究证实为优良的核酸载体。已见报道的CS/DNA复合物大致可以分为4类:1)非靶向CS/DNA纳米粒子,如CS/超螺旋DNA和CS/dsDNA/siRNA复合纳米粒子[3]、改性CS/超螺旋DNA纳米粒子[4]等,均表现出良好的哺乳细胞转染功能;2)靶向CS/DNA复合纳米粒子,如靶向大脑的锰福地吡-CS/siRNA/DNA纳米粒子[5]、靶向肿瘤细胞的CS纳米粒子[6]等;3)智能响应CS/DNA复合纳米粒子,如ATP响应[7]、氧化还原响应[8]、磁场响应CS纳米转染制剂[9]等;4)CS/DNA基人工模拟物,如CS/DNA基人工模拟酶,表现出高催化活性和高抗逆性[10]。相比种类繁多的CS/核酸复合纳米粒子报道,关于CS与核酸相互作用机制及其对细胞侵染效率的影响报道相对较少。现有研究表明,CS与DNA间弱相互作用力有利于对哺乳细胞的转染[11],CS上氨基与DNA上磷酸基团的比例对转染效率存在显著影响[12],具有支化结构的CS较线型CS具有更好的基因递送效果和更佳的细胞相容性[13]等。这些研究虽对CS/DNA相互作用与其基因转染效果间关系进行了探索性研究,但对分子水平的相互作用机制研究报道仍较少。石幻君等[14]发现磺化壳聚糖铁配合物可通过嵌插作用来解链dsDNA。Shen等[15]通过动态分子模拟发现,DNA上带负电磷酸基团与CS上带正电氨基之间的互作是壳聚糖负载DNA的主要机制。
综合以上研究可以发现,正电性CS与负电性DNA间的静电自组装是CS包埋DNA的主要作用机制。如能在体外制备携带单链区段的DNA,并在保持ssDNA构象条件下引发壳聚糖与DNA间的共聚,则有可能实现不稳定ssDNA拓扑构象的固定化。因此,我们采用热处理的方法,制备携带单链区段的线型DNA,并与CS共聚形成复合纳米粒子,对不稳定ssDNA在复合纳米粒子中的固定化负载效果进行分析评价。
1 材料与方法
1.1 试验材料
壳聚糖(粘均相对分子质量150 kDa,脱乙酰度90%以上),国药集团化学试剂有限公司;鲑鱼精DNA(D1626),美国Sigma-Aldrich公司,其0.25 mg/mL水溶液A260/A280=1.92,A260/A230=2.35;SYBR Green Ⅰ荧光染料,美国MP Biomedicals公司;其他常规生化试剂均为国产分析纯。
1.2 dsDNA热处理及解链度测定
将鲑鱼精DNA溶解于超纯水中,配置质量浓度为55 ng/μL的DNA溶液。取DNA溶液0.5 mL与SYBR Green Ⅰ原液(×10 000母液)0.5 μL混合均匀,于37 ℃下避光孵育1 h。将经过孵育的DNA溶液分装于20个0.2 mL平盖PCR管中,在荧光定量PCR仪CFX96上,分别于25、60、90 ℃下测量SYBR Green Ⅰ的绿色荧光信号强度。以25 ℃下测得荧光信号值为100% dsDNA荧光信号值,将60 ℃和90 ℃下荧光信号值与25 ℃荧光信号值相除,计算各温度下dsDNA的百分比含量。
1.3 携带单链区段DNA在壳聚糖复合纳米粒子中的负载
将CS溶解于1%醋酸溶液中,并以NaOH溶液调节pH值,配制质量浓度为1 mg/mL,pH值为5.5的CS溶液。将鲑鱼精DNA溶解于超纯水中,质量浓度为0.25 mg/mL。
在25 ℃下,按CS与DNA质量比为4/1、1/1和1/2,将DNA溶液在磁力搅拌下滴加到CS溶液中。在60、90 ℃下,按CS与DNA质量比为4/1,将DNA溶液在磁力搅拌下滴加到CS溶液中。DNA滴加溶液逐渐呈现蓝白色荧光(后续检测表明CS与DNA共聚形成了复合纳米粒子)。
1.4 复合纳米粒子表征
傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)分析采用傅里叶变换红外光谱仪Paragon 1000型(美国Perkin Elmer公司),在500~4 000 cm-1范围内扫描,样品与KBr粉末混合后压成薄片测定;差示扫描量热分(differential scanning calorimetry,DSC)分析采用差示扫描量热仪DSC Q100 V9.9 Build 303型(美国TA Instruments公司),冷冻干燥样品质量为3~5 mg,先将样品从室温降到-40 ℃,保持3 min,然后以20 ℃/min升温到250 ℃;粒径分布和zeta电位分析采用Zetasizer 3000HS型(美国马尔文仪器有限公司),以纳米溶液直接测定;透射电子显微镜观察(transmission electron microscope,TEM)采用JEM-1200EX型号(日本JEOL公司),制样方法为悬滴法。
2 结果与讨论
2.1 不同温度处理下DNA的解链度
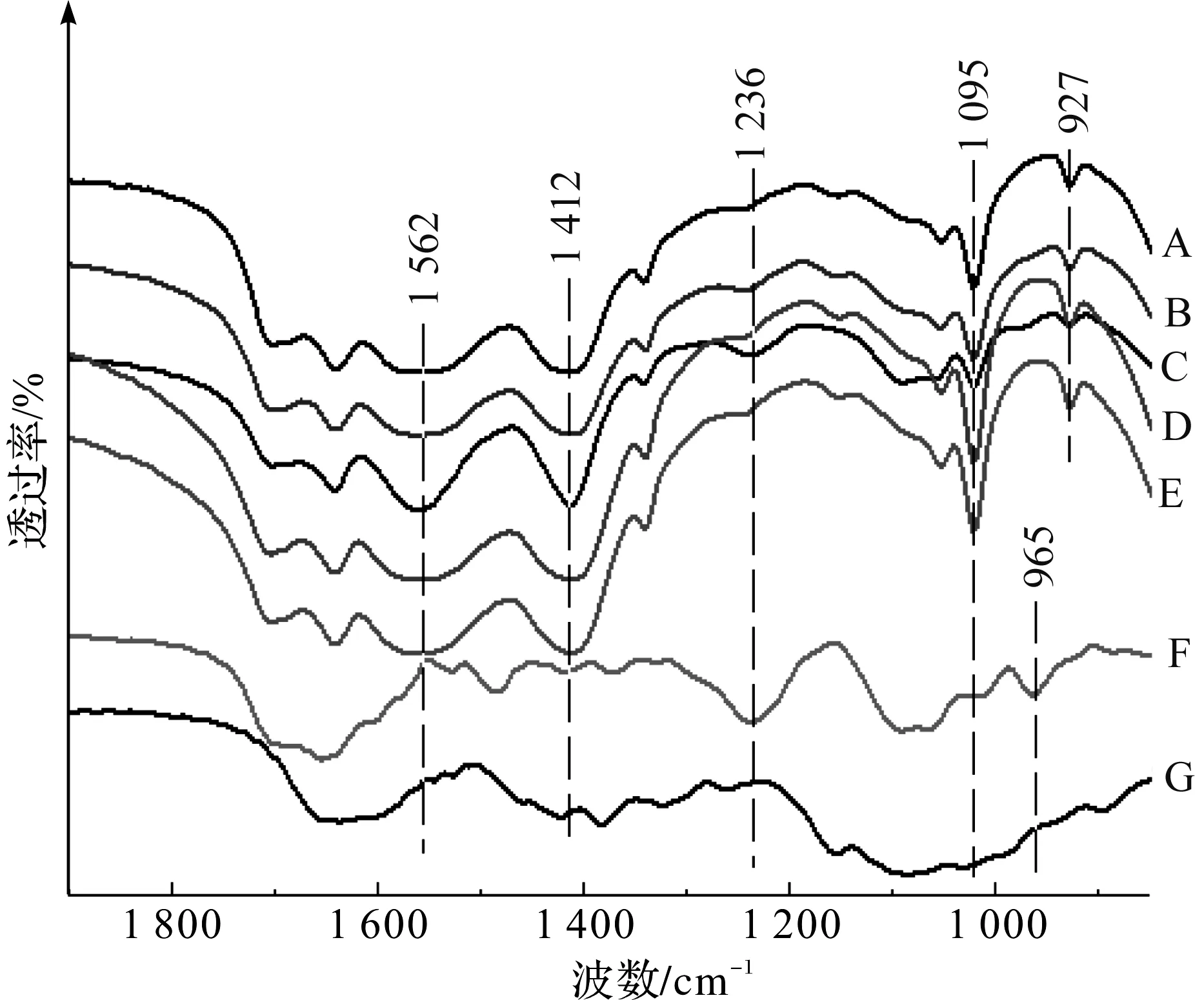
图1 CS/DNA复合纳米粒子FT-IR分析
SYBR Green Ⅰ能够与dsDNA的小沟结合,结合后的荧光信号可增强800~1 000倍。在25 ℃下,dsDNA结构稳定,SYBR Green Ⅰ与DNA充分结合,在蓝光(497 nm)激发下发射绿色荧光信号(520 nm)。当温度升高到60 ℃和90 ℃时,dsDNA部分解链产生ssDNA区段。在ssDNA区段上,DNA小沟消失,SYBR Green Ⅰ从相关位点脱落,520 nm下荧光信号减弱。同时,未解链dsDNA区段SYBR Green Ⅰ仍结合于DNA小沟上,荧光信号得到保持。将60 ℃和90 ℃下荧光信号值分别与25 ℃下荧光信号值相除即可计算相应处理温度下的dsDNA的百分比含量,并推算出相应的ssDNA百分比含量。结果显示,在60、90 ℃下dsDNA的百分比含量分别为66.9%±1.8%、10.5%±1.3%,ssDNA百分比含量分别为33.1%±1.5%、89.5%±1.9%。表明在25、60、90 ℃处理下,获得了具有不同解链度的DNA样品。60、90 ℃处理下产生的ssDNA在温度降低后会重新形成链内或链间dsDNA结构,表现为不稳定拓扑结构。
2.2 复合纳米粒子的FT-IR分析
CS/DNA复合纳米粒子FT-IR分析结果如图1所示,A、B、C对应样品为25 ℃下DNA与CS质量比分别为4/1、1/1、1/2时制备纳米粒子;D、E对应样品为DNA与CS质量比为4/1时,分别在60、90 ℃下制备纳米粒子;F为DNA,G为CS。从图1可知,DNA在1 236 cm-1和1 095 cm-1处吸收峰分别为磷酸基团(PO21-)反对称伸缩振动和对称伸缩振动峰[16-17],在CS包埋DNA形成的复合纳米粒子中,当CS与DNA比例(CS/DNA)为4/1或1/1时,上述两处吸收峰微弱。在CS/DNA为1/2样品中,上述两处吸收峰强度高于4/1或1/1样品。这表明,在4/1或1/1的CS/DNA比例下,DNA上的磷酸基团被充分固定化,对称振动减弱;而在1/2比例下,较多磷酸基团保留了对称振动状态。磷酸基团是DNA骨架的主要结构基团,CS/DNA复合纳米粒子中DNA磷酸基团的固定化,意味着DNA结构的固定化。Shen等[15]的CS负载DNA分子动态分子模拟研究报道,同样认为DNA上带负电磷酸基团与CS上带正电氨基之间的相互作用是壳聚糖负载DNA的主要机制。此外,DNA在1 236 cm-1处吸收峰是B -DNA特征峰[18],在CS/DNA复合纳米粒子中,该处吸收峰的减弱表明CS可能与其他多胺类高分子一样,能够诱导天然右手螺旋B -DNA转变为左手螺旋Z -DNA[19]。DNA在965 cm-1处的吸收峰为其主链核糖振动吸收峰,在复合纳米粒子中该振动峰向低波数方向移动到了927 cm-1,也表明复合纳米粒子中的DNA结构得到了固定化。对于复合纳米粒子中DNA解链度问题,由于DNA与CS之间及DNA碱基对之间存在多种氢键作用力且氢键构成基团相似,因此无法从傅立叶变换红外光谱中有效解析获得DNA的解链度信息。
2.3 复合纳米粒子DSC分析
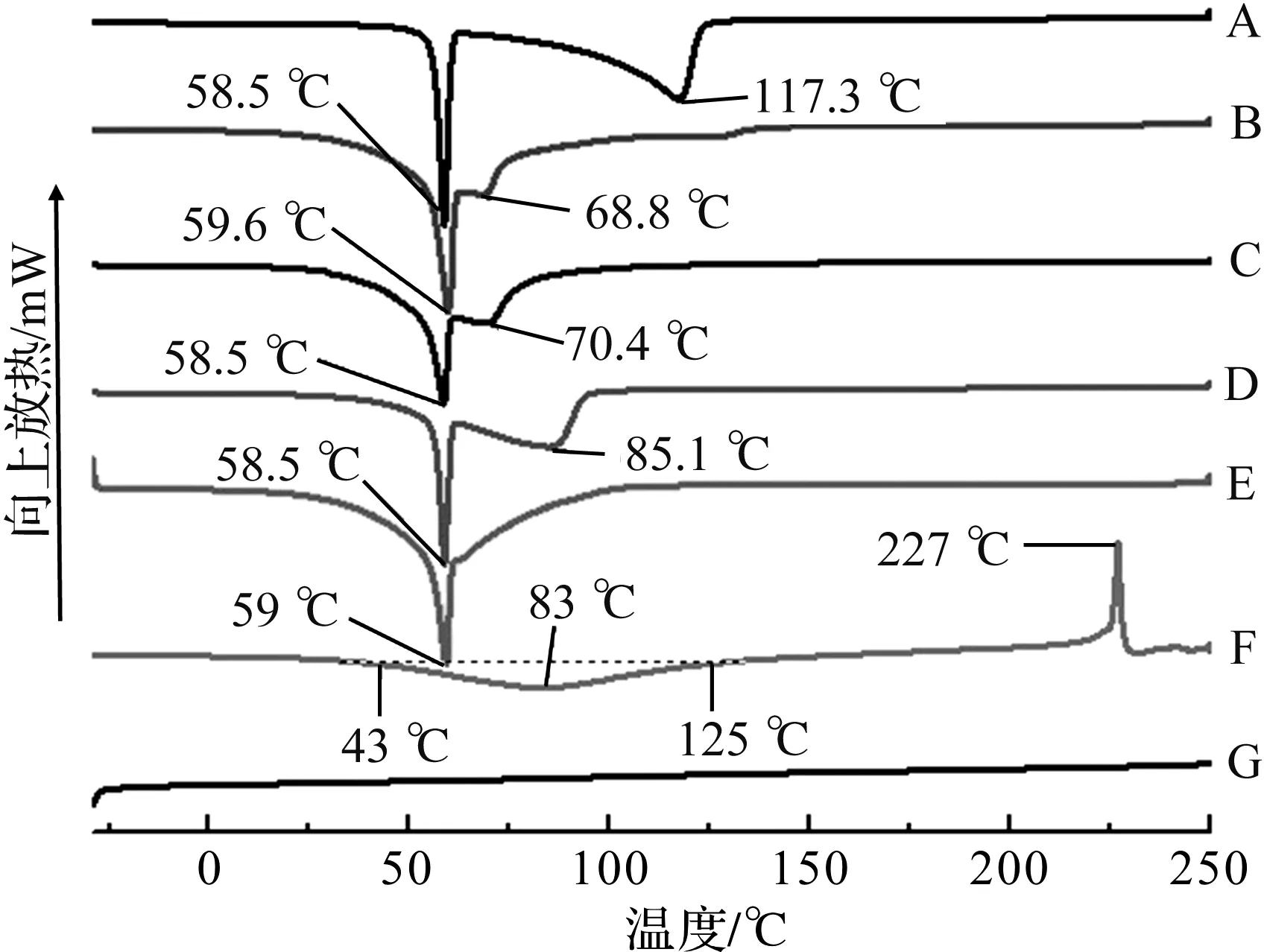
图2 CS/DNA复合纳米粒子DSC分析
CS/DNA复合纳米粒子DSC分析结果如图2所示,A、B、C、D、E、F、G对应样品与图1同。由图2可知,天然鲑鱼精DNA在43~125 ℃出现较平缓吸热单峰,峰值温度为83 ℃,该峰为dsDNA解链形成ssDNA过程吸热所致。在227 ℃附近出现的放热峰则为DNA氧化分解放热所致。CS在-30~250 ℃未出现明显吸放热峰。相比天然鲑鱼精DNA,CS/DNA复合纳米粒子的峰形和数量发生了显著变化:首先,5个CS/DNA复合纳米粒子样品(A、B、C、D和E)均在59 ℃附近出现第1个吸热峰,该峰为dsDNA局部解链DNA呼吸增强所致;其次,25 ℃或60 ℃下制备的4个CS/DNA复合纳米粒子样品(A、B、C和D),均在68.8~117.3 ℃间出现了第2个吸热峰,该峰为dsDNA完全解链吸热所致;最后,227 ℃附近未见DNA氧化分解放热峰出现,表明经CS包埋保护后dsDNA的分解温度得到了提高。比较样品A、B和C可以看出,当CS/DNA为4/1时,DNA完全解链温度最高,为117.3 ℃。这一升高DNA完全解链温度与较高CS/DNA比例下(4/1),过量CS与DNA饱和相互作用导致DNA热稳定性提高有关[20],同时也表明CS/DNA为4/1下,DNA与CS相互作用饱和度较高,有利于DNA拓扑结构的固定化。进一步比较样品A、D和E可以看出,相同CS/DNA比例下,制备温度分别为25、60、90 ℃时,DNA完全解链吸热峰逐渐向低温方向移动。由于在DNA序列相同的情况下,DNA的解链温度与其双链区段长度呈正相关,因此制备温度从25 ℃升到90 ℃过程中,CS/DNA复合纳米粒子中,dsDNA区段呈逐渐缩短趋势,相应ssDNA区段呈增长趋势。这表明,在60、90 ℃下产生的携带单链区段的DNA拓扑结构,在复合纳米粒子中得到了固定化。
2.4 复合纳米粒子的粒径分布与zeta电位
表1CS/DNA复合纳米粒子粒径分布与zeta电位分析结果
Table1Analytic results of particle size distribution and zeta potential of CS/DNA composite nanoparticles
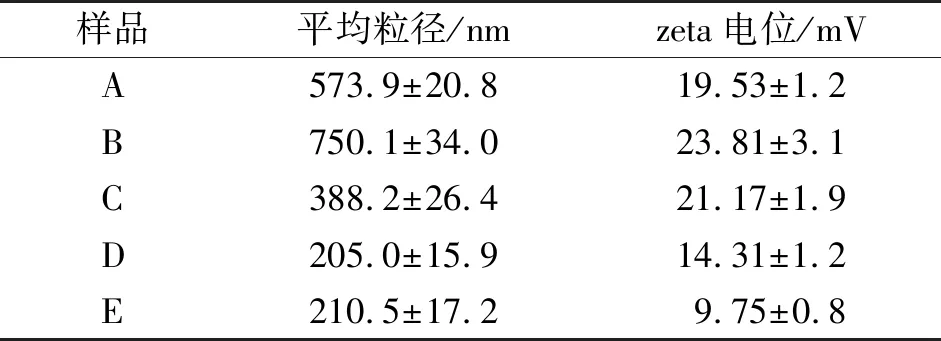
样品平均粒径/nmzeta电位/mVA573.9±20.819.53±1.2B750.1±34.023.81±3.1C388.2±26.421.17±1.9D205.0±15.914.31±1.2E210.5±17.2 9.75±0.8
CS/DNA复合纳米粒子粒径分布与zeta电位分析结果见表1,A、B、C、D、E对应样品与图1同。由表1可知,当制备温度为25 ℃时,伴随CS/DNA比例降低,复合纳米粒子平均粒径和zeta电位均出现先升高后降低的变化;当CS/DNA比例固定为4/1时,伴随制备温度升高,复合纳米粒子平均粒径和zeta电位均呈降低趋势。制备温度为25 ℃时,不同CS/DNA比例导致的平均粒径和zeta电位差异,可能与CS和DNA聚集程度不同有关。当CS/DNA比例均为4/1时,不同制备温度下(25、60、90 ℃)出现的粒径和zeta电位差异,应与DNA的解链度不同有关。在25 ℃下,天然鲑鱼精DNA主要以双链形式存在,分子刚性较强,与CS共聚形成较大纳米颗粒(平均水合粒径573.9 nm);在60、90 ℃下,鲑鱼精DNA发生解链,以双链/单链双重结构形式存在,分子刚性减弱,容易与CS共聚缠绕形成较小纳米颗粒(平均水合粒径分别为205、210.5 nm)。而伴随制备温度升高,zeta电位逐渐降低(由19.53 mV降到9.75 mV),可能是较高制备温度下含量较高ssDNA的存在降低了DNA与CS的聚集度,导致了复合纳米粒子内正电性CS比例的降低。
2.5 TEM分析
对CS/DNA比例均为4/1,制备温度分别为25、60、90 ℃的样品A、D、E进行了TEM观测,结果见图3。从图3可以看出,3个制备温度下复合纳米粒子形貌差异显著。在25 ℃下制备样品(A),复合纳米颗粒粒径较大,存在大量粒径大于100 nm的复合纳米颗粒,且颗粒中部多存在低电子密度区域,应为电子密度较低的DNA集中分布区域。在60 ℃下制备样品(D),粒径大于100 nm的复合颗粒减少,粒径小于100 nm的复合颗粒显著增多,颗粒中低电子密度区域明显减少。在90 ℃下制备样品(E),仍存在部分粒径大于100 nm的复合颗粒,但以粒径小于100 nm的复合颗粒为主,颗粒内部低电子密度区域消失。由于A、D、E样品间的主要差别是制备温度不同,即DNA解链度不同,因此3个样品间复合纳米颗粒结构差异主要由构成复合纳米颗粒的DNA拓扑结构差异造成。同时也反映出,在3个制备温度下,携带不同比例ssDNA区段的稳定或不稳定DNA拓扑结构均被固定化负载到了复合纳米颗粒中。

图3 不同温度制备壳聚糖/DNA复合纳米粒子透射电子显微镜下形貌
3 结 语
通过差异加热处理,制备了携带不同比例ssDNA区段的拓扑结构稳定或不稳定的DNA,并在相应温度下制备了CS/DNA复合纳米粒子,使得DNA的拓扑结构在复合纳米粒子中得到了固定化。尤其在CS/DNA为4/1情况下,FT-IR测试中DNA主链上磷酸基团和糖链振动均出现减弱;DSC测试中第二吸热峰伴随制备温度升高向低温方向迁移的行为,也与热处理导致的DNA双链区段长度变化预期相符;粒径分布、zeta电位和TEM测试等进一步反映出负载不同拓扑结构DNA的纳米粒子,在形貌和结构特征上存在显著差异。这些结果均有力地证明,携带单链区段的拓扑结构DNA在复合纳米粒子中获得了良好的固定化。

