Regesi再生硅材料提升牙本质表面硬度的研究
王 健 胡 方 郭创洲 郑海霞
(北京幸福益生再生医学科技有限公司,北京 101200)
牙齿敏感主要是因为牙釉质磨损或者剥离,导致牙本质小管暴露,随着温度、压力、渗透压和化学剂等局部环境改变,导致牙本质小管中的液体快速移动,刺激牙质细胞周围的神经,并引起疼痛[1]。临床上经常采用的治疗方法有两种,一是通过高浓度钾离子阻止神经对疼痛的传导;二是封闭暴露的牙本质小管,切断刺激因素通过牙本质小管进入,从而达到治疗的效果。
Regesi再生硅材料是由钙、磷、硅、氧组成的无机矿物质粉体,遇到体液后,其表面状况随时间而动态变化,形成碳酸羟基磷灰石(HCA)层,具有良好的生物相容性[2]。钙磷硅氧组成的无机矿物质材料使用在牙齿脱敏方面的研究较多[3-4],但是,其对牙本质硬度的提升效果暂无报道。牙齿脱矿后,牙釉质剥离,牙本质承担了咀嚼的功能,此时,牙本质的硬度对健康生活影响相当密切。本研究采用Regesi再生硅材料制作牙齿脱敏剂处理牙本质片,系统研究牙本质表面硬度的变化,探讨Regesi再生硅材料提升牙本质硬度的作用原理。
1 材料和方法
1.1 材料
Regesi再生硅材料脱敏剂(组成:15%的Regesi再生硅材料,甘油,聚乙二醇,北京幸福益生再生医学科技有限公司),35%的磷酸溶液(上海麦克林生化有限公司),人工唾液(依据ISO TR10271-2011配制),X射线粉末衍射仪(XRD,DMAX-RB,日本理学),场发式扫描电镜(SEM,NOVA NanoSEM 450,FEI公司,荷兰),HX-1000TM自动转塔维氏硬度计(上海精密仪器仪表有限公司),恒温振荡器(常州恩培仪器制造有限公司)。
1.2 试验方法
1.2.1 牙本质片处理:选择新鲜拔出或近期拔出的第三磨牙,用手持器械清除牙垢和附着的软组织,在75%乙醇中浸泡至少15 min,以与牙长轴垂直的角度,切取牙本质片,使其形成一个厚度为1.0 mm的牙本质片。将牙本质片置于35%的磷酸溶液中30s后取出,立即用纯化水将酸蚀剂冲洗干净,并用超声清洗仪清洗10 min,吹干。
1.2.2 实验样本处理:将空白组牙本质片作为对照组,另外3组牙本质片作为试验组。试验组使用蘸有Regesi再生硅材料脱敏剂的小毛刷,在干燥的牙本质表面同向均匀涂布2 min后,清理牙本质片表面残留脱敏剂,其中一组不经过人工唾液处理,另外两组放置于人工唾液中浸泡24 h、48 h。牙本质片从中间部位掰断,一半用于牙本质片表面小管封闭率观察,另一半的断面用于脱敏剂封闭牙本质小管深度观察。牙本质表面和断面均经过喷金后,在扫描电镜下观察各组牙片的封闭情况,并对牙本质小管计数(牙本质小管口封闭数/小管口总数)和封闭深度计量。
1.2.3 维氏硬度测试:采用维氏硬度仪,在固定载荷和加载时间分别为100g和10s的条件下,进行对照组和试验组牙本质片进行硬度测试。每片样品选中间部位一条直线,固定间隔打7个点,异常点去除,求取平均值[5]。
1.2.4 Regesi再生硅材料脱敏剂矿化处理:称量 1 g Regesi再生硅材料脱敏剂样品,分散在装有30 ml人工唾液的瓶中,将反应瓶置于恒温振荡器,设定温度为 37 ℃、转速 175 r/min;分别浸泡0 h、24 h和48 h后,样品经抽滤、清洗,60 ℃干燥。采用X射线粉末衍射仪(XRD,DMAX-RB,日本理学)对矿化后样品进行物相分析。
1.2.5统计学分析:用SPSS19.0统计软件对数据进行统计学处理,用单因素方差分析计量析比较各组小管口封闭数目比、封闭深度及硬度,所有数据均以平均数±标准差表示,并LSD法两两比较,检验水准为α=0.05。
2 结果分析
根据扫描电镜观察:对照组牙本质片表面整洁,牙本质小管轮廓清晰,并且全部开放,管口直径约为2.5-5μm,如图1-①所示;图1-②为牙本质试片涂抹脱敏剂未经过人工唾液浸泡组,图中可见部分并未完全封闭的牙本质小管,但是管口内部存在较多的填充物;图1-③和图1-④分别为涂抹Regesi再生硅材料脱敏剂,并在人工唾液中浸泡24 h和48 h,图中表面牙本质小管几乎完全封闭,在人工唾液中浸泡48 h组的封闭程度优于24 h处理组。
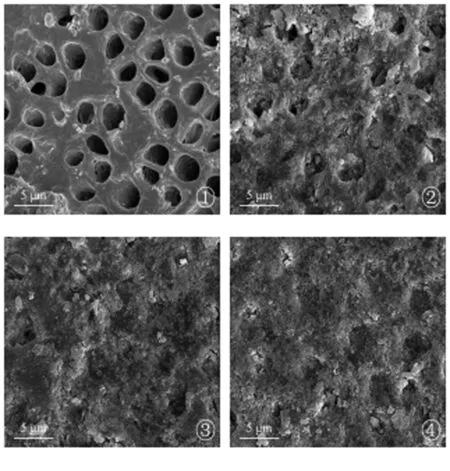
图1 空白组,0h组,24h组,48h组牙本质小管封闭率
使用牙本质小管封闭数/小管总数,分别计算各组牙本质小管封闭率。经过人工唾液浸泡0h、24h和48h的牙本质小管封闭率,均显著高于对照组(P<0.05)。涂抹脱敏剂不经过人工唾液浸泡的封闭率(93.5±6.3)%,经过24h人工唾液浸泡后,牙本质小管封闭率可达到(98.7±1.1)%,经过48h处理后,牙本质小管基本完全封闭,封闭率达到100%。根据单因素方差分析,0h、24h和48h处理的3组封闭率差异显著,具有统计学意义(P<0.05),LSD法两两比较,24 h和48 h组间差异无统计学意义(P>0.05),均显著高于0 h组(P<0.01)。
脱敏剂涂抹在牙本质片上后,在人工唾液中浸泡时间不同而牙本质小管内矿化深度不一。如图2-⑤为未处理的对照组,图中牙本质小管断面轮廓清晰,小管呈条状平行排列,管内光滑无任何堵塞物。图2-⑥为涂脱敏剂但未经过人工唾液处理组,牙本质小管口被沉积物几乎完全封闭,内部没有填充物出现。图2-⑦为涂脱敏剂后经过人工唾液24h处理组,牙本质小管口部完全封闭,封闭深度增加,管内深处出现较多填充物沉积。图2-⑧为涂脱敏剂后48 h处理组,牙本质片表面覆盖物致密,管内深出现大量填充物,致密的填充在牙本质小管中,如图中箭头所示。

图2 空白组,0h组,24h组,48h组牙本质小管封闭深度
经过测量牙本质片断面暴露的牙本质小管填充深度,在48h处理后牙本质小管中的深度可达30±9.1μm,与对照组比较,单因素方差分析3组间差异有统计学意义(P<0.05)。根据LSD法两两比较,0h和24h组间差异具有统计学意义(P<0.05),并且显著低于48 h处理组,差异具有统计学意义(P<0.05)。
采用维氏硬度仪探索经过不同时间人工唾液处理组的表面硬度变化,采用100g的载荷对牙本质片进行硬度测试,每片样品选中间部位一条直线,固定间隔打7个点,异常点去除,求取平均值。结果如图3所示,空白对照组、0h、24h和48h处理组的硬度值分别为(51.7±16.4) N/mm2、(79.3±27.1) N/mm2、(109.5±21.9) N/mm2、(228.8±32.3) N/mm2。相比于空白对照组,使用Regesi再生硅材料脱敏剂后牙本质表面硬度显著提高,试验组均具有统计学意义(P<0.05),随着人工唾液处理时间延长,牙本质片硬度呈增加趋势,0h和24h硬度值增加幅度较小,两两比较显示0h和24h组间差异无统计学意义,并均显著低于48h处理组(P<0.05)。

图3 经过0h、24h和48h人工唾液浸泡矿化处理的牙本质片表面硬度
为了进一步验证牙本质片经人工唾液处理后,牙本质硬度出现变化的原因,我们对Regesi再生硅材料脱敏剂进行0h、24h和48h人工唾液浸泡矿化实验,由于脱敏剂基质易溶于水,在人工唾液中矿化后收集的固体物仅为Regesi再生硅材料,对矿化后的样品进行XRD物相测试,图4是未浸泡处理样品(0 h)和经过24h、48h人工唾液处理的Regesi再生硅材料XRD图谱。

图4 X射线衍射图 0 h(未处理)、24 h、48 h人工唾液处理
由图4可知,未处理的Regesi再生硅材料显示出较宽广、弥散的衍射峰,说明Regesi再生硅材料是非晶态材料。经过24 h和48 h处理样品的图谱在26°、33°处出现了尖锐的衍射峰,说明样品有晶相析出,根据比对,在26°、33°、40°、50°分别对应于羟基磷灰石(HAP, PDF#54-0022)的(213)、(313)、(323)、(423)晶面衍射,说明样品经过人工唾液处理形成了HAP晶相;经48 h处理后在26°、33°衍射峰的强度明显强于24 h的样品。
3 讨论
Regesi再生硅材料是一种生物活性材料,由钙磷硅氧元素组成,根据不同制作方法调节材料的钙磷比例,钙磷比例1.5~1.8之间,接近牙齿和骨骼[6]。使用Regesi再生硅材料脱敏剂,涂在有过敏反应的牙齿上后,表面层和进入牙本质小管里的Regesi再生硅材料会被唾液包围,与唾液发生钙、磷离子交换,Regesi再生硅材料表面形成硅凝胶层,硅凝胶层作为基底吸附钙、磷离子在表面沉积,形成羟基磷灰石,从而实现封闭牙本质小管的目的。
Zhong Y等[7]研究了含有生物活性玻璃的样品在封闭牙本质小管方面的效果,结果显示含生物活性玻璃的脱敏剂能够显著降低牙本质小管的通透性;West等[8]对分别含有生物活性玻璃和含有精氨酸的脱敏牙膏在封闭牙本质小管的效果方面进行了对比研究,结果表明含有生物活性玻璃溶液的牙膏能够有效封闭牙本质小管。马骞等[9]研究不同方法使用生物活性玻璃脱敏剂对牙本质小管封闭作用,结果表明不同方法使用生物活性玻璃对敏感牙本质小管均有较好的封闭效果。史舒雅等[10]研究了生物活性玻璃脱敏剂使用1个月封闭牙本质小管,生物活性玻璃类脱敏剂能快速起效,降低渗透性。
实验中牙本质片在酸蚀后,表面牙本质小管完全暴露,单纯使用Regesi再生硅材料脱敏剂,不经过人工唾液浸泡组的封闭率(93.5±6.3)%,经过24h和48h人工唾液浸泡后,牙本质小管封闭率可达到(98.7±1.1)%和100%。随着在人工唾液中处理的时间延长,封闭率呈上升趋势,在48h人工唾液处理组的封闭率均可达到100%,同时24h和48h处理后牙本质小管的封闭深度可以达到10.2±1.6μm和30±9.1μm,其变化趋势和牙本质小管封闭率基本一致。
实验采用维氏硬度仪探索经过不同时间人工唾液处理组的表面硬度变化,结果表明,空白组牙本质片的平均维氏硬度为(51.7±16.4) N/mm2,使用Regesi再生硅材料脱敏剂后,牙本质片表面硬度提高到(79.3±27.1) N/mm2。经过24h处理表面硬度提高到(109.5±21.9) N/mm2,提升幅度较小,但是经过48 h处理样品的表面硬度大幅升高到(228.8±32.3) N/mm2。
结合牙本质小管的封闭率和封闭深度变化,牙本质片表面硬度均随着封闭深度的增加而提高,其中,长时间人工唾液处理的牙本质表面硬度显著变化。针对牙本质以上变化现象,对牙齿脱敏剂处理后样品进行了X射线衍射图谱分析,结果如图4所示,生物玻璃为非晶态材料,遇到人工唾液后有晶相析出[11],图谱中26°、33°、40°、50°分别对应于羟基磷灰石晶面衍射,说明Regesi再生硅材料经过人工唾液处理形成了羟基磷灰石晶相;经48h处理后在26°、33°衍射峰的强度明显强于24h的样品,说明在48h生成的羟基磷灰石晶相更多。
由XRD衍射图谱的结果可以证明经过24h处理后牙本质表面硬度提升幅度显著小于48h处理的原因,Regesi再生硅材料在牙本质小管中填充的越来越致密,充实了牙本质片的表面结构,减小牙本质片的表面粗糙度等影响牙本质片硬度测试的因素[12],导致牙本质片表面硬度得到显著提升。经过人工唾液处理后,Regesi再生硅材料表面形成针状羟基磷灰石,随着处理时间延长晶体结构更加完整,形成对牙本质小管均匀支撑,随着羟基磷灰石形成数量增加,羟基磷灰石在牙本质中填充更加致密,可以有效抵抗压力载荷冲击,更加稳固牙本质表面形态,使得表面硬度进一步提升。
正常牙本质主要由有机物和无机物组成,其中无机物主要是羟基磷灰石,正常牙本质的羟基磷灰石特征衍射峰的峰形、位置、高度和大小和Regesi再生硅材料经过人工唾液生成的羟基磷灰石基本一致[13],说明Regesi再生硅材料可以促使脱矿的牙本质再矿化,诱导生成新的羟基磷灰石和正常牙本质成分几乎相似,且新形成的矿物质更稳定,能够耐受酸性刺激,可形成良好的骨性结合。
综上所述,Regesi再生硅材料脱敏剂可以快速封闭牙本质小管,随着接触人工唾液的时间延长,矿化反应不断进行,Regesi再生硅材料表面形成碳酸羟基磷灰石,与牙本质构成牢固的骨性结合,牙本质小管的封闭深度和牙本质表面硬度大幅度提升,为临床牙齿过敏和牙本质暴露的治疗提供理论基础。

