巨噬细胞极化中特异性分子表达的实验研究
王乐旬张盛昔吴惠娟韦曲星胡因铭郭姣
(广东省代谢病中西医结合研究中心/广东省代谢性疾病中医药防治重点实验室/粤港澳联合代谢病重点实验室/广东药科大学中医药研究院,广东 广州510006)
巨噬细胞作为固有免疫的重要组成细胞,在器官发育、急慢性炎症、机体抵抗病原体、组织修复和稳态以及免疫调节等生理和病理过程中发挥着重要作用[1]。 巨噬细胞主要包括两种:来源于胚胎期卵黄囊的组织定居巨噬细胞(tissue resident macrophages)和来源于外周血单核细胞的巨噬细胞(monocyte-derived macrophages)[2]。 极化(polarization)是巨噬细胞的重要特点。 根据其周围的刺激不同,巨噬细胞可极化成具有不同表型和功能的细胞类型。 现在普遍接受的观点是巨噬细胞可分为两型,即M1 型和M2型,M2 又分为M2a、M2b 和M2c 3 个亚型[1,3]。
M1 型巨噬细胞,又称为经典活化的巨噬细胞(classical activated macrophages),可释放大量的炎症因子,具有抗血管形成、抗胶原蛋白合成以及清除病原体的作用[1,4-5]。 M2 型巨噬细胞,又称选择性活 化 的 巨 噬 细 胞 ( alternatively activated macrophages),可进一步分为3 种:M2a 型巨噬细胞,又称为损伤修复巨噬细胞(wound-healing macrophages),可产生多种抑炎因子,发挥抑制炎症反应、促进血管生成、胶原蛋白形成和细胞外基质沉积的作用;M2b 型巨噬细胞,又称为调节性巨噬细胞(regulatory macrophages),是一类新近发现的巨噬细胞,以产生大量IL-10 为特征,具有强大的抑炎和免疫抑制作用;M2c 型巨噬细胞,也成为获得性失活巨噬细胞(acquired deactivation macrophages),产生多种抑炎因子,发挥免疫抑制、促进血管生成、胶原蛋白形成等作用,还具有细胞吞噬功能,清除死亡的细胞[1,4-6]。 尽管国内外对巨噬细胞极化进行了深入的研究,现如今没有被普遍接受的极化特征性的分子标记[4]。
本研究利用骨髓来源的巨噬细胞,验证不同极化的诱导方法,并检测不同极化状态下的分子标记以及相关信号通路,为巨噬细胞极化的体外实验提供依据。
1 材料与方法
1.1 实验动物
8~10 周的雄性C57BL/6 小鼠购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002。
1.2 试剂
F4/80-FITC 荧光抗体、CD206-APC 荧光抗体、CD38-APC 荧光抗体、青/链霉素、EDTA 溶液、鸡卵清白蛋白(VOA)、VOA 抗体、HRP 标记的羊抗鼠IgG 和羊抗兔IgG 购自Thermo Fisher Scientific 公司;封闭抗体anti-mouse CD16/32 为BioXcell 公司产品;LIGHT- Alexa Fluor 647 荧光抗体为R&D Systems 公司产品;RPMI-1640 培养基、DMEM 培养基和胎牛血清为Gibco 产品;重组小鼠M-SCF、INFγ、IL-10、IL-13 和IL-4 为PeproTech 公司产品;红细胞裂解液、LPS(O55:B5)购自Sigma-Aldrich 公司;GAPDH 抗体购自ProteinTech 公司;p-p65、p65、p-p38、p38、p-ERK 和ERK 抗体购自Cell Signaling Technology 公司;NC 膜为Millipore 公司产品;ECL发光液为武汉聚能慧达生物科技有限公司产品;RNAiso-Plus 试剂为TAKARA 公司产品;CXCL9、CXCL13、CCL17 和CCL1 的ELISA 试剂盒为上海吉泰依科赛生物科技有限公司产品;逆转录试剂盒和荧光定量PCR 试剂盒购自TOYOBO 公司;蛋白定量试剂盒购自武汉博士德生物工程有限公司;牛血清白蛋白(BSA)、Western 细胞裂解液为上海碧云天生物技术公司产品。
1.3 主要仪器
LightCycler 480 荧光定量PCR 仪为Roche 公司产品;5810R 低温离心机为Eppendorf 公司产品;NanoDrop 2000 核酸浓度测定仪为Thermo Fisher Scientific 公司产品;CytoFlex 流式细胞仪为Beckman公司产品;Mithras LB-940 酶标仪购自德国Berthold公司;电泳仪及转膜仪为Bio-Rad 公司产品。
1.4 骨髓细胞的提取
小鼠骨髓提取过程详见参考文献[7]。
1.5 巨噬细胞的诱导
用含有青/链霉素及10%(φ)的FBS 的DMEM培养基重悬骨髓细胞,于细胞培养箱中培养3 h 后,将未贴壁的细胞离心,重悬于含有双抗、10 ng/mL的M-CSF 和10%FBS 的DMEM 培养基,于培养箱中培养,隔天换液。 M-CSF 诱导7 d 后,用0.2%的EDTA 消化细胞;然后常温1 500 r/min,离心5 min;不含血清的DMEM 培养基重悬细胞并计数;按1.0×106个/孔,进行种板;待细胞贴壁后(6 ~8 h),参照巨噬细胞体外诱导的方法[1,5]:M0:不加任何刺激因子;M1:100 ng/mL LPS +10 ng/mL INF-γ;M2a:20 ng/mL IL-4+10 ng/mL IL-13;M2b:100 ng/mL LPS+50 ng/mL 免疫复合物(IC,VOA 15 μg/mL+VOA 抗体150 μg/mL,37 ℃孵育30 min);M2c:10 ng/mL IL-10,继续培养12 h、24 h 或48 h,收集培养上清、mRNA 和蛋白质,用于后续的检测和实验。
1.6 Q-PCR 检测细胞中相关基因mRNA 的表达
mRNA 提取过程详见参考文献[8]。 引物由Invitrogen 上海公司合成,序列见表1。 按照Q-PCR试剂盒进行加样、上机运行。GAPDH作为内参,将所得Ct值按2-△△Ct方法进行数据处理。
1.7 Western blot 检测细胞中相关蛋白的表达
收集细胞蛋白,按照蛋白定量试剂盒说明书进行蛋白定量,煮沸后进行SDS-PAGE 凝胶电泳,经湿转法将胶中蛋白转至NC 膜上,用5%BSA(TBST 稀释)封闭,孵育相应蛋白的一抗(p38、ERK、p65、p-p38、p-ERK、p-p65、GAPDH,按照1 ∶1 000稀释),TBST 洗涤3次,孵育二抗(山羊抗兔,按照1 ∶10 000稀释),TBST 洗膜4 次,ECL 发光液显色,胶片于暗室中曝光,晾干胶片,扫描分析。
1.8 流式细胞仪检测
收集骨髓细胞、M-CSF 刺激的巨噬细胞或不同型别的巨噬细胞,用PBS 洗涤后,加入抗体结合缓冲液100 μL 和封闭抗体5 μL,振荡混匀,静置15 min。 然后分3 组加入抗体:F4/80 组加入1 μL F4/80 抗体,ISO 组加入1 μL 同型对照抗体,Con 组不加抗生素抗体,混匀后室温避光孵育20 min,离心,PBS 洗涤1 次,用300 μL 的PBS 重悬,上机进行流式细胞检测。
1.9 统计学方法
采用GraphPad Prism7 软件进行统计分析,计量资料采用(±s)表示。 样本数据首先进行正态性检验和方差齐性检验,对于符合正态分布且方差齐性的数据,采用单因素方差分析(ANOVA),多重比较采用Tukey 检验;不符合正态分布或方差不齐的数据采用H检验,P<0.05 为差异有统计学意义。

表1 Q-PCR 引物序列Table 1 Primer sequences for Q-PCR
2 结果
2.1 原代骨髓巨噬细胞的验证
首先对骨髓原代细胞进行流式分析,以验证原代细胞中巨噬细胞所占的比例。 结果如图1 所示,诱导前巨噬细胞指征性分子(F4/80)阳性率很低,为(4.39±2.33)%。 经过M-CSF 7 d 的诱导,骨髓细胞绝大部分都分化成了巨噬细胞,F4/80 阳性率为(91.4±5.65)%。 这表明原代骨髓细胞在M-CSF 诱导下分化成了巨噬细胞,为后续的实验打下基础。
2.2 巨噬细胞极化的诱导
对巨噬细胞诱导12 h,然后通过Q-PCR 检测不同诱导方式下巨噬细胞特异性分子的mRNA 水平变化。 结果如图2 所示,LPS+INF-γ 处理组能够显著诱导CXCL9 mRNA 水平的增加;IL-4+IL-13 处理组能够显著刺激CCL17 mRNA 的转录;LPS+IC 处理组能够显著增加CCL1 和IL-10 的mRNA 水平;IL-10 的处理能够刺激CXCL13 mRNA 的增加。
蛋白水平上,培养上清中CXCL9 的水平在LPS+INF-γ 处理组中最高,IL-4+IL-13 组能显著增加上清中CCL17 的蛋白水平,LPS+IC 组能够刺激CCL1蛋白的表达和分泌,IL-10 处理组能够增强CXCL13的蛋白表达(图3)。 此外,上清中的IL-10 的水平在LPS+IC 处理组中是最高的(图3)。
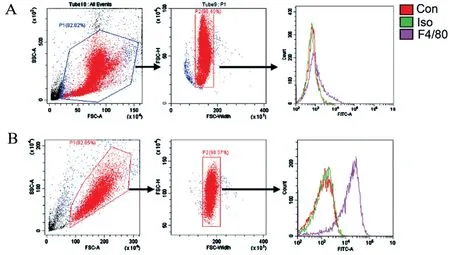
图1 流式检测原代巨噬细胞的比例Figure 1 Proportion of primary macrophages tested by flow cytometry

图2 不同处理对巨噬细胞中相关分子mRNA 水平的变化的影响Figure 2 Changes of mRNA levels of related molecules in macrophages by different treatments
2.3 巨噬细胞极化的表面分子分析
结果如图4 所示,LPS 能够显著诱导CD38 蛋白的表达并定位在细胞膜上。 本课题组也检测了作为M2 巨噬细胞的常用分子标记CD206 蛋白[1]。 结果显示,IL-4+IL-13 处理以及IL-10 处理能够增强其表达。 另外,LPS+IC 能够刺激LIGHT 蛋白的表达(图4)。 结果表明,在流式分析中,CD38 蛋白可作为M1 巨噬细胞特异性的分子标记;LIGHT 蛋白可作为M2b 巨噬细胞特异性的分子标记。
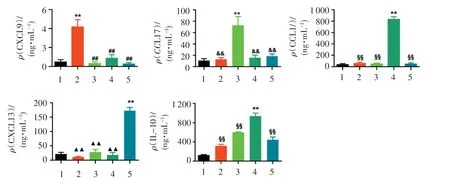
图3 不同处理对细胞培养上清中相关分子蛋白水平的变化的影响Figure 3 Changes of protein levels of related molecules in macrophages by different treatments
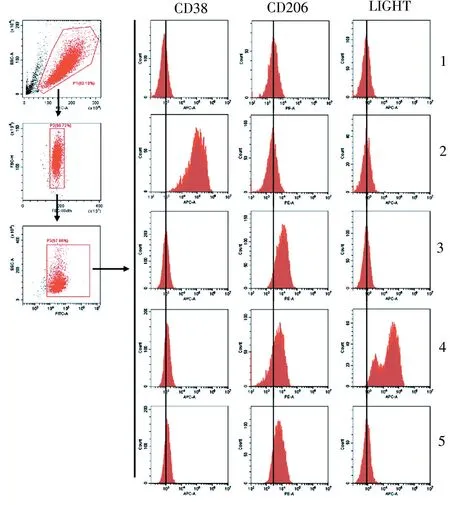
图4 流式细胞仪检测不同型别巨噬细胞中表面分子的表达Figure 4 Expressions of surface molecules in different macrophage subtypes by flow cytometry
2.4 不同刺激对细胞信号通路的影响
对信号通路相关蛋白的检测结果如图5 所示,LPS+INF-γ 以及LPS+IC 能够诱导p38 的活化;ERK蛋白在LPS+IC 处理下被激活;磷酸化的p65 蛋白在LPS+INF-γ 处理组中表达最高。
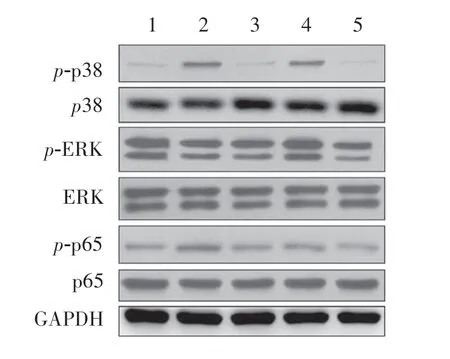
图5 不同刺激对细胞信号通路的影响Figure 5 Effect of different stimulation on cell signaling pathway
3 讨论
巨噬细胞因其在器官发育、内环境稳态的维持、组织修复、抵抗病原菌和肿瘤发生发展等方面扮演着重要作用而备受关注,成为研究热点[2]。 鉴于巨噬细胞几乎存在于所有的组织器官中[2],近年来的研究不仅从体内实验揭示其极化状态及功能,还从体外实验中研究其发挥作用的分子机制。 在体外实验中,LPS+INF-γ 诱导M1 型巨噬细胞,IL-4+IL-13诱导M2a 型巨噬细胞,LPS+IC 诱导M2b 型巨噬细胞以及IL-10 诱导M2c 型巨噬细胞的诱导方法是主流的极化方法[1,3-5,7]。 本研究证实,在体外实验中,CXCL9 和CD38 蛋白主要在M1 巨噬细胞中表达,CCL17 主要在M2a 巨噬细胞中表达,CCL1 和LIGHT 蛋白主要在M2b 巨噬细胞中表达, 而CXCL13 主要在M2c 巨噬细胞中表达。
CXCL9 属于CXC 趋化因子家族成员,可由包括巨噬细胞和T 淋巴细胞等免疫细胞以及内皮细胞等非免疫细胞合成和分泌,与靶细胞上的受体CXCR3 结合,在免疫细胞趋化中起重要作用[9-10]。M1 巨噬细胞可大量合成和分泌CXCL9,但考虑到其他细胞也可分泌CXCL9,在体内研究中一般不将CXCL9 作为M1 的分子标记[1,5,11]。 本研究证实,和其他几个组相比,在LPS +INF-γ 联合诱导组中,CXCL9 的mRNA 和蛋白质水平都显著升高。 这表明,在体外实验中,CXCL9 可指示巨噬细胞向M1 型方向极化。 和CXCL9 一样,CXCL13 也属于CXC 趋化因子家族成员,可由巨噬细胞和单核细胞等分泌,可与炎症免疫细胞上表达的CXCR5 结合,调控靶细胞的功能及趋化[12]。 文献报道M2c 巨噬细胞可分泌大量的CXCL13,并将其作为M2c 细胞的分子标记[1,4,11]。 本研 究 结 果 证 实,和 其 他 处 理 组 相 比,CXCL13 在IL-10 处理中的mRNA 和蛋白水平是最高的。
CCL1 是第1 个被发现的CC 趋化因子家族成员[1]。 除了单核细胞和巨噬细胞外,T 细胞、肥大细胞和DC 细胞都可以分泌CCL1[1]。 有研究显示,CCL1 不仅是M2b 巨噬细胞特异性分泌,而且也是其维持极化状态的关键因子[1,13]。 在本研究中,和其他几个处理组相比,LPS +IL 处理组中CCL1 的mRNA 和蛋白水平是最高的。 另外,作为CC 趋化因子家族的另一成员,CCL17 可由巨噬细胞、DC 细胞和成纤维细胞等分泌,与T 淋巴细胞上的CCR4结合,并诱导其趋化[14]。 研究显示,M2a 巨噬细胞可大量分泌CCL17[5,15]。 在本研究中,和其他几个处理相比,IL-4+IL-13 处理组中CCL17 的mRNA 和蛋白水平是最高的。
LIGHT,又被称为TNFSF14 或CD258,主要表达在T 淋巴细胞以及未成熟的DC 细胞上,发挥激活免疫细胞的作用[16]。 自从2006 年报道以来,越来越多的研究显示在区别不同极化巨噬细胞时,LIGHT 蛋白是M2b 巨噬细胞的特异性分子标记[1,13,17-18]。 本研究证实LIGHT 蛋白主要是在M2b巨噬细胞中表达。 结果提示,在体外实验中区别不同型别巨噬细胞时,LIGHT 可以将M2b 巨噬细胞鉴定出来。
CD38 是表达在巨噬细胞、单核细胞、NK 细胞等免疫细胞膜表面的一种蛋白分子,具有重要的生理和病理作用[19]。 最近研究显示,在不同型别的巨噬细胞中,CD38 蛋白主要在M1 巨噬细胞中表达[5,20]。 流式结果证实,CD38 蛋白主要是在M1 型巨噬细胞中表达。 这提示CD38 蛋白可以作为M1巨噬细胞流式检测的特异性分子标记。
IL-10 是一种具有强大抑炎功能的细胞因子,作为区别M1 和M2 巨噬细胞的分子标记已被广泛接受[1,3-4]。 但是,在高表达IL-10 的M2 巨噬细胞中,M2b 巨噬细胞表达量最高[5]。 另外,相对M2 巨噬细胞,M1 巨噬细胞表达IL-10 的水平是降低的,但和M0 巨噬细胞相比,其表达IL-10 的水平也是升高的[5]。 本研究也证实了这一点。 这表明,如果单独利用IL-10 鉴定其中一个型别,往往会产生误导。所以,如果想利用IL-10 作为巨噬细胞极化的一个分子标记,最好和其他分子标记一起使用。
综上,在体外实验中从mRNA 水平或/和蛋白水平上检测巨噬细胞的极化,可用CXCL9 作为M1 的特征性分子,CCL17 作为M2a 的特征性分子,CCL1 作为M2b 的特征性分子,CXCL13 作为M2c 的特征性分子;从流式检测的角度,可用CD38 蛋白作为M1 的特征性分子,LIGHT 作为M2b 的特征性分子。

