EMS诱变对茄子种子萌发、幼苗生长和抗氧化系统的影响
尚 静,张 会,王圣洁,王小玲,姜守阳,查丁石,吴雪霞*
(1.上海市农业科学院 设施园艺研究所,上海 201403;2.上海海洋大学 水产与生命科学院,上海 201306;3.上海乾德种业有限公司,上海 200235;4.上海农科种子种苗有限公司,上海 201106)
化学诱变育种是始于20世纪初的一种作物育种技术,通过诱变剂对植物DNA造成损伤和错误修复等,产生后代较为稳定的遗传突变体[1]。对分离后代进行突变体的选择和鉴定,育成可直接或间接利用的遗传稳定的品种[2]。化学诱变可操作性强,效率高,且成本低,无需特殊设备,因而已成为近几年来应用最为广泛的诱变技术[3]。化学诱变剂有1000多种。与其它诱变剂相比,甲基磺酸乙酯(EMS)具有诱变特异性强、频率高、范围广,且多产生显性突变体,易于筛选等特点,成为公认的应用最广、效果最好的化学诱变剂[4]。目前,EMS诱变技术在植物中应用广泛,现已在拟南芥[5]、小麦[6]、水稻[7]、马铃薯[8]、大豆[9]、油菜[10]等作物中构建了突变体库。这些突变体库不仅为深入研究基因组学提供了优良的材料,也为培育新品种提供了丰富的遗传资源。
茄子(SolanummelongenaL.)属茄科,原产于印度,是亚热带和热带地区常见蔬菜。茄子虽然形态多样,但其栽培种经过特定方向的不断选育,遗传背景相对狭窄[11]。此外,由于不同地区间的种质资源不断交流,现在茄子种质同质化严重,遗传多样性减少[12]。因此加强茄子种质资源创新,扩展其遗传基础对茄子新品种的选育具有重要意义。前人研究表明,通过化学和物理方法诱导突变是增加茄子遗传多样性的高效方法[13]。茄子突变体是培育新品种的潜在材料[14]。本研究以稳定遗传的茄子自交系为材料,探究了不同EMS浓度对茄子发芽率和幼苗生长的影响,从而获得了适宜的诱变处理;在此诱变基础上,我们进一步测定了茄子幼苗在两个半致死EMS处理下的生理指标,为建立茄子EMS诱变体系,进一步利用突变体材料进行种质创新奠定了基础。
1 材料与方法
1.1 供试材料
供试茄子材料为遗传稳定的茄子高代自交系‘8果’,由上海市农业科学院园艺所提供。其性状表现为:萼片绿色,果皮紫黑色,果实长棒形,光泽强,产量高,抗病性强,商品性优。本试验在上海市农业科学院园艺所完成。
选取颗粒饱满、无病变的茄子种子进行EMS诱变。EMS 购自美国Sigma公司(产品号M880-5g),其为水剂,微溶于水。用于化学诱变剂溶剂配制的化学药品为常规无机试剂 Na2HPO4和NaH2PO4,均购自上海国药集团化学试剂有限公司,产品纯度为化学纯。
磷酸缓冲溶液的准备:Na2HPO4配制500 mL溶液,需要35.82 g,命名为 A;NaH2PO4配制500 mL溶液,需要15.605 g,命名为 B。磷酸缓冲溶液(A∶B=61∶39)现配现用,用NaOH溶液将pH值微调至7。
1.2 试验方法
1.2.1 EMS诱变条件筛选,筛选半致死处理 试验设置EMS浓度6个、浸泡时间5个,共30个处理(见表1),每个处理3次重复,每个重复供试100粒种子。本试验步骤参照文献[15]中的方法并稍作修改,具体如下:
(1)诱变前处理:在25 ℃下将种子用水浸泡4~6 h,然后用吸水纸吸干,待用;
(2) 6个浓度EMS溶液的配制:在50 mL离心管中分别加入0、75、150、225、300、375 μL EMS溶液,再分别加入磷酸缓冲液15.000、14.925、14.850、14.775、14.700、14.625 mL,配制成体积分数分别为 0%、0.5%、1.0%、1.5%、2.0%、2.5%的EMS溶液;
(3)浸泡诱变处理:将经诱变前处理的待用种子放入配制好的EMS溶液中,将离心管封口并用锡纸包裹避光,防止EMS诱变剂见光分解。将离心管放于26 ℃、100 r/min的摇床内充分摇晃,每个EMS诱变浓度对应5个处理时间(4、6、8、10、12 h);
(4)诱变完成后处理:取出摇床中的离心管,先加入10 mL浓度为1 mol/L的Na2S2O3终止反应;再用20 mL浓度为0.100 mol/L的Na2S2O3洗3遍,每次轻摇5 min,倒掉溶液;最后用自来水冲洗3~4 h,洗净种子表面的残留物;
(5)统计发芽:将经诱变处理后的种子分别放入装有吸水纸的发芽盒中,加入无菌水,用吸水纸覆盖种子,避光放置于28 ℃的恒温培养箱里过夜催芽,直至种子发芽,期间每天记录种子发芽数。在第10天时统计种子发芽情况,计算种子发芽率,达到空白对照的发芽率50%的EMS处理剂量和处理时间为最佳处理,该处理为半致死EMS处理。
1.2.2 半致死EMS诱变处理对茄子幼苗生长的影响试验 EMS与水作用易产生有毒的化合物,会对植物造成生理损伤,导致植株不育[16]。根据1.2.1中的试验,筛选出0.5% EMS处理6 h和1.0% EMS处理4 h为最佳诱变处理,分别用S1和S2表示,即这2个处理对茄子种子产生诱变作用,又不会造成严重的毒害。选取0% EMS处理4 h的种子作为空白对照(CK),下文中提到的S1、S2、CK均与此处一致。在诱变处理第10天时计算不同处理的发芽率,对照(CK)供试100粒种子,重复6次;S1、S2每个处理供试200粒种子,6次重复。在第14天时测定幼苗的总长、幼苗鲜重,并取样测定幼苗的相关生理指标,每个处理10株,重复3次。
1.3 测定指标与方法
1.3.1 生长指标的测定 分别利用直尺和游标卡尺测量幼苗的株高(子叶节至生长点)、茎粗;吸干水分后称量幼苗鲜重。
1.3.2 生理指标的测定 丙二醛(MDA)含量、超氧阴离子(O2·-)产生速率和H2O2含量,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,脯氨酸(Pro)含量和可溶性蛋白质含量的测定均参照Wu等[17]的方法。
1.4 统计分析
采用Origin 7.5软件绘图,用SPSS统计软件中的Duncan’s新复极差法对试验平均数进行多重比较。
2 结果与分析
2.1 EMS诱变处理对茄子种子萌发的影响
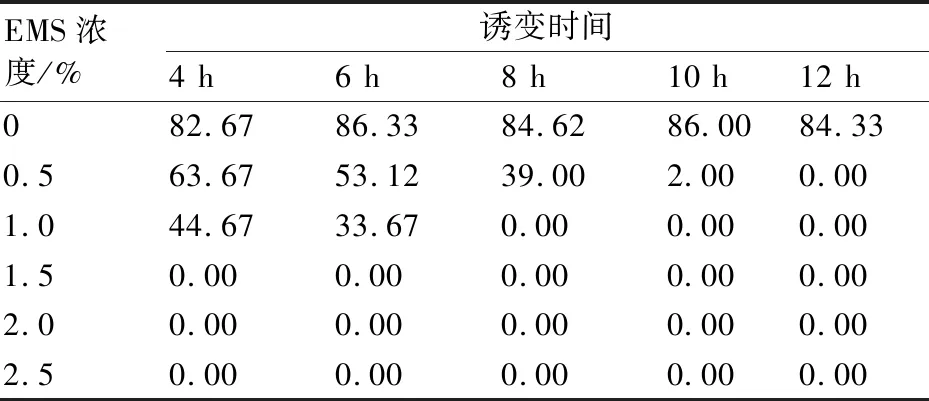
由表1和图1可见:当EMS浓度为0%时,茄子种子发芽率随处理时间的增加变化不明显,均在80%以上,故在分析半致死EMS处理对茄子种子萌发和幼苗生长的影响时,以0% EMS处理4 h为空白对照(CK);当EMS浓度为0.5%和1.0%时,发芽率随处理时间的增加均呈下降趋势;当EMS浓度≥1.5%时,处理时间从4 h至12 h,种子均不发芽。当EMS处理时间一定时,在EMS浓度0%~1.0%范围内,茄子种子的发芽率随着EMS浓度的增加均呈降低趋势。0.5% EMS处理6 h和1.0% EMS处理4 h,种子发芽率分别为53.12%、44.67%,约为CK的种子发芽率的1/2。因此,选择0.5% EMS处理6 h、1.0% EMS处理4 h为茄子种子的最佳诱变处理。为了保证试验结果的准确性, 此部分做了5次重复试验,虽然每次重复的试验结果有所差异,但基本趋势一致。
表1 不同EMS诱变处理下茄子种子的萌发率
%
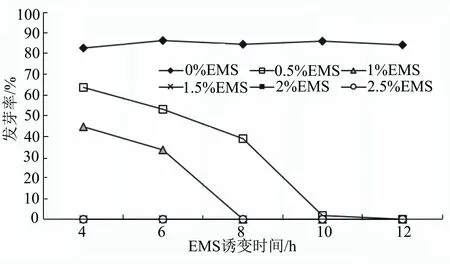
图1 不同EMS诱变处理对茄子种子萌发的影响
2.2 半致死EMS处理对茄子种子发芽和幼苗生长的影响
从表2可以看出,不同半致死EMS处理对茄子种子发芽和幼苗生长的影响程度不同。与CK相比,S1和S2处理的种子发芽率显著降低,分别降低了16.83和30.00个百分点;S1和S2处理对茄子的幼苗长度均无显著影响;S1处理对幼苗的鲜重无显著影响,但S2处理使茄子幼苗鲜重显著降低,较CK降低了14.30%;在S1和S2处理间茄子种子发芽率、幼苗长度和幼苗鲜重均无显著差异。
2.3 半致死EMS处理对茄子幼苗MDA含量、O2·-产生速率和H2O2含量的影响
由表3可知:与CK相比,在S1处理下的茄子幼苗丙二醛(MDA)含量、超氧阴离子(O2·-)产生速率和H2O2含量均无明显变化;S2处理的上述指标均较CK显著增加,分别增加了26.04%、13.23%、28.91%;S2处理的上述指标均显著高于S1处理。
2.4 半致死EMS处理对茄子幼苗酶活性的影响
由表4可以看出:与CK相比,S1处理的茄子幼苗超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性无显著变化,过氧化物酶(POD)活性显著提高;S2处理的SOD、POD和CAT活性均较CK显著提高,分别提高了14.39%、25.31%和18.41%;在S1和S2处理间SOD活性和POD活性无显著差异,但S2处理的CAT活性显著高于S1处理。
2.5 半致死EMS处理对茄子幼苗脯氨酸和可溶性蛋白质含量的影响
从表5可以看出:与CK相比,S1和S2处理下茄子幼苗脯氨酸含量均无显著变化;S1处理下茄子幼苗可溶性蛋白质含量无显著变化;S2处理使茄子幼苗可溶性蛋白质含量显著升高,较CK升高了36.97%;在S1和S2处理间可溶性蛋白质含量差异显著,但脯氨酸含量差异不显著。

表2 半致死EMS诱变处理对茄子种子发芽和幼苗生长的影响
注:同列数据后附不同小写字母表示差异达5%显著水平。下同。
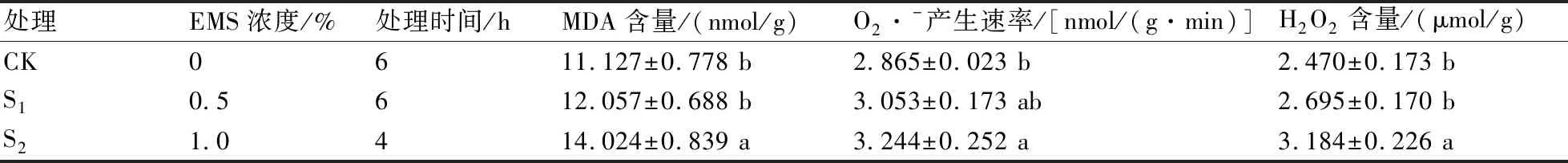
表3 半致死EMS处理对茄子幼苗MDA含量、O2·-产生速率和H2O2含量(鲜重)的影响

表4 半致死EMS处理对茄子幼苗酶活性的影响

表5 半致死EMS处理对茄子幼苗脯氨酸和可溶性蛋白质含量的影响
3 讨论
不同植物对EMS的耐受程度不同,因此对EMS浓度和诱变时间进行筛选是构建茄子EMS突变体库的前提。任婷婷等[18]的研究表明,EMS 浓度越高、诱变时间越长,对植物组织造成的伤害越大,产生的突变也会越多,但植物也会因为损伤过度而死亡;反之,诱变剂量太低和诱变时间不够则会导致突变减少,构建饱和突变体库需要的群体就会增大,从而会增加成本,降低筛选效率。本试验研究结果表明:当EMS浓度(>0%)一定时,茄子种子的发芽率随处理时间的增加呈下降趋势;当处理时间一定时,随着EMS浓度的增加,茄子种子的发芽率呈递减趋势,且当浓度≥1.5%时,种子均不发芽,并出现不同程度的腐烂,表明过高的EMS浓度会对茄子种子产生毒害作用,从而抑制其萌发,最终致其死亡。这与张雨桐等[19]在对直立型扁蓿豆种子进行诱变时得出的结论相似。
半致死剂量既是确定试验材料对EMS敏感性的主要指标,也是EMS化学诱变剂量的应用参考,以种子的相对发芽率为50%时的诱导剂量为半致死剂量[20]。在茄科蔬菜中,汪斌[21]在用甲基磺酸乙酯(EMS)对加工番茄进行诱变时,根据种子发芽率、发芽势、发芽指数分析认为:EMS诱变加工番茄“JW9”的半致死剂量为3%处理10 h。周书栋等[22]在分析EMS处理对辣椒种子萌发和幼苗生理特性的影响时,发现1.0% EMS处理下的辣椒种子发芽率和幼苗存活率均接近半致死剂量下的。在本试验中,用0.5% EMS处理6 h和用1.0% EMS处理4 h,茄子种子的发芽率约为对照组发芽率(82.67%)的1/2。
EMS对植物的诱变作用可能会降低植物体对活性氧(O2·-、H2O2)的防御能力,对种子的毒害可能是由活性氧过剩导致。在本试验中的S1处理下,茄子种子MDA含量、O2·-产生速率和H2O2含量与CK相比均无明显变化;但S2处理的上述指标均显著增加,表明膜脂过氧化程度加剧,细胞膜透性增加,细胞内含物流失加剧。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)是植物体内主要的抗氧化酶,受到的毒害作用越深,活性氧含量越高,抗氧化酶活性相应增高,用于清除活性氧,这是植物体对自身的重要保护机制[23]。与CK相比,S1处理的茄子幼苗SOD和CAT活性无显著变化,POD活性显著提高,S2处理的上述3种酶活性均显著提高。
脯氨酸和可溶性蛋白质的积累,有助于植物应对不利环境。本试验结果表明:与CK相比,S1和S2处理下茄子幼苗脯氨酸含量均无显著变化;S1处理下茄子幼苗可溶性蛋白质含量无显著变化,S2处理使茄子幼苗可溶性蛋白质含量显著降低。说明半致死 S2处理比S1处理对茄子的毒害作用大。S2处理的EMS浓度高于S1处理,但处理时间少于S1处理,猜测用EMS处理茄子种子时,浓度升高比时间延长对其伤害更大。这与何慧怡等[24]在EMS诱变甘蔗愈伤组织的试验中得出的结论相似。
我们只针对EMS诱变的浓度和时间组合对茄子种子萌发和幼苗生长的影响做了研究,初步探索出了适合诱变茄子种子的EMS浓度和时间组合,可为今后建立茄子突变体库、丰富茄子育种材料及加快茄子育种进程提供参考。但如何对诱变后的植株进行鉴定分析,如何筛选具有目的性状的变异植株,需要进一步探究。

