捻转血矛线虫GST耐药基因的克隆、表达及生物信息学分析
赵学亮 孙 柯 苏 倩 呼和巴特尔 王文龙
(内蒙古农业大学 兽医学院/农业农村部动物疾病临床诊疗技术重点实验室,呼和浩特 010018)
捻转血矛线虫(Haemonchuscontortus)是毛圆科血矛属的一种消化道线虫,主要寄生在绵羊、山羊、牛等反刍动物的皱胃,偶见于小肠[1]。该病分布广泛,给畜牧业,尤其是热带、亚热带及降雨量较多的地区养殖业带来严重威胁[2]。国内外对捻转血矛线虫病主要采用丙硫咪唑等化学药物防治,然而随着该类驱虫药物的使用,捻转血矛线虫的耐药现象逐渐凸显。van Wyk等[3]于1986年首次报道捻转血矛线虫对丙硫咪唑等驱虫药物的耐药性。随后的几十年内,捻转血矛线虫耐药性已在世界范围内广泛得到报道[4]。因此,在捻转血矛线虫耐药检测方法和耐药机制研究显得尤为重要。
丙硫咪唑能与捻转血矛线虫β-微管蛋白亚基结合,阻断β-微管组装,使虫体发育代谢障碍,从而导致虫体死亡。据报道捻转血矛线虫对丙硫咪唑产生耐药性的主要原因是由于β-微管蛋白同种型Ⅰ基因的突变(F167Y,E198A和F200Y),导致该蛋白结构改变,使药物不能与其靶位点结合而失去作用[5]。但由于寄生虫等真核生物复杂的耐药机制,耐药性的产生可能存在多种原因[6],耐药机制尚待进一步研究。
谷胱甘肽S转移酶(Glutathione S-transferase,GST)于20世纪60年代在大鼠肝脏中首次被发现,是生物体内最重要的解毒酶系之一。GST能催化亲电性有害物质与还原型谷胱甘肽结合发挥解毒功能,对生物体代谢内源性和外源性化合物起着重要作用[7]。而GST在寄生虫耐药性、细菌耐药性都发挥着主导作用[8-9]。因此本试验基于转录组测序分析的基础上,拟筛选出与耐药相关的GST基因[10]。通过对捻转血矛线虫GST蛋白结构序列、抗原表位进行预测分析,探究原核表达系统最佳诱导表达条件,以期获得稳定的纯化GST重组蛋白,为探究捻转血矛线虫耐药机制和免疫防控提供依据。
1 材料与方法
1.1 虫株及质粒
捻转血矛线虫丙硫咪唑敏感株(HC)和耐药株(HC-BZ)均在液氮中保存,用于RNA的提取。克隆载体pMD19-T simple vector,购自大连宝生物工程有限公司;表达载体pET30a(+)在本实验室保存。
1.2 试剂及仪器
Trizol试剂、反转录试剂盒、限制性内切酶EcoR Ⅰ、XhoⅠ等均购自TaKaRa公司;质粒抽提试剂盒、胶回收试剂盒购自AXYGEN公司;Ni+蛋白纯化试剂盒购自上海生工;氯仿、异丙醇均为国产分析纯。核酸浓度测定仪(Thermo NanoDrop 2000,美国)、凝胶影像仪(赛智创业科技有限公司,北京)。
1.3 Total RNA提取及cDNA合成
将组织样品在液氮中取出,放入预冷的研钵中研磨,然后加入Trizol,提取捻转血矛线虫总RNA。将获得的总RNA进行浓度、纯度检测后,利用反转录试剂盒合成cDNA。
1.4 GST基因扩增
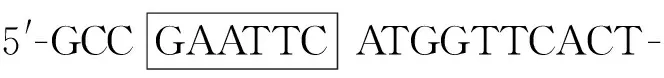
1.5 GST基因克隆及测序
用胶回收试剂盒回收PCR产物,将目的片段3’末端添加“A尾”,然后与克隆载体pMD19-T过夜连接,转化至Trans1-T1感受态细胞中,过夜培养。将阳性菌株送华大基因公司进行测序,测序结果正确的质粒命名为pMD19T-GST。
1.6 GST基因原核表达载体构建
将pMD19T-GST和表达载体pET30a(+)分别用限制酶EcoR Ⅰ和XhoⅠ进行双酶切,回收目的基因和载体片段,T4连接酶过夜连接,转化至E.coliDH5α感受态细胞,过夜培养后进行PCR和双酶切鉴定,阳性菌株送华大基因公司进行双向测序,测序结果正确的质粒命名为pET30a(+)-GST。
1.7 GST蛋白表达条件优化
将测序正确的重组表达菌BL21(pETGST)接种于10 mL含Kan抗性的LB液体培养基中,37 ℃过夜培养,对重组表达菌BL21(pETGST)进行温度、时间和IPTG诱导浓度表达条件优化。温度优化,将温度分为20、25、30和37 ℃不同梯度,在摇床中180 r/min培养6 h。时间优化,分别在0、1、2、3、4、6、7、8和9 h时间点各取2 mL菌液,37 ℃,180 r/min 培养。IPTG浓度优化,浓度梯度分别为0.05、0.1、0.2、0.6、1.0、2.0和4.0 mmol/L,37 ℃,180 r/min培养6 h。离心收菌,按照不同的OD值加入相应量的PBS,然后加入蛋白上样缓冲液,煮沸10 min裂解变性,用12% SDS-PAGE凝胶电泳检测。
1.8 重组蛋白表达形式鉴定
按照最佳诱导条件分别诱导100 mL重组表达菌液,低温超速离心收集菌液沉淀,然后超声破碎,12 000 r/min低温离心15 min,分别收集上清和沉淀,煮沸10 min裂解变性,用12% SDS-PAGE凝胶电泳进行表达形式检测。
1.9 重组表达菌pET30a-GST的纯化
按照1.8方法收集上清和沉淀,并利用8 M尿素充分溶解沉淀,然后离心收集上清,用0.45 μm孔径的滤器过滤,然后按照上海生工Ni+说明书纯化蛋白。
1.10 GST基因生物信息分析
利用蛋白质在线分析工具Prot-Param(https:∥web.expasy.org/protparam/)分析GST蛋白质的理化性质(氨基酸组成,分子质量,不稳定系数、等电点等);利用ProtScale(https:∥web.expasy.org/protscale/)分析GST蛋白的亲水性和疏水性[11];利用SignalP 4.0 Server(http:∥www.cbs.dtu.dk/services/SignalP-4.0/)预测GST蛋白的信号肽[12];利用TMHMM Server(http:∥www.cbs.dtu.dk/services/TMHMM/)预测GST蛋白的跨膜区[13];利用NetPhos3.1 Server(http:∥www.cbs.dtu.dk/services/NetPhos/)预测GST蛋白的磷酸化位点[14];利用在线软件SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测GST蛋白的二级结构[15];利用在线软件SWISS-MODEL(https:∥swissmodel.expasy.org/)预测GST蛋白的三级结构[16];利用Conserved domains(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对GST蛋白进行保守结构域预测分析[17];利用DNAStar分析GST蛋白B细胞抗原表位等。
2 结果与分析
2.1 GST基因扩增、克隆及测序
PCR扩增捻转血矛线虫GST基因,经1%的琼脂糖凝胶电泳检测,结果显示在618 bp处扩增出条带,片段长度与预期片段大小一致(图1)。
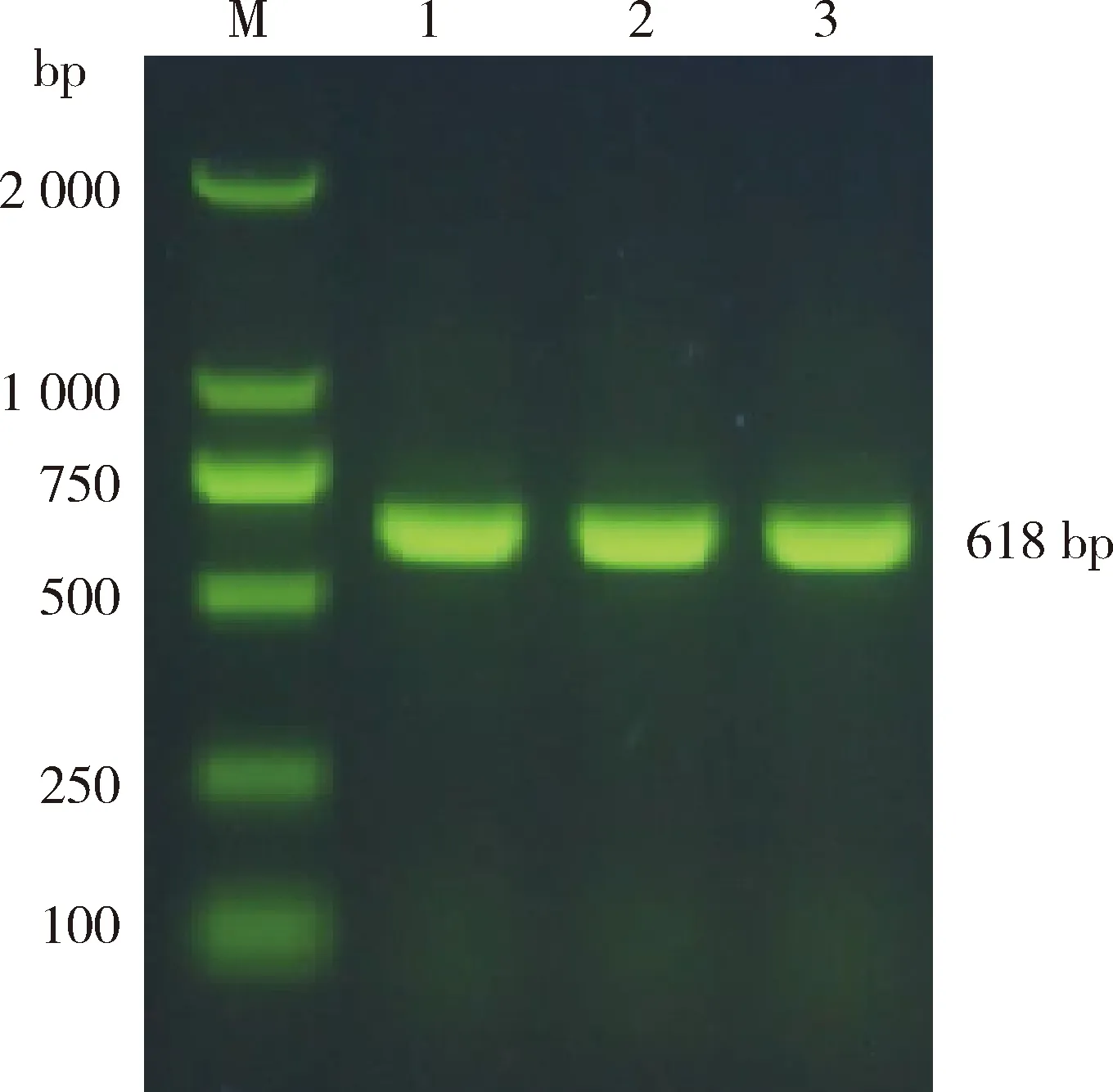
M,DNA 标准DL2000;1~3,GST基因的扩增产物。
M, DL2000 DNA Marker; 1-3, products ofGSTgene.
图1 捻转血矛线虫GST基因PCR扩增结果
Fig.1 PCR amplification results ofGSTgene ofHaemonchuscontortus
2.2 重组表达载体的构建与鉴定
将测序正确的菌液提取质粒,限制性内切酶XhoⅠ和EcoR Ⅰ进行双酶切,结果显示,分别出现在大小为618 bp和5 422 bp的条带,表明目的片段插入到表达载体pET30a中,成功构建重组质粒(图2)。
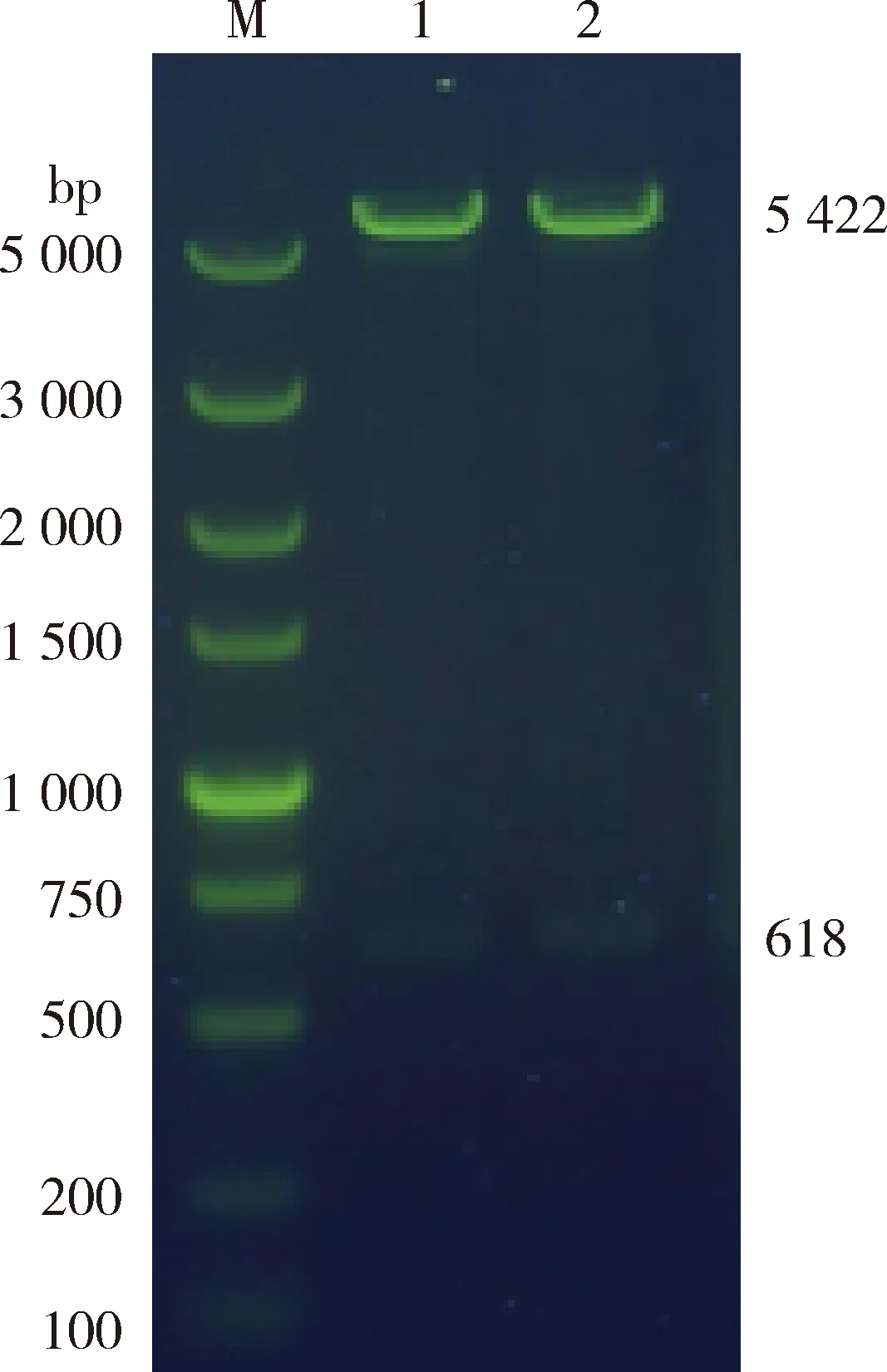
M,DNA标准DL5000;1~2,pET30-GST的双酶切产物。
M, DL5000 DNA Marker; 1-2, double restriction enzyme digestion products of pET30-GST.
图2 重组质粒pET30-GST的双酶切鉴定
Fig.2 Identification result of recombinant plasmid pET30a (+)-GST byXhoⅠ andEcoR Ⅰ digestion
2.3 重组蛋白表达条件优化
对重组表达菌BL21(pETGST)进行诱导表达温度、时间和IPTG浓度优化,结果显示,4个不同温度下诱导后的重组表达菌均在29 ku诱导出条带,在37 ℃时的蛋白表达量最高(图3)。9个不同时间下诱导后的重组表达菌均在29 ku诱导出条带,表达量随着诱导时间的增加而增加,在6 h时表达量达到最高(图4)。7 个不同IPTG浓度优化梯度下诱导后的重组表达菌均在29 ku诱导出条带,但表达量和OD600 nm值均没有显著差异,表明IPTG浓度对重组表达菌影响较小,所以选择IPTG终浓度0.05 mmol/L为IPTG的最佳诱导浓度(图5)。至此,成功对重组蛋白表达条件进行优化,最佳诱导条件为37 ℃、6 h、IPTG浓度0.05 mmol/L。

M1,protein maker (10~180 ku);M2,protein maker (14.3~97.2 ku);1,BL21 (DE3)对照;2,诱导后pET30;3,诱导前pET30;4~7,BL21 (pETGST) 20,25,30和37 ℃诱导表达。
M1, protein maker (10-180 ku); M2, protein maker (14.3-97.2 ku); 1, BL21(DE3); 2, pET30 after induction; 3, pET30 before induction; 4-7, BL21 (pETGST) induced expression at 20, 25, 30 and 37 ℃, respectively.
图3 重组基因BL21(pETGST)诱导温度优化结果
Fig.3 Expression of recombinant gene BL21 (pETGST) under different temperatures by SDS-PAGE
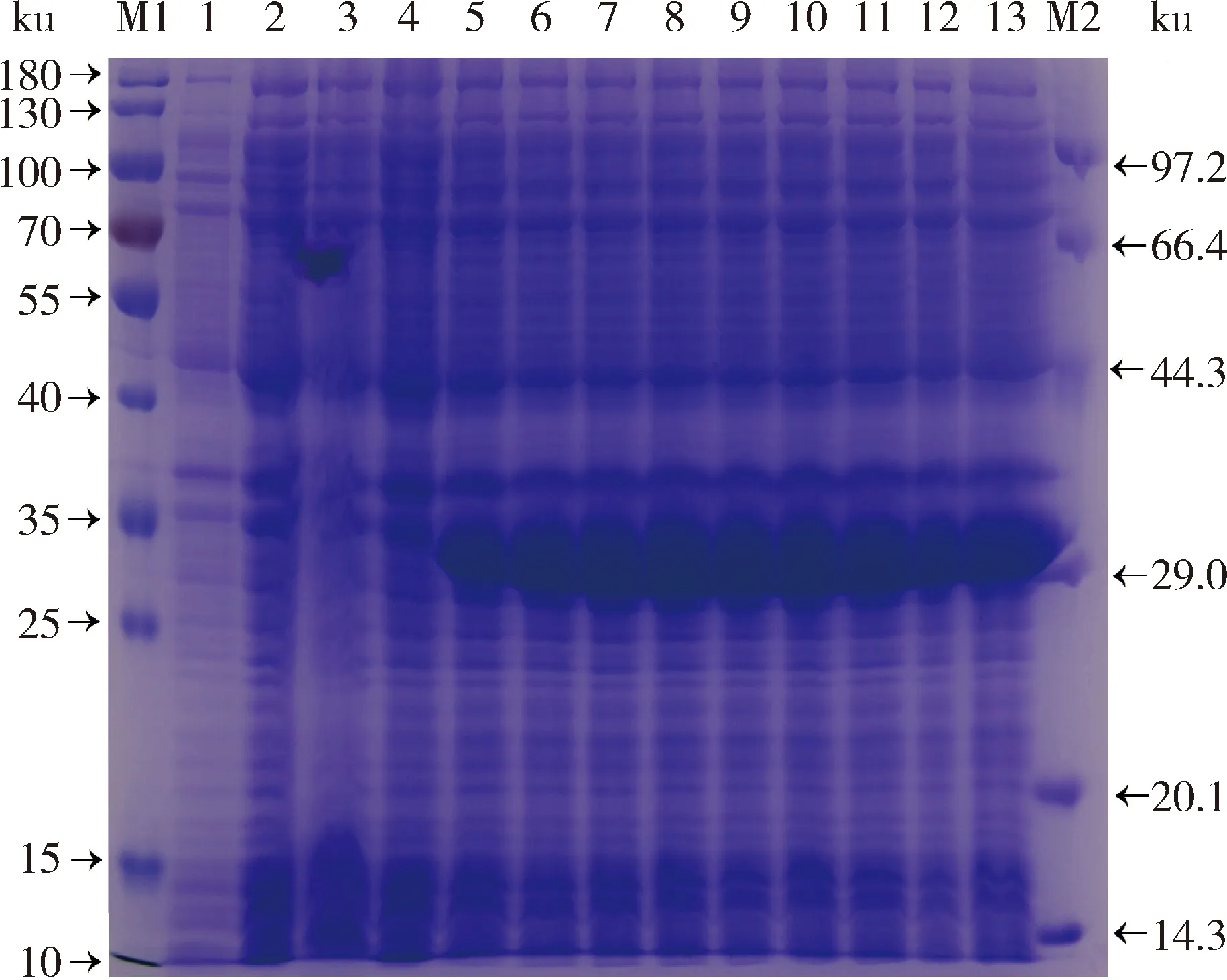
M1,protein maker (10-180 ku);M2,protein maker (14.3~97.2 ku);1,BL21(DE3)对照;2,诱导后pET30;3,诱导前pET30;4~13,BL21 (pETGST)在 0,1,2,3,4,5,6,7,8和9 h时的诱导表达 M1, protein maker (10-180 ku); M2, protein maker (14.3-97.2 ku); 1, BL21(DE3); 2, pET30 after induction; 3, pET30 before induction; 4-13. BL21 (pETGST) induced at 0, 1, 2, 3, 4 5, 6, 7, 8 and 9 h, respectively.
图4 重组基因BL21(pETGST)诱导时间优化结果
Fig.4 Expression of recombinant gene BL21 (pETGST) under different temperatures by SDS-PAGE

M1,protein maker (10~180 ku);M2,protein maker (14.3~97.2 ku);1,BL21(DE3)对照;2,诱导后pET30;3,诱导前pET30;4,诱导前BL21(pETGST);5~11,BL21 (pETGST)在 0.05,0.1,0.2,0.6,1.0,2.0和4.0 mmol/L时的诱导表达。
M1, protein maker (10-180 ku); M2, protein maker (14.3-97.2 ku); 1, BL21(DE3);2, pET30 after induction;3, pET30 before induction;4, BL21 (pETGST) before induction; 5-11, The expression production of IPTG concentration with 0.05, 0.1, 0.2; 0.6; 1.0, 2.0, 4.0 mmol/L, respectively.
图5 重组基因BL21(pETGST) IPTG诱导浓度优化结果
Fig.5 Expression of recombinant gene BL21 (pETGST) under different IPTG concentrations
2.4 重组蛋白表达形式鉴定
利用最佳优化条件(37 ℃、6 h、0.05 mmol/L)对重组表达菌进行大量诱导表达,然后经12%的SDS-PAGE凝胶电泳进行表达形式鉴定。结果显示,重组蛋白rGST以包涵体的形式存在(图6)。
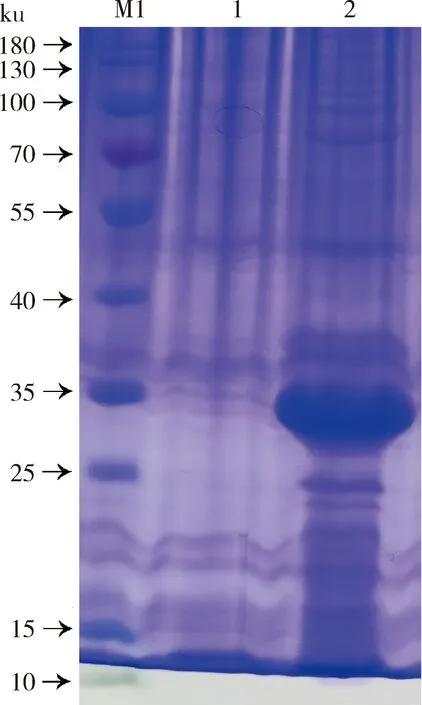
M1,protein maker(10~180 ku);1,rGST上清;2,rGST沉淀。
M1, protein maker (10-180 ku); 1,rGST supernatant; 2, rGST precipitation.
图6 重组蛋白表达形式鉴定
Fig.6 Detection of expression products of recombinant protein
2.5 重组蛋白纯化
利用8 mol/L尿素溶解包涵体沉淀,离心后收集上清,然后用0.45 μm滤器过滤后与Ni+柱过夜结合,根据蛋白纯化说明书获得较纯的蛋白。经SDS-PAGE结果显示,目的蛋白条带大小约为29 ku,与预期大小一致(图7)。
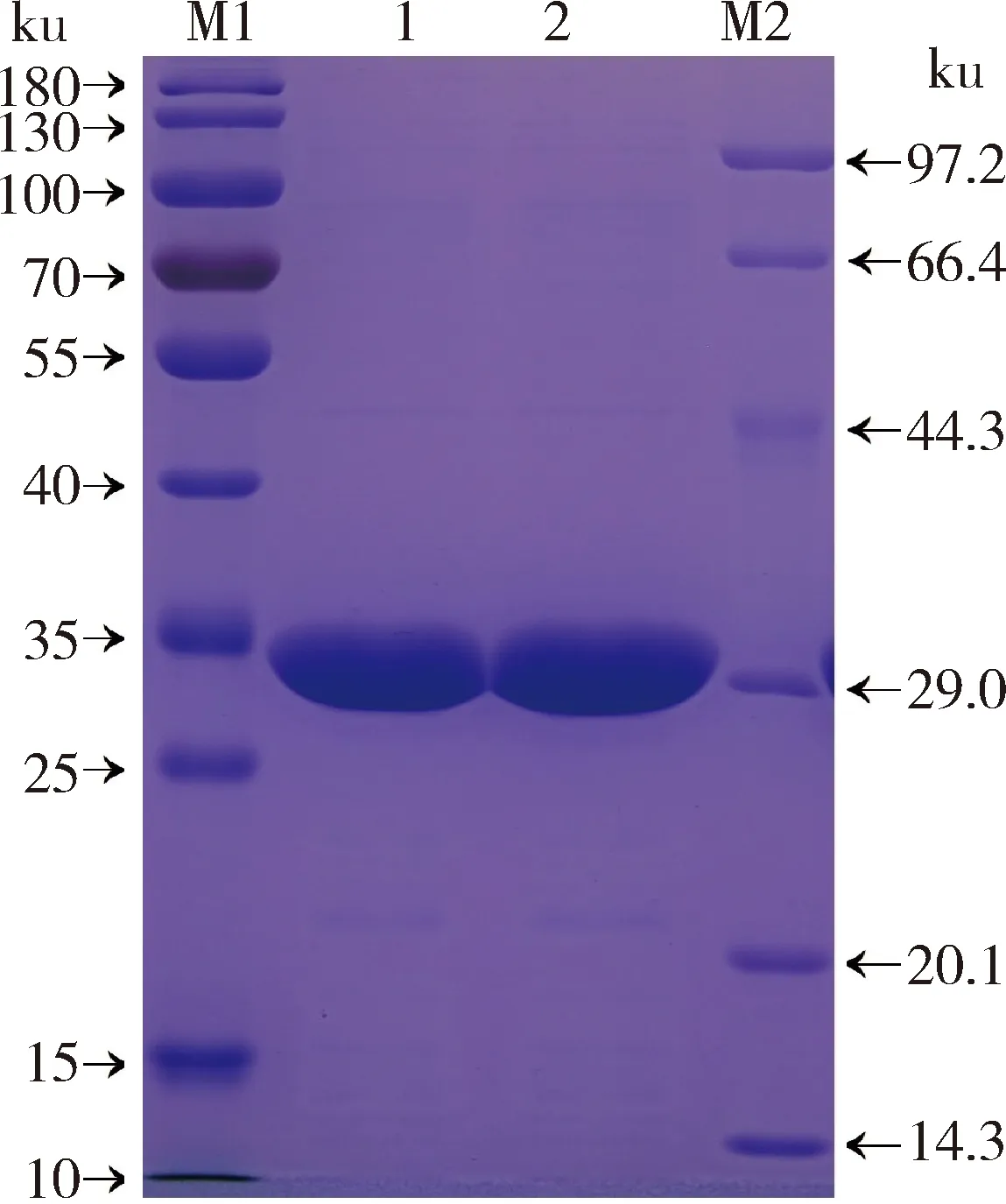
M1,protein maker (10~180 ku);M2,protein maker (14.3~97.2 ku);1~2,rGST纯化。
M1, protein maker (10-180 ku); M2, protein maker (14.3-97.2 ku); 1-2, rGST purification.
图7 重组蛋白纯化结果
Fig.7 Result of recombinant protein purification
2.6 GST基因编码蛋白的生物信息学分析
利用Port-Param在线软件分析GST蛋白的一级结构,结果表明,GST基因序列长618 bp,编码205个氨基酸,分子式为C1083H1657N277O294S6,理论等电点为9.53,包含20种氨基酸,其中含量最高的是Lys占10.2%,含量最低的是Cys占1.0%;蛋白质不稳定指数为34.80,属于稳定蛋白;脂肪系数为83.32;总平均亲水指数为-0.256,是亲水性蛋白。亲水性预测分析表明,该蛋白在氨基酸第31位点存在最小值-2.51,亲水性较强,在氨基酸第136位点存在最大值1.83,疏水性较强。跨膜区和信号肽预测表明该蛋白不含有跨膜区和信号肽。磷酸化位点预测表明,GST蛋白共含有12个磷酸化位点,含有苏氨酸位点最多,酪氨酸位点最少。二级结构预测显示,α螺旋含量最多,共有106个,占GST蛋白二级结构的51.71%;β转角含量最少,共有11个,占GST蛋白二级结构的5.37%(图8)。SWISS-MODEL三级结构预测显示,GST蛋白与1zl9.1.A同源性最高,为57.14%,GMQE值为0.81,趋近于1,建模质量较好,表明所得结果可靠(图9)。结构功能域预测发现,GST蛋白在4~73位氨基酸有一个GST_N_Sigma结构域,是GST同源区结合位点,属于PTZ00057超家族成员。抗原表位预测显示,GST蛋白含有较多潜在的B细胞抗原肽表位,主要位于25~48,55~63,92~106,113~124,139~147,170~189,195~205位氨基酸残基或其附近,提示这些区段含有潜在优势抗原表位。

h,α-螺旋;e,延伸链;t,β-转角;c,自由卷曲 h, alpha helix; e, extended strand; t, beta turn; c, random coil
图8 GST蛋白二级结构预测
Fig.8 Secondary structure prediction of GST protein
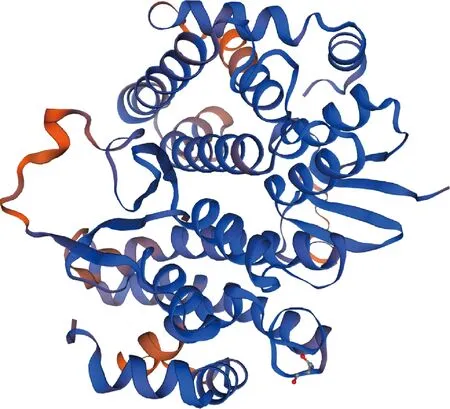
图9 GST蛋白三级结构预测
Fig.9 Tertiary structure prediction of GST protein
3 讨论与结论
中国是捻转血矛线虫的主要流行国家之一。目前,对该病的防治几乎主要依靠丙硫咪唑、伊维菌素等化学驱虫药,但长期重复使用,导致耐药株不断出现。本课题组在2017—2019年对内蒙古绵羊捻转血矛线虫进行流行病学调查及耐药性检测时发现,捻转血矛线虫感染率已达到78%~89%,且耐药现象十分严重[10],给捻转血矛线虫病的防治带来巨大困难。因此,寻找新的药物靶点和探索耐药机理对捻转血矛线虫的防控及避免耐药性的产生具有重要意义。本研究基于转录组数据筛选出的耐药基因GST,对其进行原核表达及生物信息学分析,成功的表达了pET30a(+)-GST重组蛋白,并分析了该蛋白的结构和功能。SDS-PAGE分析显示,rGST在诱导表达后的6 h达到最大表达量,不同温度对重组表达菌表达量的影响较大,rGST在诱导温度为37 ℃时达到最大表达量,IPTG诱导显示,rGST在0.05~4.0 mmol/L诱导下均得到了表达,且表达量无显著差异,选择浓度较小的0.05 mmol/L作为IPTG的最佳诱导浓度。另外,该蛋白以包涵体形式表达,利用Ni+柱对其进行纯化时发现,200、250和300 mmol/L咪唑均可将GST蛋白洗脱,且纯度较高。
随着后基因组时代的到来,生物信息学技术已成为生命科学领域研究的重要工具之一。分析蛋白质理化性质、预测蛋白质结构及抗原表位,对解析基因的结构、功能及筛选药物靶点候选分子具有重要的意义。本研究利用在线软件对GST蛋白进行预测。生物信息学分析表明,GST蛋白具有完整的ORF,编码360个氨基酸,理论等电点pI为9.53,共3 317个原子,分子式为C1083H1657N277O294S6,属于稳定的亲水性蛋白,亲水性蛋白有利于蛋白的高效表达,利于抗原抗体的嵌合。跨膜区和信号肽预测表明,该蛋白不含有跨膜区和信号肽,属于膜外蛋白,推测该蛋白可能在细胞合成后直接发挥生物学作用。磷酸化位点预测表明,当潜在磷酸化位点的阈值为0.5时,该蛋白含有12个磷酸化位点,其中4个丝氨酸位点,6个苏氨酸位点,2个酪氨酸位点。二级结构预测表明,α-螺旋是构成二级结构的主要成分。三级结构预测表明,GMQE值为0.81,趋近于1,且具备典型结构。近年来,随着生物信息学的快速发展,表位疫苗已成为疫苗研究的热点,因此对抗原表位的预测具有重要的意义。抗原表位预测表明,GST蛋白含有较多的B细胞抗原表位,具有较好的抗原性,与Liu等[18]旋毛虫GST蛋白上的研究一致。
GST是生物体内一类重要的解毒酶系,在药物作用下该基因常发挥其解毒功能,保护机体不受外界选择压力的伤害。该蛋白在耐药性中发挥着重要的作用,Sevastos等[19]研究表明,在禾谷镰刀菌中GST基因介导丙硫咪唑药物的耐药;Sayani等[20]研究发现,GST基因在小菜蛾氰戊菊酯耐药株的表达量是敏感株的9.5倍,证实了伊朗地区小菜蛾对杀虫剂的抗性机制与GST有关;Kamita[21]等研究发现蚊子对菊酯类药物的耐药性增加,与GST基因的表达量上调有关。本研究发现,GST基因在捻转血矛线虫也具有类似生物学功能,可能在响应丙硫咪唑选择压力过程中发挥着重要作用。对GST功能和结构的深入探讨不仅有助于了解虫体对丙硫咪唑的耐药机制,也可为捻转血矛线虫耐药性早期检测提供参考。
本研究成功构建了捻转血矛线虫GST基因原核表达系统,并对表达条件进行优化,获得了GST重组蛋白;结构分析发现,蛋白质无跨膜区和信号肽,α-螺旋是构成二级结构的主要成分;抗原表位预测表明,GST蛋白是一种含有7个较好抗原表位的亲水性蛋白。推测GST基因有望用作捻转血矛线虫耐药性诊断抗原和疫苗候选抗原。

