水分调控下旱地土壤中毒死蜱的消解研究
丛 鑫, 王冬琦, 邓艳玲, 刘寒冰, 薛南冬*
1.辽宁工程技术大学环境科学与工程学院, 辽宁 阜新 123000 2.中国环境科学研究院, 北京 100012
毒死蜱是一种广谱、高效有机磷杀虫剂,常用于玉米、小麦、水稻、蔬菜和果树等作物害虫防治. 在我国旱地农业中,毒死蜱施用尤为广泛[1]. 然而作用于靶标生物的毒死蜱不足施加量的1%,其大部分进入了环境中,其中土壤是毒死蜱在环境中的主要归宿[2-4]. 毒死蜱在土壤中可进行物理、化学和生物降解,主要降解产物有TCP (3,5,6-三氯-2-吡啶酚)和DETP (O,O-二乙基硫代磷酸酯),其中DETP可以直接被生物利用生成硫代磷酸和乙醇[5],而TCP由于具有较强的抗菌活性降解较慢,因此毒死蜱在土壤中的降解产物以TCP为主[6]. 毒死蜱在防治病虫害的同时也对人体健康产生风险,研究[7]表明,毒死蜱主要通过抑制乙酰胆碱酯酶的活性来影响人体神经系统,严重时还可引发新生儿缺陷和癌症[8];另有研究[9-10]表明,TCP的生物毒性强于母体毒死蜱,且二者存在协同效应,因此土壤中毒死蜱及TCP的环境行为日益受到重视.
土壤中毒死蜱的消解速率决定了其对环境风险的大小. 目前,已有大量关于毒死蜱在作物中残留及在土壤中消解的动态报道[11-13],但关于农艺调控措施对土壤中毒死蜱消解影响的研究较少. 研究[14-15]表明,毒死蜱在不同土壤中的消解速率不同,农田土壤中毒死蜱的半衰期为2~145 d. 毒死蜱的半衰期与是否种植作物及种植作物种类有关,种植作物土壤中毒死蜱的半衰期较短,且作物种类不同,半衰期也有差异[16-19]. 此外,土壤中毒死蜱的消解还受微生物和环境因素(如土壤温度、pH、有机质含量等)的影响[20-22]. 根据旱地作物需水特性和干旱区域的气候特点,适时灌溉是确保旱地农业丰收的基本措施,但不同的水量灌溉会引起土壤条件和土壤理化性质的变化,可能改变毒死蜱的迁移、吸附解吸和消解等环境行为而带来生态风险[23]. 土壤中毒死蜱主要通过非生物降解(光解)和生物降解(微生物降解)作用来进行转化和消解,而毒死蜱生物降解的第一步属于水解反应,土壤中的水解途径以碱性水解为主[24]. 可见,土壤水分条件是影响旱地土壤中毒死蜱消解的重要因素. 为研究不同水分调控条件下旱地土壤中毒死蜱的消解特性,该研究选取北方旱地常见作物玉米、大豆和小麦为目标农作物,研究不同水分条件下毒死蜱及TCP在作物种植土壤中的消解行为,探讨水分调控下影响毒死蜱消解速率的关键因素,以期为降低毒死蜱在北方旱地土壤中的生态环境风险提供依据.
1 材料与方法
1.1 主要仪器与试剂
高效液相色谱仪(LC-20AT,日本岛津公司);C18反相色谱柱〔Syncronis (250 mm× 4.6 mm×5 μm),美国Thermo Fisher Scientific公司〕;TOCTN分析仪(MultiNC 3100,德国耶拿分析仪器股份公司);土壤水分测定仪(XM60,瑞士普利赛斯公司).
标准品毒死蜱(99.6%),标准品TCP (99.8%)均购自美国AccuStandard公司;40%毒死蜱乳油购自深圳诺普信农化股份有限公司;甲醇、乙酸乙酯均为色谱纯,购自上海安谱科学仪器有限公司;氯化钙、氯化钾、乙酸、活性炭和过氧化氢均为分析纯,购自国药集团化学试剂有限公司;氯化钠、氢氧化钠和次氯酸钠为分析纯,购自天津市光复科技发展有限公司.
1.2 样品前处理与检测
供试土壤采自北京市顺义区(40°11′N、116°35′E)旱地农田(0~20 cm),土壤类型为潮土. 采集的土壤经去除碎石、树枝等杂物,自然风干,过2 mm网筛后备用. 土壤pH为7.16(水土质量比为2.5∶1),含水率为3.19%,田间持水量为21.35%,w(有机质)为1.15%,w(TN)为0.08%,土壤中未检出毒死蜱及TCP.
供试作物为玉米(品种:京单28)、大豆(品种:中黄38号)和小麦(品种:春硕18). 将玉米、大豆、小麦种子置于阴暗处,使用3%的H2O2浸泡15 min消毒,经自来水冲洗数遍以去除残留的H2O2,再用去离子水冲洗2~3遍,用滤纸拭干后置于底部垫有纱布的培养皿中,加入适量去离子水后置于黑暗的培养箱中催芽.
土壤中毒死蜱及TCP的分析方法:称取15 g土壤样品于250 mL锥形瓶中,加入50 mL乙酸乙酯-乙酸混合液(乙酸乙酯、乙酸、超纯水的体积比为98∶1∶1),在200 rmin下振荡1 h,收集上层清液,并用30 mL上述乙酸乙酯-乙酸混合液洗涤土壤残渣,合并滤液于250 mL锥形瓶中;加入20 mL 20%的NaCl溶液,在150 rmin下振荡10 min,静置20 min分液后除去水相,取上层有机相经无水硫酸钠脱水,浓缩至10 mL,将浓缩液转移至加入40 mg活性炭的50 mL离心管中,经振荡、过滤、浓缩、定容,过0.22 μm有机滤膜,待测.
土壤中毒死蜱和TCP用高效液相色谱法测定,标准样品和加入毒死蜱及TCP标样土壤样品的液相色谱图见图1. 流动相为甲醇和0.02%的乙酸超纯水(二者体积比为90∶10),流速为1 mLmin,检测波长为293 nm,柱温为30 ℃,进样体积为10 μL. 土壤中毒死蜱和TCP的添加回收率分别为81%~118%和90%~116%,最低检出限分别为0.04和0.02 mgkg.
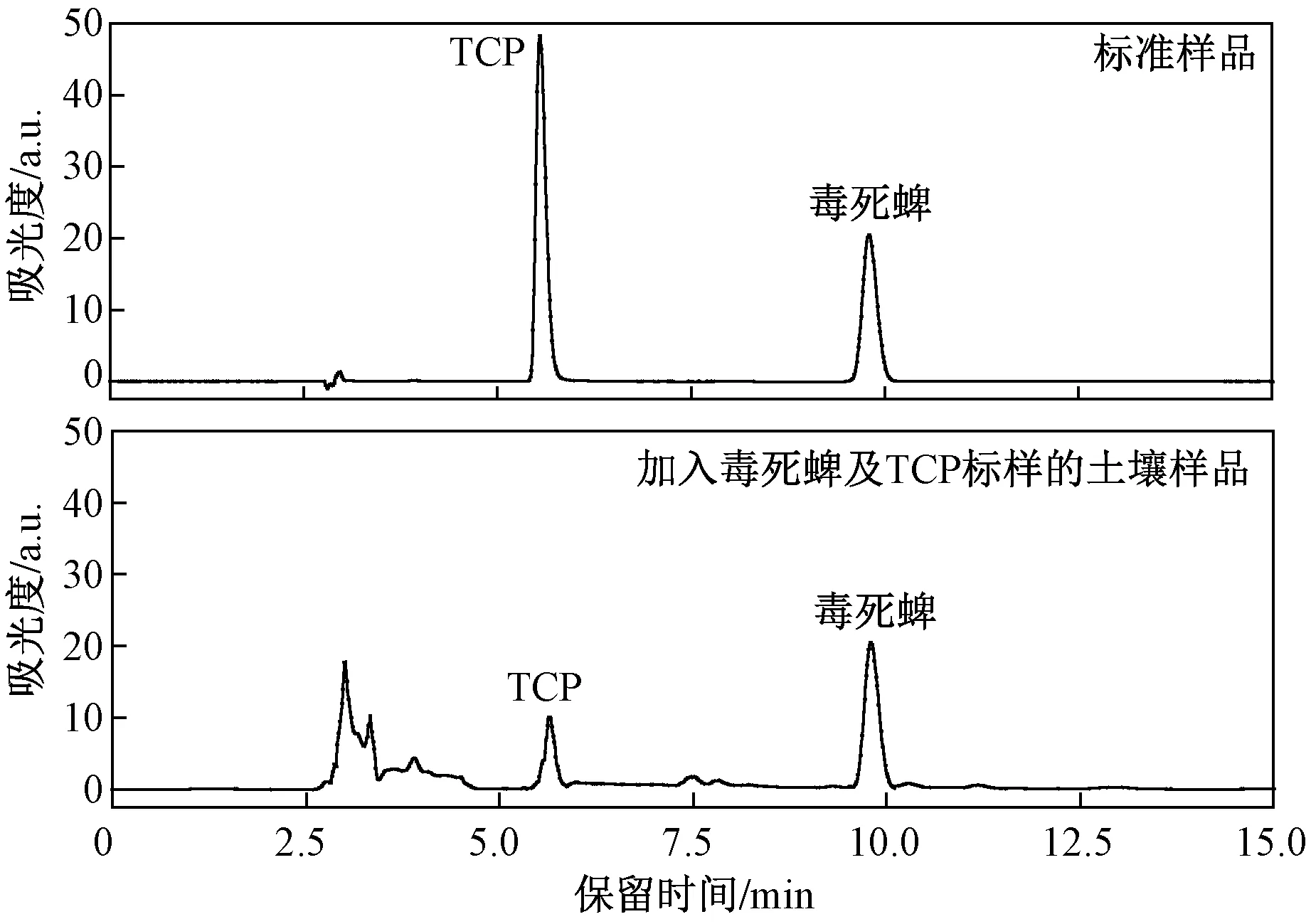
图1 标准样品和加入毒死蜱及TCP标样土壤样品的液相色谱图Fig.1 Liquid chromatogram of standard and spiked samples
土壤pH、含水率分别采用电位法、烘干法测定;土壤田间持水量采用环刀法测定;土壤中w(有机碳)、w(DOC)(DOC为可溶性有机碳)采用TOCTN分析仪测定;土壤中w(TN)采用凯氏定氮法测定;土壤粒径采用激光粒度仪测定;w(MBC)(MBC为微生物量碳)采用氯仿熏蒸提取法测定;土壤中w(NH4+-N)采用2 molL KCl浸提靛酚蓝比色法测定;土壤中w(NO3--N)采用酚二磺酸比色法测定[25].
1.3 试验方法
盆栽试验:将10 kg过2 mm筛的土壤装入直径25 cm、高30 cm的盆钵中,调节水分至40%FC (田间持水量,field capacity),培养1周,播种作物(玉米、大豆、小麦),每个盆分4穴,每个穴3粒,深度约4 cm. 播种作物1周后在每盆分别加入不同水量调节水分至设定水平,模拟田间实际环境条件从干旱到水分充足共设置5个水分处理,即20%FC、40%FC、60%FC、80%FC和100%FC,表示田间持水量依次为20%、40%、60%、80%和100%,对应的含水率分别为4.27%、8.54%、12.81%、17.08%和21.35%,该试验设计的最高水分处理为100%FC,同时盆栽试验进行前对试验容器底部进行了密封处理,以杜绝因洒水渗漏等外部原因而导致的数据不准确. 播种作物2周后,将毒死蜱按田间推荐剂量400 mgL(40%毒死蜱乳油配制)按照150 mL盆均匀喷洒在土壤表面开始试验. 生长期间不施其他农药,蜗牛等虫害采用手工去除. 温室中保持25~32 ℃,自然光照,盆钵的位置每1周调换1次,尽量减少因光照、气温等条件差异对试验的影响. 在作物生长期间,多次测定采样点土壤含水率,发现60%FC更接近于实际土壤含水率,同时60%FC在农业生产中也更容易实现,因此模拟实际农田作物生长水分处理选择60%FC,在该条件下3种作物分别增加1组用以比较根际土壤与非根际土壤毒死蜱消解的差异. 试验设置对照组(不种植任何植物),每个处理均设3个重复.
分别于施农药处理后第0、1、3、5、10、15、20、30、45天采用多点随机采样法分别采集容器上层(0~10 cm)和下层(10~20 cm)土壤,采用四分法混匀装于自封袋中,-20 ℃下保存,用于土壤中毒死蜱及TCP的检测分析;同时测定处理后第45天的土壤性质,分析处理后土壤性质变化对毒死蜱消解的影响;其中1组60%FC处理,分别于施农药处理后第0、1、3、5、10、15、30、45天在每个盆中随机选取1株长势良好的作物植株,挖取植株根周3 cm范围内的全部根系,用手轻抖以去除附着土,用软毛刷刷取根际土,装于自封袋,-20 ℃下保存,用于根际与非根际土壤样品分析. 试验期间采用称重法保持各处理的土壤湿度. 每2 d称量、浇水各一次,浇水时间为08:00—10:00. 浇水量按式(1)计算.
m3=m0-(m1+m2)
(1)
式中:m3为当日浇水量,g;m0为盆土固定质量,g;m1为当日盆土质量,g;m2为取土总质量,g.
1.4 数据分析方法
土壤中w(毒死蜱)及其变化率采用一级动力学方程进行拟合:
Ct=C0e-kt
(2)
式中:Ct为t天时土壤中w(毒死蜱),mg/kg;C0为首次采集土壤中w(毒死蜱),mg/kg;k为消解速率常数.
毒死蜱的半衰期(DT50)计算方法:
DT50=(ln 2)k
(3)
运用Microsoft Excel 2010和SPSS 24. 0软件进行数据统计分析,使用Origin 2017软件绘图.
2 结果与讨论
2.1 不同水分处理土壤中毒死蜱及TCP消解变化情况
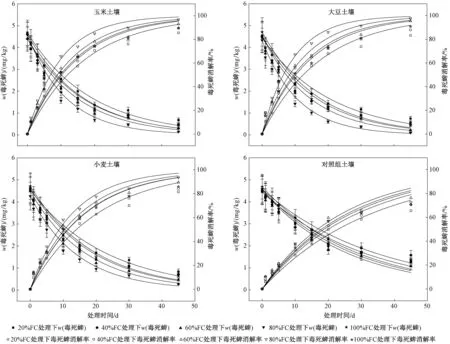
图2 不同水分处理下各作物土壤中毒死蜱随时间的消解情况Fig.2 Dissipation of chlorpyrifos in various crop soils under different moisture treatments
不同水分处理土壤中施用毒死蜱后,各作物土壤中毒死蜱随时间的消解情况如图2所示. 由图2可见,不同水分处理下种植玉米、大豆和小麦的土壤中毒死蜱在前期(0~10 d)和后期(10~45 d)的变化趋势具有相似性. 前期土壤中毒死蜱消解速率较快,后期w(毒死蜱)变化趋于平缓,可能是因为前期表层土壤中毒死蜱受到太阳光影响以及微生物作用[26],相应的化学键发生断裂迅速降解,当w(毒死蜱)较高时土壤吸附点位可能已达到饱和状态,剩余的毒死蜱溶解在土壤溶液相中,通过生物和非生物机制降解[27]. 随着时间的延长,土壤中毒死蜱降解产生大量TCP,由于TCP对土壤中酶活性和微生物活力具有抑制作用,导致毒死蜱的消解速率降低,随着土壤中w(毒死蜱)的进一步降低,土壤中毒死蜱大部分被吸附,毒死蜱消解曲线趋于平缓.
不同水分处理土壤中毒死蜱消解速率有明显差异,作物种植土壤中毒死蜱消解速率表现为80%FC>60%FC>40%FC>100%FC>20%FC,对照组土壤中毒死蜱消解速率表现为60%FC>80%FC>100%FC>40%FC>20%FC. 可见,无论是否种植作物,土壤中毒死蜱的消解速率均随着土壤含水量的增加呈先增后降的趋势,表明适宜的水分条件有利于土壤中毒死蜱的消解,水分含量过高或过低均不利于毒死蜱的消解. 与其他水分条件相比,种植作物土壤在80%FC处理下毒死蜱的消解明显较快,可能是由于80%FC处理下土壤性质变化明显,进而影响毒死蜱的消解. 有研究[28]表明,土壤含水量的适度提高不仅可以增强微生物的活性,也可以增加土壤中微生物的数量,从而加快土壤有机碳的矿化速度,80%FC处理下土壤有机碳含量明显降低. 这与Fernández-Alberti等[29]研究不同含水量下生物混合物中毒死蜱降解效果所得结论基本一致.
不同水分处理土壤中毒死蜱的消解过程符合一级动力学方程. 不同水分处理(20%FC、40%FC、60%FC、80%FC和100%FC)土壤中毒死蜱的半衰期分别为13.10~23.58、11.44~21.87、10.12~17.82、7.61~18.87和11.75~19.42 d (见表1). 施毒死蜱45 d后,不同水分处理(20%FC、40%FC、60%FC、80%FC 和100%FC)土壤中毒死蜱的消解率分别为65.58%~85.56%、70.71%~89.64%、76.30%~95.33%、72.53%~97.60%和70.57%~90.80%. 可

表1 不同水分处理各作物土壤中毒死蜱消解速率常数(k)与半衰期
见,80%FC处理下,土壤中毒死蜱半衰期最短,消解速率最快;60%FC处理下毒死蜱消解稍慢于80%FC处理;20%FC、40%FC和100%FC处理下毒死蜱半衰期有不同程度增加,这可能是由于20%FC和40%FC土壤处于干旱和低湿度条件,在这种条件下土壤微生物活性降低以及毒死蜱的水解反应受到一定的限制;100%FC处理下,土壤通透性发生变化,微生物活动受到抑制,导致毒死蜱消解速率降低,这主要与不同水分处理土壤中有机质含量及微生物活性不同有关[30],溶解性有机质有促进毒死蜱在土壤中消解的作用,进而显著降低植株对毒死蜱的吸收[31-32]. 不同水分处理下,作物生长状态确有不同,与其他处理相比,20%FC处理下作物生长较慢,作物植株较小,但40%FC、60%FC、80%FC和100%FC处理下,作物植株长势基本一致,无明显差异,故笔者未关注作物生长状态指标. 在60%FC处理下3种作物(大豆、玉米、小麦)土壤中毒死蜱的消解均较快,仅次于80%FC 处理下毒死蜱的消解速率,这可能由于60%FC 处理下微生物较为活跃,加速了土壤中毒死蜱的消解. 毒死蜱在土壤中的消解是一个涉及生物、化学和物理的复杂过程,不同水分条件使土壤处于不同的理化及生物学性状,从而对毒死蜱的消解产生重要影响. 可见,农业生产中通过灌溉适当调节土壤水分保持在60%FC~80%FC的条件下可加快毒死蜱消解、降低毒死蜱的环境风险. 我国北方旱地土壤通常约在60%FC条件下,在施用毒死蜱期间通过适当增加土壤含水率可降低毒死蜱的环境风险.
对不同水分处理土壤中施用毒死蜱后主要代谢产物TCP变化的分析结果(见图3)显示:施药当天,不同水分处理土壤中均可检出TCP,20%FC、40%FC、60%FC、80%FC和100%FC处理土壤中w(TCP)分别为0.10~0.21、0.15~0.21、0.16~0.27、0.21~0.34和0.17~0.25 mg/kg;施药后0~5 d,不同水分处理土壤中w(TCP)均呈递增趋势;施药后10~15 d,除20%FC处理外,其余处理土壤中w(TCP)均先出现一个短暂的下降而后达到峰值,然后开始逐渐降低,这可能因为毒死蜱前期快速降解生成大量TCP,TCP对土壤微生物的抑制作用导致其降解缓慢,随着时间延长,TCP继续甲基化而进一步降解. Singh等[33]研究土壤中毒死蜱降解时也发现,随着土壤中w(TCP)的增加,毒死蜱的半衰期不断增加,TCP本身的降解速率也逐渐降低. 不同水分处理土壤中TCP的变化情况与毒死蜱基本一致,均在80%FC处理下积累达到最高浓度并且随后迅速消解,60%FC处理下次之. 这进一步证明不同水分条件会显著影响毒死蜱的消解与转化.
2.2 不同水分条件下土壤理化性质对毒死蜱消解的影响
土壤中毒死蜱的消解受到土壤理化性质的影响,已有研究[34]证实,土壤理化性质(如含水率、pH和有机质含量等)显著影响土壤中毒死蜱的消解. 为进一步分析不同水分条件下土壤中毒死蜱消解速率的影响因素,以玉米种植土壤为例,对其理化性质变化进行分析(见表2),并采用相关性分析探讨土壤中毒死蜱消解速率与土壤理化性质之间的关系(见表3). 由表3可见,土壤中毒死蜱的消解速率(k)与w(DOC)和w(MBC)均呈显著正相关,与w(有机碳)呈显著负相关,即水分对土壤毒死蜱消解的影响主要是通过影响有机碳、MBC和DOC而实现的.
土壤有机碳对土壤中毒死蜱的吸附具有显著影响,随着土壤w(有机碳)的降低,有机碳对毒死蜱的吸附作用逐渐减弱,加速其水解[35],从而对毒死蜱消解产生影响. DOC是土壤微生物可直接利用的碳源,同时也是污染物移动的载体,其与有机污染物的竞争
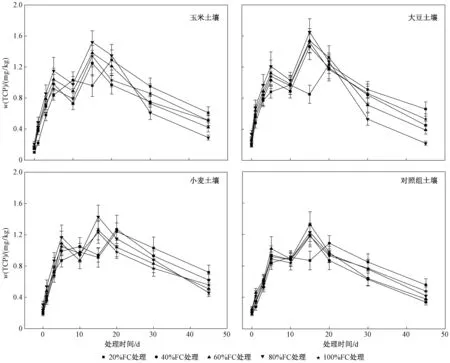
图3 不同水分处理下各作物土壤中w(TCP)随时间的变化Fig.3 Changes in the contents of TCP in various crop soils under different moisture treatments

水分处理w(有机碳)∕(g∕kg)w(DOC)∕(mg∕kg)w(MBC)∕(mg∕kg)w(NH4+-N)∕(mg∕kg)w(NO3--N)∕(mg∕kg)pH20%FC11.39±0.6039.62±1.64166.88±7.156.56±0.8510.57±0.617.11±0.0240%FC9.43±0.6243.32±3.45198.10±12.4110.26±0.5711.93±0.297.22±0.0460%FC7.24±0.5949.94±2.15235.79±5.647.85±0.648.16±0.336.87±0.0280%FC5.99±0.4660.35±2.25263.97±5.785.08±0.955.80±0.407.31±0.03100%FC7.96±0.2652.61±3.44213.11±4.169.44±0.573.48±0.516.56±0.12
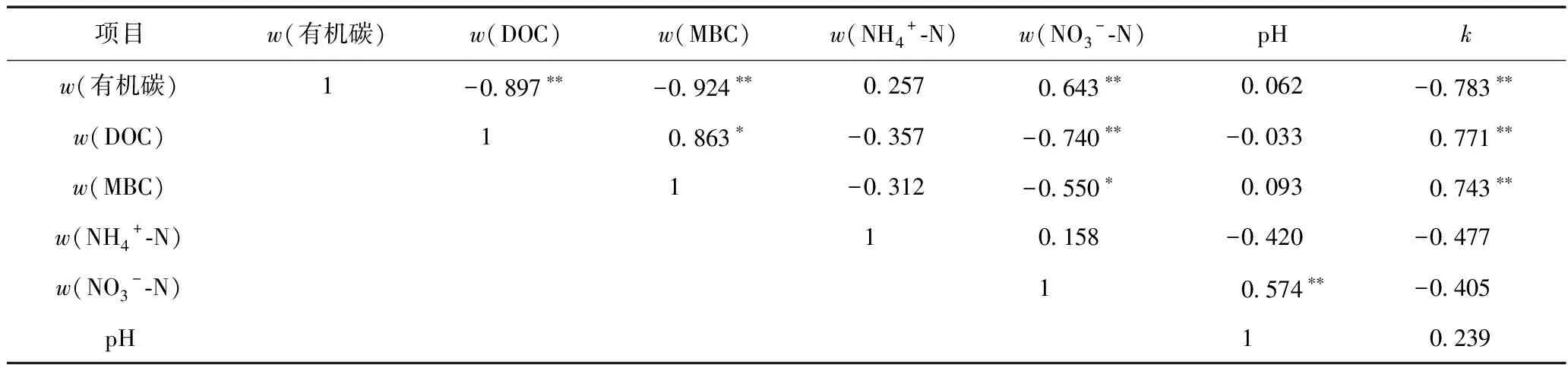
表3 玉米种植土壤理化性质之间及其与消解速率常数(k)之间的相关性分析
注:*表示在0.05水平(双侧)上显著相关;** 表示在0.01水平(双侧)上显著相关.
吸附作用会使更多的有机污染物留在土壤溶液中,从而提高了微生物对有机污染物的利用率,加快了有机污染物的降解[36-38]. 微生物作用也是土壤中毒死蜱消解的重要途径[39],土壤中MBC的增加,在一定程度上反映微生物活动旺盛,其对土壤中毒死蜱降解作用增强.
由表3可见,土壤理化性质之间也存在相关关系,如w(有机碳)与w(DOC)、w(MBC),w(DOC)与w(MBC)间均呈显著相关. 水分在引起某方面土壤性质变化时也会引起其他理化性质的变化,水分对土壤中毒死蜱消解的影响,可能是多个理化性质的综合作用,而且各理化性质对土壤中毒死蜱消解的作用方向和强度也有所不同.
为进一步探讨消解速率常数与土壤理化性质之间的关系,以玉米种植土壤为例进行了通径分析(见表4). 由表4可见,不同土壤理化性质对消解速率常数的直接通径系数大小依次为w(有机碳)>w(DOC)>w(MBC)>w(NH4+-N)>w(NO3--N)>pH,表明在直接影响土壤毒死蜱消解的各项因素中,有机碳作用最大,其次为DOC和MBC. 从表4还可以看出,土壤各理化性质对消解速率常数的影响具有直接作用和间接作用,但不同土壤理化性质对消解速率常数的间接影响程度不同,影响程度由大到小依次为w(有机碳)>w(DOC)>w(MBC)>w(NH4+-N)>pH>w(NO3--N).

表4 玉米种植土壤理化性质与消解速率常数(k)之间的通径分析
此外,从决定系数(dij)可知,w(有机碳)、w(DOC)和w(MBC)对土壤中毒死蜱消解的影响要略大于其他因子(见表5). 各因子对通径分析中回归方程R2的贡献表现为w(有机碳)(0.578)>w(DOC)(0.297)>w(MBC)(-0.192)>w(NH4+-N)(0.092)>w(NO3--N)(-0.063)>pH(0.036). 无论从决定系数还是各因子对R2的贡献,w(有机碳)、w(DOC)和w(MBC)对土壤中毒死蜱的消解均有显著影响. 不同水分处理下,土壤中毒死蜱消解速率的不同可能是由于水分改变了土壤中w(有机碳)、w(DOC)和w(MBC)造成的.
2.3 作物根际与非根际土壤中毒死蜱及TCP消解情况
在适宜作物生长的水分条件(60%FC)下,3种作物根际与非根际土壤中w(毒死蜱)及w(TCP)变化情况如图4所示. 由图4(a)可见,无论作物根际土壤还是非根际土壤,毒死蜱均在前期快速消解、后期变化平缓,但毒死蜱消解差异明显. 土壤中w(毒死蜱)表现为大豆根际土壤>玉米根际土壤>小麦根际土壤>玉米非根际土壤>大豆非根际土壤>小麦非根际土壤>对照组土壤. 由表6可见,玉米、大豆和小麦根际土壤毒死蜱的半衰期分别为8.60、7.00和9.96 d,非根际土壤毒死蜱的半衰期分别为10.22、10.25和11.97 d,3种作物根际土壤中毒死蜱消解速率均快于非根际土壤. 由图4(b)可见,3种作物根际和非根际土壤中TCP均在前期大量积累至峰值后又快速消解,但w(TCP)变化也有明显差别. 相比于非根际土壤,3种作物根际土壤中TCP前期积累达到峰值所需时间较短,随着时间延长,TCP消解也较迅速. 根际是土壤中消解外源有机物的最佳环境,根系细胞有大量分泌物和脱落物,此外根系分泌物不仅可以通过促进微生物活性从而增强有机污染物消解,根系分泌物在微生物消解有机污染物时还起到“共代谢”基质或协同作用[40]. 3种作物根际土壤中毒死蜱消解的变化速率表现为大豆土壤>玉米土壤>小麦土壤,不同作物根系分泌物的差异,导致根际微环境有所不同,进而影响根际土壤中毒死蜱的消解过程. GUO等[41]通过模拟根际环境,研究玉米和大豆根系分泌物对有机污染物多环芳烃消解和土壤细菌群落结构的影响时发现,添加玉米和大豆根系分泌物可使污染物质消解显著增强. 玉米根系分泌物对土壤中污染物质的去除率高于大豆根系分泌物.
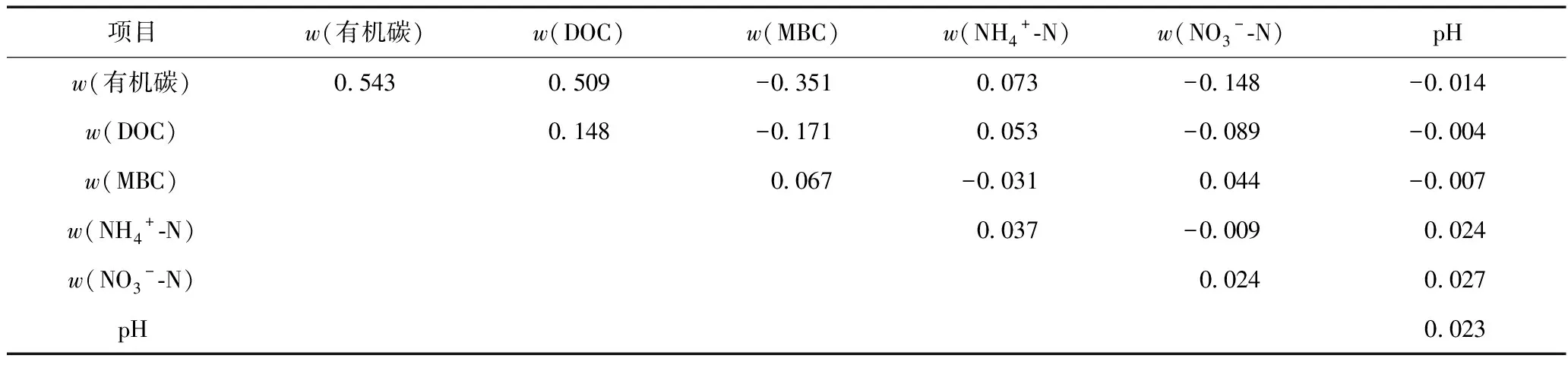
表5 玉米种植土壤理化性质与消解速率常数(k)之间通径分析的决定系数值(dij)
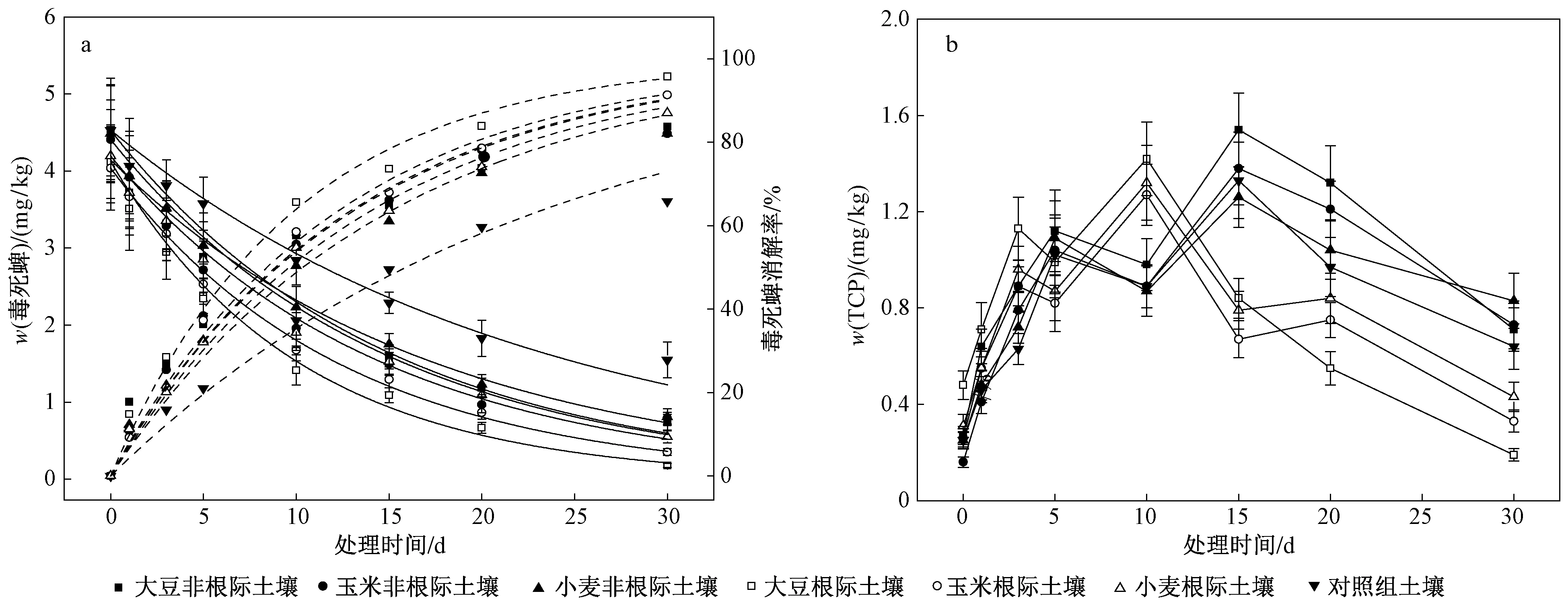
图4 不同作物根际与非根际土壤中w(毒死蜱)及w(TCP)变化Fig.4 Changes of chlorpyrifos and TCP content in rhizosphere and non-rhizosphere soils
各作物非根际土壤中毒死蜱消解速率表现为小麦土壤>玉米土壤>大豆土壤,这可能是由于作物叶面覆盖度不同,导致土壤表面遮荫面积有差异,从而进一步影响不同作物土壤中毒死蜱的消解过程. 施药后,从作物生长情况看,作物对盆栽土壤遮荫面积表现为大豆>玉米>小麦,这可能导致大豆非根际土壤温度较低,光解较少,因此大豆非根际土壤中毒死蜱消解较慢. Chai等[42]研究毒死蜱在热带土壤中的消解时发现,在15~35 ℃范围内随温度的升高,毒死蜱降解速率显著增加,表明温度对土壤中毒死蜱的降
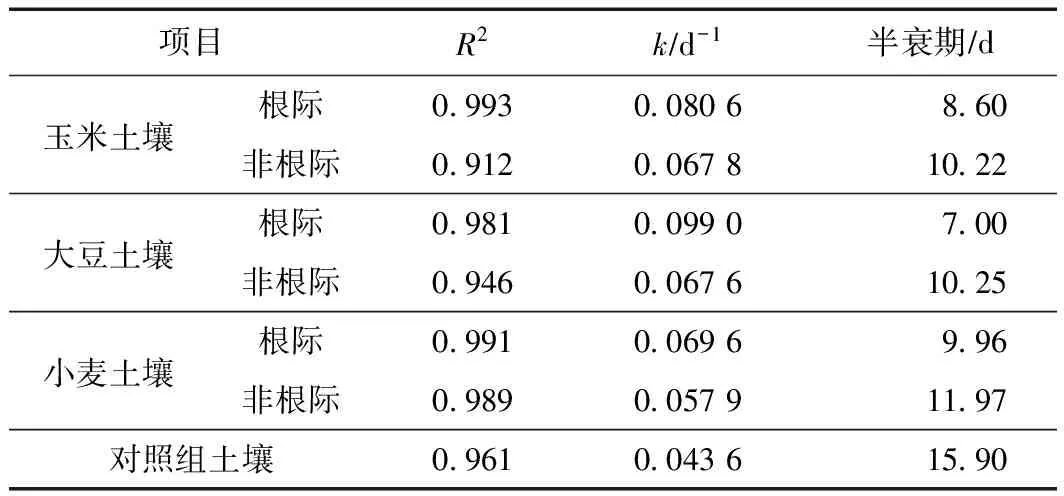
表6 不同作物根际与非根际土壤中毒死蜱消解速率常数(k)与半衰期
解有很大影响.
3 结论
a) 不同水分下土壤中毒死蜱的消解速率有明显差别,种植作物土壤中毒死蜱的消解速率均表现为随水分增加呈先增后降的特征,施药45 d后,20%FC、40%FC、60%FC、80%FC和100%FC处理土壤中毒死蜱消解率分别为65.58%~85.56%、70.71%~89.64%、76.30%~95.33%、72.53%~97.60%和70.57%~90.80%. 在80%FC处理下土壤中毒死蜱消解最快,60%FC处理下次之,表明农业生产中通过灌溉适当调节土壤水分在60%FC~80%FC条件可加快毒死蜱消解、降低毒死蜱的环境风险.
b) 水分调控下土壤中毒死蜱的消解速率与土壤有机碳、DOC和MBC均呈显著相关. 水分对土壤中毒死蜱的消解主要通过影响土壤有机碳、DOC和MBC起作用.
c) 玉米、大豆和小麦根际土壤毒死蜱半衰期分别为8.60、7.00、9.96 d,非根际土壤中分别为10.22、10.25、11.97 d. 根际土壤中毒死蜱的消解速率均快于非根际土壤,种植不同作物的根际土壤中毒死蜱的消解速率也有所差异.
参考文献(References):
[1] 王川,周巧红,吴振斌.有机磷农药毒死蜱研究进展[J].环境科学与技术,2011,34(7):123-127.
WANG Chuan,ZHOU Qiaohong,WU Zhenbin.Research advances of a kind of organophosphate pesticide chlorpyrifos[J].Environmental Science & Technology (China),2011,34(7):123-127.
[2] PIMENTEL D.Amounts of pesticides reaching target pests: environmental impacts and ethics[J].Journal of Agricultural & Environmental Ethics,1995,8(1):17-29.
[3] DUTTA M,SARDAR D,PAL R,etal.Effect of chlorpyrifos on microbial biomass and activities in tropical clay loam soil[J].Environmental Monitoring & Assessment,2010,160(1234):385-391.
[4] SINGH P B,SHARMA S,SAINI H S,etal.Biosurfactant production byPseudomonassp. and its role in aqueous phase partitioning and biodegradation of chlorpyrifos[J].Letters in Applied Microbiology,2010,49(3):378-383.
[5] SINGH B K,WALKER A,MORGAN J A W,etal.Biodegradation of chlorpyrifos by enterobacter strain B-14 and its use in bioremediation of contaminated soils[J].Applied and Environmental Microbiology,2004,70(8):4855-4863.
[6] RACKE K D,COATS J R,TITUS K R.Degradation of chlorpyrifos and its hydrolysis product,3,5,6-trichloro-2-pyridinol,in soil[J].Journal of Environmental Science & Health Part B,1988,23(6):527-539.
[7] BERENSTEIN G,NASELLO S,ÉRICA B,etal.Human and soil exposure during mechanical chlorpyrifos,myclobutanil and copper oxychloride application in a peach orchard in Argentina[J].Science of the Total Environment,2017,586:1254-1262.
[8] LEE W J,BLAIR A,HOPPIN J A,etal.Cancer incidence among pesticide applicators exposed to chlorpyrifos in the agricultural health study[J].Journal of the National Cancer Institute,96(23):1781-1789.
[10] 余凯敏,冯为民,李国超,等.毒死蜱的环境生物学效应分析[J].生物技术通报,2015,31(8):225-230.
YU Kaimin,FENG Weimin,LI Guochao,etal.An analysis of environmental and biological effects of chlorpyrifos[J].Biotechnology Bulletin,2015,31(8):225-230.
[11] TIWARI M K,GUHA S.Kinetics of biotransformation of chlorpyrifos in aqueous and soil slurry environments[J].Water Research,2014,51(6):73-85.
[12] 崔旭,赵静,吴加伦,等.48%毒死蜱乳油在杭白菊和土壤中的消解动态[J].农药学学报,2014,16(2):159-164.
CUI Xu,ZHAO Jing,WU Jialun,etal.Residual dissipation behavior of chlorpyrifos 480 EC in chrysanthemum flower and soil[J].Chinese Journal of Pesticide Science,2014,16(2):159-164.
[13] 方华.毒死蜱在大棚土壤和蔬菜中的残留特征、土壤生态效应及其控制途径[D].杭州:浙江大学,2007:20-25.
[14] 张家禹,刘丽丽,李国超,等.毒死蜱对斑马鱼胚胎氧化应激效应研究[J].中国环境科学,2016,36(3):927-934.
ZHANG Jiayu,LIU Lili,LI Guochao,etal.Oxidative stress effects of chlorpyrifos on zebrafish embryos[J].China Environmental Science,2016,36(3):927-934.
[15] RACKE K D.Environmental fate of chlorpyrifos[J].Reviews of Environmental Contamination & Toxicology,1993,131:1-150.
[16] 万宗君,陈振德,栾霞,等.韭菜和土壤中毒死蜱的残留与降解动态[J].应用生态学报,2012,23(2):525-530.
WAN Zongjun,CHEN Zhende,LUAN Xia,etal.Residue of chlorpyrifos and its degradation dynamics in Chinese chive (Alliumtuberosum) plant and soil[J].Chinese Journal of Applied Ecology,2012,23(2):525-530.
[17] 毛应明,王学松,沈伟健,等.毒死蜱在小麦植株及土壤环境中的残留特性[J].环境科学研究,2007,20(5):105-109.
MAO Yingming,WANG Xuesong,SHEN Weijian,etal.The residual property of chlorpyrifos in wheat seedling and soil[J].Research of Environmental Sciences,2007,20(5):105-109.
[18] 汪立刚,蒋新,颜冬云,等.土壤中残留毒死蜱的作物效应[J].环境科学,2006,27(2):366-370.
WANG Ligang,JIANG Xin,YAN Dongyun,etal.Effect of chlorpyrifos residue in red soil on crops[J].Environmental Science,2006,27(2):366-370.
[19] 虞云龙,杨基峰,潘学冬,等.作物种类对根际土壤中丁草胺降解的影响[J].农药学学报,2004,6(1):46-52.
YU Yunlong,YANG Jifeng,PAN Xuedong,etal.Effect of plant species on degradation of butachlor in rhizosphere soils collected from agricultural field[J].Chinese Journal of Pesticide Science,2004,6(1):46-52.
[20] CHAI L K,MOHD-TAHIR N,HANSEN S,etal.Dissipation and leaching of acephate,chlorpyrifos,and their main metabolites in field soils of Malaysia[J].Journal of Environmental Quality,2009,38(3):1160-1169.
[21] CHU Xiaoqiang,FANG Hua,PAN Xuedong,etal.Degradation of chlorpyrifos alone and in combination with chlorothalonil and their effects on soil microbial populations[J].Journal of Environmental Sciences,2008,20(4):464-469.
[22] FANG Hua,YU Yunlong,CHU Xiaoqiang,etal.Degradation of chlorpyrifos in laboratory soil and its impact on soil microbial functional diversity[J].Journal of Environmental Sciences,2009,21(3):380-386.
[23] AWASTHI M D,PRAKASH N B.Persistence of chlorpyrifos in soils under different moisture regimes[J].Pest Management Science,2015,50(1):1-4.
[24] 薛南冬,刘寒冰,杨兵,等.毒死蜱土壤环境行为研究进展[J].浙江大学学报,2017,43(6):713-726.
XUE Nandong,LIU Hanbing,YANG Bing,etal.Progress on environmental behavior of chlorpyrifos in soils[J].Journal of Zhejiang University,2017,43(6):713-726.
[25] 鲍士旦.土壤农业化学分析[M].3版.北京:中国农业出版社,2000:152-177.
[26] CHAI L K,MOHD-TAHIR N,HANSEN H C B,etal.Dissipation of acephate,chlorpyrifos,cypermethrin and their metabolites in a humid-tropical vegetable production system[J].Pest Management Science,2010,65(2):189-196.
[27] PAPADOPOULOU E S,KARAS P A,NIKOLAKI S,etal.Dissipation and adsorption of isoproturon,tebuconazole,chlorpyrifos and their main transformation products under laboratory and field conditions[J].Science of the Total Environment,2016,569570:86-96.
[28] 邓书林.土壤含水量对川西亚高山针叶林下土壤有机碳含量的影响研究[D].北京:中国科学院大学,2016:10-15.
[30] DAS S,ADHYA T K.Degradation of chlorpyrifos in tropical rice soils[J].Journal of Environmental Management,2015,152:36-42.
[31] CHISHTI Z,HUSSAIN S,ARSHAD K R,etal.Microbial degradation of chlorpyrifos in liquid media and soil[J].Journal of Environmental Management,2013,114(2):372-380.
[32] 何任红,蒋新宇,曹正,等.溶解性有机质对毒死蜱在土壤-植物系统中残留的影响[J].环境科学与技术,2013,36(3):28-31.
HE Renhong,JIANG Xinyu,CAO Zheng,etal.Effects of dissolved organic matter on residues of chlorpyrifos in soil-plant system[J].Environmental Science & Technology (China),2013,36(3):28-31.
[33] SINGH B K,WALKER A,MORGAN J A W,etal.Effects of soil pH on the biodegradation of chlorpyrifos and isolation of a chlorpyrifos-degrading bacterium[J].Applied & Environmental Microbiology,2003,69(9):5198-5206.
[34] ZHANG Qun,WANG Baichuan,CAO Zhengya,etal.Plasmid-mediated bioaugmentation for the degradation of chlorpyrifos in soil[J].Journal of Hazardous Materials,2012,221222:178-184.
[35] MOSQUERA-VIVAS C S,HANSEN E W,GARCA-SANTOS G,etal.The effect of the soil properties on adsorption,single-point desorption,and degradation of chlorpyrifos in two agricultural soil profiles from colombia[J].Soil Science,2016,181(9):446-456.
[36] COX L,VELARDE P,CABRERA A,etal.Dissolved organic carbon interactions with sorption and leaching of diuron in organic-amended soils[J].European Journal of Soil Science,2010,58(3):714-721.
[37] 许中坚,刘广深,刘维屏.土壤中溶解性有机质的环境特性与行为[J].环境化学,2003,22(5):427-433.
XU Zhongjian,LIU Guangshen,LIU Weiping.Environmental characteristic and behavior of dissolved organic matter in soils[J].Environmental Chemistry,2003,22(5):427-433.
[38] 李太魁.紫色土坡地土壤可溶性有机碳迁移过程研究[D].北京:中国科学院研究生院,2011:11-16.
[39] AWAD N S,SABIT H H,ABO-ABA S E M,etal.Isolation,characterization and fingerprinting of some chlorpyrifos-degrading bacterial strains isolated from Egyptian pesticides-polluted soils[J].African Journal of Microbiology Research,2011,5(18):2855-2862.
[40] 郜红建,蒋新,常江,等.根分泌物在污染土壤生物修复中的作用[J].生态学杂志,2004,23(4):135-139.
GAO Hongjian,JIANG Xin,CHANG Jiang,etal.Effects of root exudates in the bioremediation of contaminated soils[J].Chinese Journal of Ecology,2004,23(4):135-139.
[41] GUO Meixia,GONG Zongqiang,MIAO Renhui,etal.The influence of root exudates of maize and soybean on polycyclic aromatic hydrocarbons degradation and soil bacterial community structure[J].Ecological Engineering,2017,99:22-30.
[42] CHAI L K,WONG M H,BRUUN-HANSEN H C.Degradation of chlorpyrifos in humid tropical soils[J].Journal of Environmental Management,2013,125(1):28-32.

