不同生长阶段斑马鱼对Cu2+的毒性响应差异
廖 伟, 刘大庆, 冯承莲,*, 金小伟, 刘 娜, 白英臣,, 吴代赦
1.南昌大学资源环境与化工学院, 鄱阳湖环境与资源利用教育部重点实验室, 江西 南昌 330031 2.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 3.江西省灌溉试验中心站, 江西 南昌 330201 4.中国环境监测总站, 北京 100012
环境中的重金属具有持久性和不可降解性,水域水体、沉积物中一旦重金属含量增高,将危及或危害水生生物的生存和繁衍. Cu虽然在生物机体细胞代谢中起重要作用[1],但Cu (主要指Cu2+)同样会对水生生物具有较高毒性[2-5]. 研究[2,6-7]发现,我国太湖、辽河、鄱阳湖等水域重金属污染的生态风险均较高,其中Cu为潜在风险最大的重金属元素之一,故选择Cu作为目标污染物具有重要意义.
目前,大部分研究主要考虑水质因素如硬度[8-11]、pH[12-13]、溶解性有机碳(DOC)[12,14-16]等对重金属污染物生物有效性的影响,而极少考虑水生生物不同生长阶段群体对污染物响应的差异. 在进行水环境基准推算时,大部分环境管理文件提到原则上选择最敏感生长阶段的毒性数据来推导基准值. 常用的水生生物,如虾的各生长阶段变化明显,相关研究较多,但不同受试生物对污染物的最敏感生长阶段不同. 而鱼作为最重要的水生生物类群之一,不同生命阶段对污染物敏感性的研究较少,所以选取合适的模式生物,合理区分其不同生长阶段,研究污染物对其不同阶段毒性差异具有重要意义.
斑马鱼属鲤科,具有生长周期短、繁殖能力强、对污染物敏感等特点,是研究水生生物毒性效应良好的模式生物之一. 目前我国已建立了斑马鱼国家资源中心,广泛用于各种重金属、有机物等化学物质的毒性测试[17-21]. 现有研究仅将斑马鱼分为胚胎、幼鱼、成鱼3个阶段[22-24]来比较污染物对其毒性的差异,但并未提及阶段划分的依据. 斑马鱼早幼期生长发育速度快,易受外界干扰,仅分为胚胎、幼鱼、成鱼3个阶段难以代表斑马鱼生命周期不同阶段对待测有毒化合物敏感性的变化,因此,有必要对斑马鱼早幼期不同阶段进行细分,进一步研究其对有毒化合物敏感性的差异变化.
该研究旨在探索我国常见的且已大规模使用的模式生物斑马鱼不同生长阶段划分及分阶段培养方法,并研究不同生长阶段斑马鱼对Cu2+的毒性响应差异,以期为污染物生态风险评价和水质基准研究中对受试生物不同阶段的选取提供理论依据.
1 材料与方法
1.1 试验材料
试验用鱼:受试生物为AB品系斑马鱼(Daniorerio),购于中国科学院水生生物研究所,已在实验室驯养5 a以上.
CuSO4·5H2O(五水合硫酸铜,GR)购自上海国药试剂厂;Cu标准溶液购于国家标准物质网;CaCl2·2H2O(氯化钙,AR)、MgSO4·7H2O(硫酸镁,AR)、NaHCO3(碳酸氢钠,AR)、KCl(氯化钾,AR)等试剂均购自上海国药试剂厂;丰年虾休眠卵购自天津丰年水产养殖有限公司. 试验用所有容器均放入酸桶(10%~15%盐酸)浸泡24 h,再用自来水、除氯水冲洗干净.
1.2 主要仪器
MGC-350 HP-2人工智能气候箱(上海一恒科学仪器有限公司);CASA流水养殖系统(无锡中科水质环境技术有限公司);Leica M165C体式显微镜(徕卡微系统有限公司);Mettler Toledo XPE205电子天平〔瑞士梅特勒-托利多国际贸易(上海)有限公司〕;Milli Q Direct8试验超纯水机〔默瑞(上海)生物科技有限公司〕;Agilent7500a电感耦合等离子体质谱仪(美国安捷伦科技有限公司);YSI Professional Plus多参数水质分析仪〔维赛仪器贸易(上海)有限公司〕;PHS-3E精密pH计(上海仪电科学仪器股份有限公司).
1.3 斑马鱼培育方法
斑马鱼亲鱼饲养:置于流水养殖系统,饲养条件为温度(25±1)℃、光强 1 000 lx、光暗比为16 h∶8 h. 水源为普通自来水经过活性炭过滤曝气后注入流水养殖系统,水质硬度为(130±10)mg/L,pH为7.7±0.2,ρ(DO)>6 mg/L.
斑马鱼繁殖:夜晚将待产卵亲鱼放入孵化盒中,每个孵化盒放置两雄、两雌,第2天即可产卵.
根据斑马鱼的培养方法[25]、标准试验方法[26-27]及实验室观察,该研究将斑马鱼生命周期划分为8个不同阶段(见表1).

表1 不同生长阶段斑马鱼划分描述
斑马鱼孵化:将斑马鱼受精卵收集到盛有曝气自来水(经0.45 μm滤膜过滤)的结晶皿中,加入约0.01%的亚甲基蓝试剂,置于光强为 1 000 lx、光暗比为16 h∶8 h、温度为(28±1)℃下孵化. 孵化密度以每0.5 L水放入60~80枚受精卵为宜,每6~8 h观察1次,视情况换水. 该方法下,实验室斑马鱼受精卵 48~72 h可全部孵化,平均孵化率高于95%.
仔、幼鱼饲养:孵化3~4 d后喂食经碾磨的初孵化丰年虾碎末及少量新鲜蛋黄水;7~8 d喂食初孵化丰年虾,每天换水1次;14 d后放入流水养殖系统与成鱼同条件饲养.
成鱼饲养:流水养殖系统饲养,早晚喂食孵化丰年虾,培养条件与亲鱼一致.
孵化10 d后斑马鱼累积平均成活率为85.3%±4.5%,10 d后不同生长阶段斑马鱼平均成活率均高于95.0%,满足试验方法中对受试生物成活率的要求.
1.4 斑马鱼生长监测
每个监测阶段至少设置6个平行组,监测环境条件、饲养密度、喂食量等与试验受试鱼相同,各阶段成活率采用拍照计数的方法进行测定. 斑马鱼体长测定:孵化0~17 d内采用拍照投影的方法测量,17 d后用直尺测量. 斑马鱼体质量测定:孵化0~17 d内一次称量5~200尾斑马鱼,再求其平均质量;17 d后直接称量单尾鱼质量. 斑马鱼各生长指标见式(1)~(3).
鱼体长日均增长率(GL)计算公式:
(1)
体质量日均增长率(GW)计算公式:
(2)
斑马鱼质量指数(BMI)计算公式:
BMI=WILI2
(3)
式中:LI为某生长阶段初始体长,mm;LF为某生长阶段末体长,mm;WI为某生长阶段初始体质量,g;WF为某生长阶段末体质量,g;N为某生长阶段天数,d.
1.5 毒性暴露试验方法
斑马鱼急性毒性试验严格按照毒性试验操作进行[26-27]. 采用单因子急性毒性测试方法,试验周期为96 h,不同生长阶段斑马鱼鱼龄偏差均小于12 h(其中1 d幼鱼鱼龄偏差小于6 h),根据鱼大小选择不同直径的结晶皿或大烧杯,保证暴露液中鱼的密度不超过0.5 g/L. 暴露试验标准稀释水按照标准试验方法[26]要求配制,水体硬度为250 mg/L (以CaCO3计),模拟自来水则根据实验室自来水钙镁离子的浓度,配制成硬度约为125 mg/L (以CaCO3计)的重组水. 使用前充分曝气24 h,ρ(DO)>6.0 mg/L,pH为7.8±0.2,符合标准试验方法[26]要求. 每个暴露浓度均设置3个平行,每个平行均放入10尾斑马鱼,采用半静态试验方法,每24 h更换暴露液,以保证受试物质的稳定性及DO合格,暴露期间水温、光照与培养条件保持一致. 试验期间观察24、48、72、96 h鱼的死亡(用玻璃棒轻触鱼的尾部,没有反应即认为已死亡)情况,并记录每个容器中鱼死亡的数目,清出死鱼. 试验过程中,所有死亡以及试验后未死亡的鱼均收集冷冻待集中处理. 试验期间,所有空白试验组斑马鱼死亡率均为0;经电感耦合等离子体质谱仪测量,Cu2+暴露液浓度实测值与理论值相差小于6%.
1.6 数据收集和筛选
Cu的水生生物毒性数据主要来源于已公开发表的学术论文[6-7,28],并检索2014—2018年US EPA的毒性数据库ECOTOX (http://cfpub.epa.gov/ecotox)、Web of Science和中国知网等文献数据库公开发表的文献数据作为补充. 毒性数据筛选规则参考 HJ 831—2017《淡水水生生物水质基准制定技术指南》[29]及文献[30],数据筛选后仅保留我国本土物种的毒性数据进行比较.
1.7 数据处理
采用SPSS 22.0软件Probit方法计算暴露试验的LC50(半致死浓度)及其95%置信区间,用Origin 8.0软件制图.
2 结果与分析
2.1 斑马鱼生长监测
通过对不同性别斑马鱼体长、体质量数据进行模拟发现,logistic增长方程能较好地拟合斑马鱼雌鱼、雄鱼的体长与体质量之间变化规律(见表2).
不同生长阶段斑马鱼各生长指标变化情况如图1所示. 由图1可见,斑马鱼在17~24 d内生长最快,90 d后斑马鱼体长增长率降至低点;120 d后斑马鱼体质量增长速率也降至最低,第120天斑马鱼质量指数与第90天时基本持平.
试验监测表明,在食物充足情况下,斑马鱼的体长、体质量变化均符合logistic增长方程,90 d后斑马鱼达到生殖水平. 第90天斑马鱼已接近成鱼体长,而体质量方面,由于斑马鱼亲鱼繁殖需要,90 d后其体质量还保持一定的增长率. 由图1可见,第150天斑马鱼体质量日均增长率高于第120天,除斑马鱼生殖能量储备外,还一个重要原因是120 d后斑马鱼的饲养密度降低,减少了斑马鱼的生存环境压力,使得体质量日均增长率及质量指数升高.
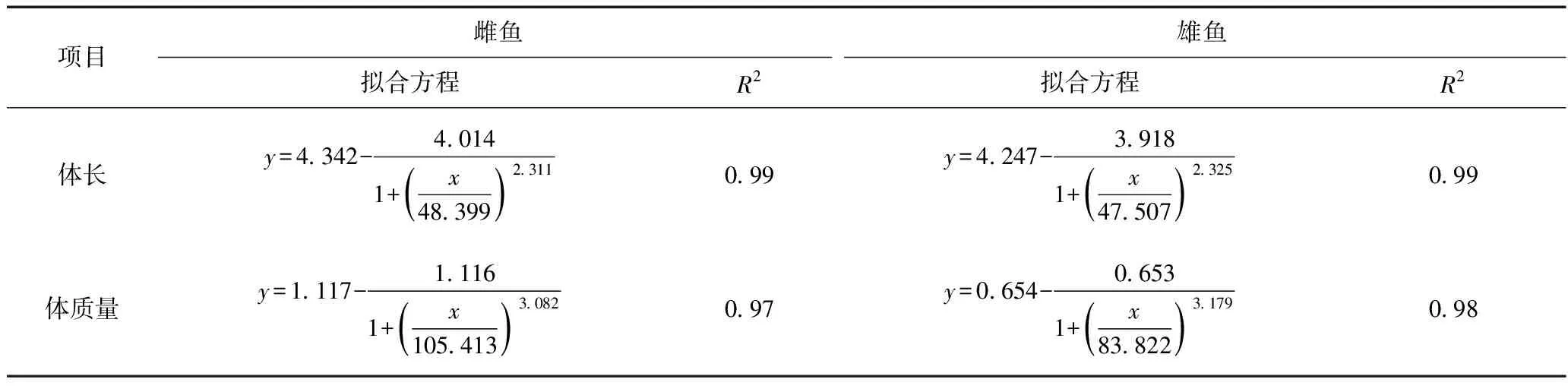
表2 斑马鱼体长与体质量之间的拟合结果
注:x为鱼龄,d;y为体长或体质量,mm或g.
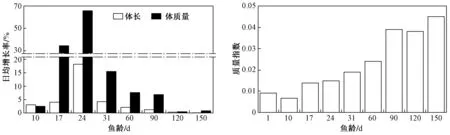
图1 不同生长阶段斑马鱼各生长指标变化情况Fig.1 The variation of indicators at different growth stages of zebrafish
由图1可见:鱼龄在10 d前,斑马鱼无论是体长率还是体质量的日均增长率率均十分缓慢;17 d后稚鱼能主动捕食活体丰年虾,并能快速吸收并合成自身需要的物质,此时斑马鱼稚鱼体长日均增长率较10 d快速增加,且17 d时体质量日均增长率约是10 d的14倍;24 d时斑马鱼幼鱼的体长、体质量日均增长率均为全生命周期最快的时期,此阶段斑马鱼幼鱼活动范围较17 d时有了较大提高,外表体型均接近成鱼;31 d后斑马鱼幼鱼体长、体质量日均增长率较24 d时均有所下降,但体长日均增长率仍保持次高速率增长,体质量日均增长率较17和24 d时有所减缓,该阶段斑马鱼幼鱼活动范围已涉及整个鱼缸,能够自由游动,外表进一步接近成鱼;60 d时斑马鱼幼鱼体长、体质量日均增长率较31 d时进一步放缓,体长已经达成鱼体长的75%,体质量日均增长率仍然保持较高水平;90 d时斑马鱼体长、体质量日均增长率较60 d时进一步放缓,但由于斑马鱼体长和体质量基数大,该阶段处于最大的绝对增长量;90 d后斑马鱼体长已经接近成鱼平均水平,而体质量则在120 d后与成鱼平均水平相当. 综上,将斑马鱼分为仔鱼阶段(1 d、10 d),稚鱼阶段(17 d),幼鱼阶段(24、31、60 d)和成鱼阶段(90、120 d),符合斑马鱼的生长规律.
2.2 不同生长阶段斑马鱼对Cu2+的毒性差异
我国鱼类急性毒性测试标准方法均采用硬度为250 mg/L的标准稀释水溶液,但其与实际环境中水的硬度存在较大差异[31],而水体硬度又是影响Cu2+水生生物毒性的重要因素之一[9,32-33],故该研究根据实验室自来水钙镁离子浓度,配制了硬度为125 mg/L的模拟自来水,分别研究标准稀释水和模拟自来水下Cu2+对不同生长阶段斑马鱼的毒性,结果如图2所示.

图2 不同水质条件下各生长阶段斑马鱼对Cu2毒性的响应差异Fig.2 The toxicity response of zebrafish to Cu2+ at different growth stages under different water quality conditions
由图2可见:标准稀释水条件下,Cu2+对不同生长阶段斑马鱼的毒性随暴露时间的延长而逐渐增大,Cu2+对斑马鱼各阶段24 h-LC50、48 h-LC50、72 h-LC50、96 h-LC50的几何平均值分别为0.54、0.42、0.38和0.36 mg/L;从不同生长阶段划分来看,Cu2+对斑马鱼的96 h-LC50分别为0.425 mg/L (1 d)、0.768 mg/L (10 d)、0.550 mg/L (17 d)、0.309 mg/L (24 d)、0.334 mg/L (31 d)、0.327 mg/L (60 d)、0.230 mg/L (90 d)和0.180 mg/L (120 d),表明随着鱼龄的增加,Cu2+对斑马鱼的毒性不断增大,不同生长阶段斑马鱼对Cu2+的敏感性顺序为120 d>90 d>24 d>60 d>31 d>1 d>17 d>10 d.
由图2可见:模拟自来水条件下,Cu2+对斑马鱼各生长阶段的毒性随暴露时间的延长而逐渐增大,Cu2+对斑马鱼各生长阶段24 h-LC50、48 h-LC50、72 h-LC50、96 h-LC50的几何平均值分别为0.36、0.28、0.25和0.24 mg/L;从不同生长阶段划分来看,Cu2+对斑马鱼的96 h-LC50分别为0.377 mg/L (1 d)、0.438 mg/L (10 d)、0.366 mg/L (17 d)、0.201 mg/L (24 d)、0.206 mg/L (31 d)、0.189 mg/L (60 d)、0.167 mg/L (90 d)和0.144 mg/L (120 d),结果表明随着鱼龄的增加,Cu2+对斑马鱼毒性增大,不同生长阶段斑马鱼对Cu2+的敏感性顺序为120 d>90 d>60 d>24 d>31 d>1 d>17 d>10 d. 模拟自来水条件下,Cu2+对斑马鱼各生长阶段毒性变化情况与标准稀释水试验结果一致.
2.3 不同生长阶段斑马鱼毒性差异在Cu2+的物种敏感度分布变化
为研究不同生长阶段斑马鱼对Cu2+敏感性差异在Cu物种敏感度分布图中的变化情况,将Cu2+对不同生长阶段斑马鱼96 h-LC50毒性数据加入Cu的物种敏感度分布图中进行比较. 图3为不同生长阶段斑马鱼对Cu2+敏感性在Cu物种敏感度分布图中的位置,其中每个点代表一个生物毒性数据,数据的毒性终点均为标准试验下的LC50或EC50(半数效应浓度),除斑马鱼外,其他物种不进行生长阶段划分. 物种敏感度分级参考文献[34-36]:累积概率小于5%,属于非常敏感;累积概率为5%~15%,属于敏感;累积概率为15%~30%,属于较敏感;累积概率为 30%~50%,属于相对不敏感;累积概率大于50%,属于不敏感.
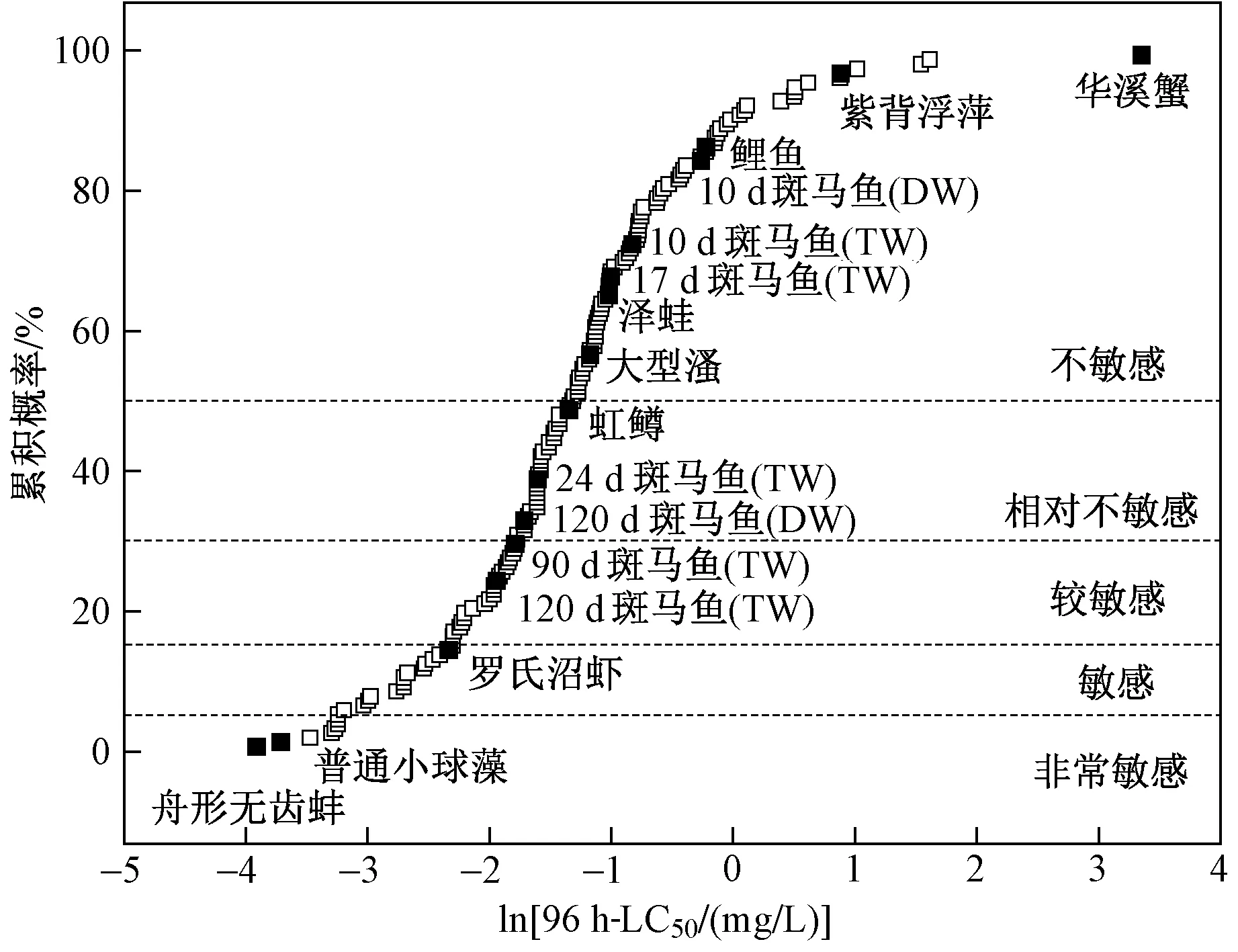
注: DW—标准稀释水; TW—模拟自来水. 除斑马鱼外,其他物种毒性数据来自文献[6-7,28].图3 不同生长阶段斑马鱼在Cu物种敏感度分布Fig.3 Species sensitivity distributions for Cu2+ under different life-stage
由图3可见:Cu2+对水生生物的急性毒性数据量为152个,该研究中最敏感的为模拟自来水下120 d成鱼期斑马鱼(排序第37位),累积概率为24.18%,属于较敏感物种;标准稀释水下120 d成鱼期斑马鱼排在第50位,累积概率为32.68%,属于相对不敏感物种;而10 d仔鱼期斑马鱼在模拟自来水和标准稀释水下的排序分别为第111和129位,累积概率分别为72.55%和84.31%,均属于不敏感物种. 研究发现,不同生长阶段斑马鱼对Cu2+的敏感性在Cu2+的物种敏感度分布中变化显著,且成鱼敏感性高于幼鱼敏感性.
3 讨论
由于发育完善程度、代谢速率等不同,生物的不同生长阶段对污染物毒性响应的敏感性存在差异. 研究[37]表明,生物体在胚胎发育、性分化和性成熟期对污染物较敏感. 该研究将斑马鱼分为8个不同生长阶段,发现1、24、90和120 d的斑马鱼均处于相对敏感期,但敏感性总体趋势为成鱼阶段(120、90 d)>幼鱼阶段(60 、31、24 d)>卵黄囊仔鱼期(1 d)>稚鱼期(17 d)>晚期仔鱼期(10 d).
蒋金花等[22]研究发现,三唑酮对斑马鱼毒性大小的规律为成鱼(90 d)>幼鱼(55 d)>仔鱼(8 d),与笔者研究结果一致. 程艳红等[23]研究斑马鱼不同生长阶段的急性毒性效应时发现,乙草胺、丁草胺对斑马鱼毒性大小表现为仔鱼(8 d)>成鱼(90 d)>幼鱼(55 d),丙草胺对斑马鱼毒性大小表现为仔鱼(8 d)、成鱼(90 d)>幼鱼(55 d),成鱼敏感性大于幼鱼敏感性,与该研究结论一致. 但仔鱼(8 d)毒性敏感性与笔者研究结果不一致,这与不同实验室的仔鱼选取时间和养殖方式有较大关系,因为斑马鱼在8 d左右,其卵黄囊刚耗尽,失去卵黄囊提供营养物质,体弱的斑马鱼容易死亡,从而导致仔鱼(8 d)敏感性增加.
大量研究表明,重金属污染物对无脊椎动物毒性表现为幼年期大于成年期. 如Soegianto等[38-39]研究发现,幼虾对Pb和Cu最敏感;Madhav等[40]研究发现,7 d卤虫藻对Cu最敏感,而成年卤虫藻对Cu最不敏感;Verriopoulos等[41]研究发现,Cu对桡足类水蚤的毒性大小表现为1 d>5 d>10 d. 由于重金属对不同生长阶段鱼类致毒机理复杂,研究结果没有特定的规律. TANG等[42]发现,Cu对15 d白鲟的毒性高于对48及139 d白鲟的毒性,但Cd对48 d白鲟的毒性高于对15和139 d白鲟的毒性. Mcnulty等[43]研究Cu对拟银汉鱼年龄特异性差异时发现,年龄在0、3、5 d的拟银汉比年龄≥7 d的拟银汉对Cu更不敏感,原因是鱼在生长发育过程中由皮肤呼吸为主逐渐转变为腮呼吸为主,随着鱼龄增大,增加腮损伤或功能障碍导致幼鱼的敏感性增加,另外该研究表明拟银汉鱼早幼期阶段腮的表面积增加超过7倍,而皮肤表面积在同一时期只增长了3倍. 该研究发现,Cu2+对斑马鱼各生长阶段的毒性在10、17和24 d随鱼龄的增加而增大,24 d后无显著差异,但31 d略高于24 d. Cu的主要致毒机理为游离Cu (Cu2+)进入细胞质膜,增加质膜的渗透性,引起钠等其他离子流失,破坏离子平衡、提升血液粘度,造成心力衰竭等症状,导致生物死亡[19,44]. 在斑马鱼驯养过程中研究发现,斑马鱼孵化12 h后有50%的仔鱼能平游,但前期生长十分缓慢,呼吸频率低,且10 d仔鱼基本靠卵黄囊维持生命. 该阶段大部分斑马鱼死亡症状为畸形,失去游泳能力等,再停止心跳. 相对于发育相对完善的小鱼来说,仔鱼活动能力弱、新陈代谢慢,且主要靠皮肤与暴露液毒性离子接触,从而减少了暴露液毒性离子进入鱼体内的途径,故该阶段斑马鱼对暴露液毒性物质的敏感性低. 17 d后斑马鱼稚鱼活动能力提升,捕食能力增强、活动频率提高,新陈代谢加快,呼吸频率较之前快,此时斑马鱼可能慢慢由皮肤接触为主转化为鱼鳃接触为主,所以17 d幼鱼对Cu2+敏感性高于10 d幼鱼. 但24、31 d幼鱼对Cu2+的敏感性显著高于17 d幼鱼,斑马鱼在17 d后处于快速生长期,此时斑马鱼幼鱼无论从体长还是体质量均高于前期[45]. 60 d后随着斑马鱼体长和体质量的快速增加,其新陈代谢速率不断加快,极大地增强了鱼各组织(如鱼鳃)与外界溶液的交流,90 d后斑马鱼性成熟,进入繁殖期,鱼体对污染物的敏感性进一步增大,所以该研究中Cu2+对斑马鱼成鱼的毒性大小为成鱼阶段>幼鱼阶段>稚鱼阶段>仔鱼阶段.
4 结论
a) 斑马鱼在食物充足情况下,体长、体质量的变化均符合logistic增长方程,90 d斑马鱼接近成鱼平均体长,且达到生殖水平. 根据斑马鱼生长监测结果确定斑马鱼的不同生长阶段,即卵黄囊仔鱼期(1 d)、晚期仔鱼期(10 d)、稚鱼期(17 d)、早幼期(24 d)、幼鱼期(31 d)、发育期(60 d)、成熟期(90 d)、成鱼期(120 d)等8个生长阶段.
b) 从不同生长阶段划分来看,Cu2+对不同生长阶段斑马鱼的毒性表现为120 d>90 d>24 d>60 d>31 d>1 d>17 d>10 d,随着鱼龄的增加,Cu2+对斑马鱼的毒性逐渐增大;将试验数据结合文献数据构成Cu2+的物种敏感度分布,结果显示成鱼期斑马鱼为较敏感物种,而晚期仔鱼期斑马鱼为不敏感物种,受试生物的不同生长阶段对污染物的敏感性存在较大差异.
参考文献(References):
[1] FESTA R A,THIELE D J.Copper:an essential metal in biology[J].Current Biology,2011,21(21):877-883.
[2] DONNACHIE R L,JOHNSON A C,MOECKEL C,etal.Using risk-ranking of metals to identify which poses the greatest threat to freshwater organisms in the UK[J].Environmental Pollution,2014,194(7):17-23.
[3] FU Zhiyou,WU Fengchang,CHEN Lulu,etal.Copper and zinc,but not other priority toxic metals,pose risks to native aquatic species in a large urban lake in eastern China[J].Environmental Pollution,2016,219:1069-1076.
[4] FU Zhiyou,GUO Wenjing,DANG Zhi,etal.Refocusing on nonpriority toxic metals in the aquatic environment in China[J].Environmental Science & Technology,2017,51(6):3117-3118.
[5] 李强,刘云庆,陈望香,等.新疆地表水体重金属生态风险评估[J].中国环境科学,2018,38(5):1913-1922.
LI Qiang,LIU Yunqing,CHEN Wangxiang,etal.Ecological risk assessment of heavy metals in water of Xinjiang Area[J].China Environmental Science,2018,38(5):1913-1922.
[6] 吴丰昌,冯承莲,曹宇静,等.我国铜的淡水生物水质基准研究[J].生态毒理学报,2011,6(6):617-628.
WU Fengchang,FENG Chenglian,CAO Yujing,etal.Aquatic life ambient freshwater criteria for copper in China[J].Asian Journal of Ecotoxicology,2011,6(6):617-628.
[7] 张旭,付卫强,冯承莲,等.我国淡水中铜的水质基准及生态风险评估研究[J].环境工程,2016,34(5):156-160.
ZHANG Xu,FU Weiqiang,FENG Chenglian,etal.Water quality criteria and ecological risk assessment of copper in Chinese freshwaters[J].Environmental Engineering,2016,34(5):156-160.
[8] 周永欣,周仁珍,尹伊伟.在不同水硬度下铜对草鱼,鲢和大鳞泥鳅的急性毒性[J].暨南大学学报(自然科学与医学版),1992(3):62-67.
ZHOU Yongxin,ZHOU Renzhen,YIN Yiwei.Acute toxicity of copper to the grass carp,silver carp and loach under different water hardness[J].Journal of Jinan University (Natural Science),1992(3):62-67.
[9] 王伟莉,焦聪颖,闫振广,等.水体硬度对铜和镉生物毒性的影响[J].环境工程技术学报,2013,3(3):272-278.
WANG Weili,JIAO Congying,YAN Zhenguang,etal.Effects of water hardness on ecotoxicity of cadmium and copper to aquatic organisms[J].Journal of Environmental Engineering Technology,2013,3(3):272-278.
[10] 熊小琴,罗思,吴本丽,等.不同硬度条件下Cd2+和Cu2+对稀有鮈鲫的急性毒性[J].生态毒理学报,2016,11(3):316-322.
XIONG Xiaoqin,LUO Si,WU Benli,etal.Acute toxicity of cadmium and copper to gobiocypris rarus under different water hardness[J].Asian Journal of Ecotoxicology,2016,11(3):316-322.
[11] PLAYLE R C,GENSEMER R W,DIXON D G.Copper accumulation on gills of fathead minnows:influence of water hardness,complexation and pH of the gill micro-environment[J].Environmental Toxicology & Chemistry,2010,11(3):381-391.
[12] DE-SCHAMPHELAERE K A,JANSSEN C R.Effects of dissolved organic carbon concentration and source,pH,and water hardness on chronic toxicity of copper toDaphniamagna[J].Environmental Toxicology & Chemistry,2004,23(5):1115-1122.
[13] DE-SCHAMPHELAERE K A,JANSSEN C R.A biotic ligand model predicting acute copper toxicity forDaphniamagna:the effects of calcium,magnesium,sodium,potassium,and pH[J].Environmental Science & Technology,2002,36(1):48-54.
[14] 黄圣彪,王子健.天然水体中铜的形态及其对Q67淡水发光菌的毒性作用[J].环境科学研究,2003,16(2):43-46.
HUANG Shengbiao,WANG Zijian.Speciation of copper in natural waters and its toxicity to Q67 freshwater luminescence baceria[J].Research of Environmental Sciences,2003,16(2):43-46.
[15] 胡释尹,李非里,方小满.溶解性有机质对自然水体中重金属生物有效性评价的影响[J].环境科学与技术,2016,39(1):27-31.
HU Shiyin,LI Feili,FANG Xiaoman.Effect of dissolved organic matter in evaluating heavy metals bioavailability in natural water[J].Environmental Science & Technology (China),2016,39(1):27-31.
[16] WANG Chunyan,CHEN Han,WU K B,etal.Application of the biotic ligand model to predict copper acute toxicity to Medaka fish in typical Chinese rivers.[J].Water Science & Technology,2011,64(6):1277-1283.
[17] 王佳佳,徐超,屠云杰,等 斑马鱼及其胚胎在毒理学中的试验研究与应用进展[J].生态毒理学报,2007,2(2):123-135.
WANG Jiajia,XU Chao,TU Yunjie,etal.Exper imental research and application of zebrafish and embryos in toxicology[J].Asian Journal of Ecotoxicology,2007,2(2):123-135.
[18] 刘在平,张松林.斑马鱼在环境监测中的应用[J].江苏农业科学,2011,39(2):486-488.
[19] 赵巧雅,孙雪婧,王玲玲,等.铜对斑马鱼鳃的损伤及其作用机制[J].解剖学报,2018,49(3):367-373.
ZHAO Qiaoya,SUN Xuejing,WANG Lingling,etal.Gill injury by copper and its mechanism in zebrafish[J].Acta Anatomica Sinica,2018,49(3):367-373.
[20] 彭涛,王思思,任琳,等.磷酸三苯酯对斑马鱼早期生命阶段的神经毒性研究[J].生态毒理学报,2016,11(1):254-260.
PENG Tao,WANG Sisi,REN Lin,etal.Neurotoxicity of triphenyl phosphate on the early life stages of zebrafish[J].Asian Journal of Ecotoxicology,2016,11(1):254-260.
[21] YANG Y,QI S,WANG D,etal.Toxic effects of thifluzamide on zebrafish (Daniorerio)[J].Journal of Hazardous Materials,2016,307(4):127-136.
[22] 蒋金花,吴声敢,陈江滨,等.三唑酮对斑马鱼和稀有鮈鲫不同生长阶段的急性毒性比较[J].生态毒理学报,2015,10(5):150-156.
JIANG Jinhua,WU Shengan,CHEN Jiangbin,etal.Acute toxicity effects of triadimefon on different life stages of zebrafish (Daniorerio) and Chinese rare minnow (Gobiocyprisrarus)[J].Asian Journal of Ecotoxicology,2015,10(5):150-156.
[23] 程艳红,葛婧,胡高洁,等3种酰胺类除草剂对斑马鱼不同生长阶段的急性毒性效应[J].生态毒理学报,2017,12(6):171-178.
CHENG Yanhong,GE Jin,HU Gaojie,etal.Acute toxicity effects of three amide herbicides to different life stages of zebrafish (Daniorerio)[J].Asian Journal of Ecotoxicology,2017,12(6):171-178.
[24] 杨阳.噻呋酰胺对斑马鱼的毒性及作用机制研究[D].北京:中国农业大学,2017:22-28.
[25] KIMMEL C B,BALLARD W W,KIMMEL S R,etal.Stages of embryonic-development of the zebrafish[J].Developmental Dynamics,1995,203(3):253-310.
[27] OECD.Guideline for testing of chemicals No.203 fish,acute toxicity test[S].Paris:Organization for Economic Co-Operation and Development,2019.
[28] ZHANG Yahui,ZANG Wenchao,QIN Lumei,etal.Water quality criteria for copper based on the BLM approach in the freshwater in China[J].Plos One,2017,12(2):1-13.
[29] 环境保护部.HJ 831—2017淡水水生生物水质基准制定技术指南[S].北京:中国标准出版社,2017.
[30] 刘娜,金小伟,王业耀,等.生态毒理数据筛查与评价准则研究[J].生态毒理学报,2016,11(3):1-10.
LIU Na,JIN Xiaowei,WANG Yeyao,etal.Review of criteria for screening and evaluating ecotoxicity data[J].Asian Journal of Ecotoxicology,2016,11(3):1-10.
[31] 周怀东,彭文启,杜霞,等.中国地表水水质评价[J].中国水利水电科学研究院学报,2004,2(4):255-264.
ZHOU Huaidong,PENG Wenqi,DU Xia,etal.Assessment of surface water quality in China[J].Journal of China Institute of Water Resources and Hydropower Research,2004,2(4):255-264.
[32] TAN Qiaoguo,WANG Wenxiong.Acute toxicity of cadmium in daphnia magna under different calcium and pH conditions:importance of influx rate[J].Environmental Science & Technology,2011,45(5):1970-1976.
[33] US Environmental Protection Agency.Aquatic life ambient freshwater quality criteria-copper[R].Washington DC:Office of Water,2001:2-4.
[34] FENG Chenglian,WU Fengchang,DYER S D,etal.Derivation of freshwater quality criteria for zinc using interspecies correlation estimation models to protect aquatic life in China[J].Chemosphere,2013,90(3):1177-1183.
[35] VAN-VLAARDINGEN P L A,TRAAS T P,WINTERSEN A M,etal.ETX20-A program to calculate hazardous concentration and fraction affected,based on normally distributed toxicity data[R].Bilthoven,Netherlands:National Institute for Public Health and the Environment(RIVM),2004.
[36] 王晓南,郑欣,闫振广,等.水质基准鱼类受试生物筛选[J].环境科学研究,2014,27(4):341-348.
WANG Xiaonan,ZHEN Xin,YAN Zhenguang,etal.Screening of native fishes for deriving aquatic life criteria[J].Research of Environmental Sciences,2014,27(4):341-348.
[37] DEL S A,HENDRIKS A J,LENDERS H J,etal.Development and application of the SSD approach in scientific case studies for ecological risk assessment[J].Environmental Toxicology & Chemistry,2016,35(9):2149-2161.
[38] SOEGIANTO A,ASIH A Y P,IRAWAN B.Lead toxicity at different life stages of the giant prawn (de Man):considerations of osmoregulatory capacity and histological changes in adult gills[J].Marine & Freshwater Behaviour & Physiology,2016,49(3):187-200.
[39] ASIH A Y P,IRAWAN B,SOEGIANTO A.Effect of copper on survival,osmoregulation,and gill structures of freshwater prawn (Macrobrachiumrosenberg,de Man) at different development stages[J].Marine and Freshwater Behaviour and Physiology,2013,46(2):75-88.
[40] MADHAV M R,DAVID S E M,KUMAR R S S,etal.Toxicity and accumulation of copper oxide (CuO) nanoparticles in different life stages of Artemia salina[J].Environmental Toxicology & Pharmacology,2017,52:227-238.
[41] VERRIOPOULOS G,MORAÏTOU-APOSTOLOPOULOU M.Differentiation of the sensitivity to copper and cadmium in different life stages of a copepod[J].Marine Pollution Bulletin,1982,13(4):123-125.
[42] TANG Song,DOERING J A,SUN Jianxian,etal.Linking oxidative stress and magnitude of compensatory responses with life-stage specific differences in sensitivity of white sturgeon (Acipensertransmontanus) to copper or cadmium[J].Environmental Science & Technology,2016,50(17):9717-9726.
[43] MCNULTY H R,ANDERSON B S,HUNT J W,etal.Age-specific toxicity of copper to larval topsmeltAtherinopsaffinis[J].Environmental Toxicology and Chemistry,1994,13(3):487-492.
[44] 王振,金小伟,王子健.铜对水生生物的毒性:类群特异性敏感度分析[J].生态毒理学报,2014,9(4):640-646.
WANG Zhen,JIN Xiaowei,WANG Zijian.Taxon-specific sensitivity differences of copper to aquatic organisms[J].Asian Journal of Ecotoxicology,2014,9(4):640-646.
[45] ZHU Ya,SU Guangong,YANG Dandong,etal.Time-dependent inhibitory effects of Tris (1,3-dichloro-2-propyl) phosphate on growth and transcription of genes involved in the GHIGF axis,but not the HPT axis,in female zebrafish[J].Environmental Pollution,2017,229:470-478.

