强冷应激对阿勒泰及杂交种羔羊脂质代谢相关基因mRNA表达量及脂肪沉积的影响
汪骁轩,高静雯,魏殿华,高健鹏,章 莲,张 莉,齐亚银
(宁夏大学农学院,宁夏银川 750021)
能够引起应激反应的刺激称之为应激源。寒冷刺激属于应激源的一种,能够改变动物机体稳定的内环境,进而影响其生理和行为并产生许多异常反应。动物长期处于冷应激环境中,会引起机体产生一系列生理反应,如影响到血液中理化指标、产肉性能、神经内分泌系统的正常代谢、机体激素水平等[1]。其中脂肪代谢是体内重要且复杂的生化反应,指生物体内脂肪在各种相关酶的帮助下,消化吸收、合成与分解的过程,加工成机体所需要的物质,保证正常生理机能的运作,对于生命活动具有重要意义。其中脂肪酸合成酶(Fatty Acid Synthase,FAS)与脂蛋白脂酶(Lipoprotein Lipase,LPL)在脂肪代谢中起到重要作用。FAS基因在组织中的含量对动物体内脂肪代谢具有重要的调控作用,其含量的多少可以显著影响甘油三酯(TG)在机体内的含量[1];LPL主要由脂肪组织和骨骼肌等所分泌的一种蛋白水解酶,主要位于血管内皮表面,它在TG合成携带中起着关键作用,也是机体内TG降解反应的限速酶[1]。
本实验旨在研究强冷应激后阿勒泰羊、阿勒泰和萨福克杂交羊、阿勒泰断尾羊的FAS、LPL基因mRNA的表达变化、血脂含量及屠宰性能,揭示冷应激对3种绵羊脂肪的沉积和代谢的影响,初步探讨冷应激与血脂之间的关系,为新疆绵羊抗寒育种工作提供理论依据。
1 材料与方法
1.1 实验动物 选择体况相近、体重(34±4)kg 的 6月龄阿勒泰公羔羊、阿勒泰羊与萨福克杂交一代公羔羊、断尾阿勒泰公羔羊,每个品种3只,18 只分为常温组(15~20℃)与冷应激组(-25~-30℃)。试验前和试验期间自由采食和饮水,每组饲养条件一致。饲养12 d后进行屠宰,屠宰前禁食 24 h,并称量试验羊的宰前活重,屠宰后分别进行屠宰性能的测定。
1.2 实验仪器 全自动酶标仪(PowerWave XS2)购自美国 BioTek 仪器有限公司,实时荧光定量 PCR 仪(Roche LightCycler®igh),高速冷冻离心机(Sigma,2-16k),水浴锅(DKB-501A),PCR 仪(BIO-RAD),UVP 凝胶成像仪,超净工作台,低温冰箱,电泳仪,电子称(Sartorius group,Acculab ALC1100.2),微量移液器(eppendorf)。
1.3 主要试剂 绵羊高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆固醇、甘油三酯测试盒均购自南京建成生物科技有限公司。Trizol、DEPC、DNA Marker、Mix 购自天根生物科技服务有限公司;PrimeScript@RT Reagent kit 反转试剂盒(批号:RR047A)购自TaKaRa公司;LightCycler 480 SYBR Green I Master;异丙醇、无水乙醇购自北京华美生物工程公司。
1.4 引物设计与合成 以绵羊LPL、FAS、GAPDH的cDNA为模板,利用 Primer Premier 5.0软件设计引物(表1),引物由北京六合华大基因有限公司合成。
1.5 样品的采集与处理 屠宰前,每只绵羊采 2 份4~5 mL血样,均用肝素抗凝管暂时储存,全部血样采集完毕后其中1份1 000 rpm离心5min,分装待测血浆胆固醇、甘油三酯、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇的含量,分装后的样品存放于-20℃冰柜。屠宰后,采集阿勒泰羊、杂交羊和断尾羊胸部肌间、肩胛间、腹股沟的脂肪,立即放入液氮罐速冻转入-80℃冰箱中进行保存。
1.6 总 RNA 提取与反转录 将采集好的胸部、腹股沟和肩胛间脂肪组织,迅速编号并放于盛有液氮的碾钵中。根据RNA提取试剂盒及反转录试剂盒说明操作提取总RNA并反转录为cDNA。反转录产物可直接用于PCR扩增。
1.7 目的基因PCR反应 利用常规PCR反应对组织样品中LPL和FAS基因进行扩增,PCR反应体系20 μL:cDNA 2 μL,mix10 μL,上、下游引 物(10 pmol/L)各 0.4 μL,超纯水 7.2 μL。PCR 反应条件:95℃预变性 5 min;95℃变性30 s,54℃退火30 s,72℃延伸30 s,35个循环;72℃延伸5 min。用2%琼脂糖凝胶电泳检测PCR产物。
1.8 实时荧光定量 PCR 反应 PCR反应体系20 μL:模板 2 μL,SYBR 10 μL,上、下游引物(10 pmol/L)各0.4 μL,ddH2O 7.2 μL。PCR 反应条件:95℃预变性5 min;94℃变性30 s,53℃退火30 s,72℃延伸30 s,40个循环。反应结束后,计算冷应激前后阿勒泰羊、杂交羊、断尾羊胸部肌间、肩胛间、腹股沟脂肪的各基因的相对表达量,每个组织重复3次。
1.9 血脂指标测定 使用ELISA方法检测绵羊血液中总胆固醇(T-CHO)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)含量。
1.10 屠宰性能的测定 测量绵羊活重、胴体重、净肉重、眼肌面积、GR值、背膘厚、屠宰率、脂肪重、肌肉重、内脏重。
1.11 统计分析 试验数据采用Excel 2010进行初步整理,用SPSS11.0软件中单因素分析进行差异性分析。P<0.05为差异显著。
2 结果
2.1FAS、LPL基因的RT-PCR扩增 以RNA反转录的cDNA为模板,以FAS、LPL的上、下游引物扩增,得到256、181 bp条带(图1)。可以看出,PCR扩增条带亮度明显,说明cDNA模板扩增稳定。
2.2 冷应激前后3种绵羊不同部位脂肪LPL、FAS基因含量变化
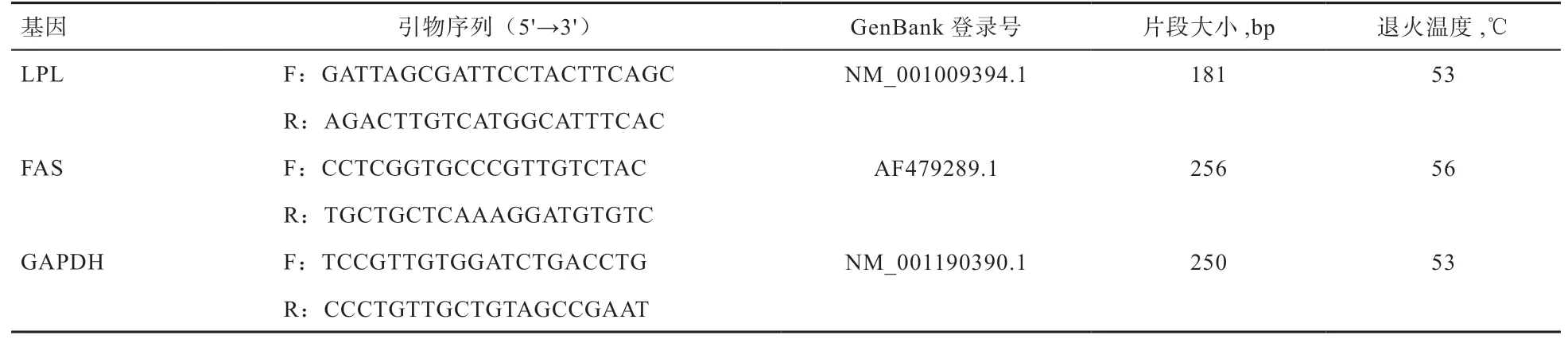
表1 基因的引物序列
2.2.1 冷应激后阿勒泰、杂交种及断尾羔羊不同脂肪中FASmRNA表达量的变化 由表 2可以看出,与冷应激前相比,冷应激后阿勒泰羊与杂交羊胸部脂肪FASmRNA的表达量升高,其中杂交羊与冷应激前对比差异显著,而冷应激后断尾羊FASmRNA表达量下降且冷应激后FASmRNA表达量呈现杂交羊>阿勒泰羊>断尾羊;与冷应激前相比,冷应激后3种羔羊肩胛间脂肪FASmRNA的表达量呈升高趋势,其中杂交羊与冷应激前对比差异显著且呈现杂交羊>阿勒泰羊>断尾羊;冷应激后3种羔羊腹股沟脂肪FASmRNA的表达量都增高,其中阿勒泰羊与断尾羊与冷应激前相比差异显著且呈现阿勒泰羊>断尾羊>杂交羊。
2.2.2 冷应激后阿勒泰、杂交种及断尾羔羊不同脂肪中LPLmRNA表达量的变化 根据表 3可以看出,冷应激后阿勒泰羊与杂交羊胸部脂肪LPLmRNA的表达量增高,而断尾羊与冷应激前相比呈显著下降趋势且冷应激后FASmRNA表达量呈现杂交羊>阿勒泰羊>断尾羊;冷应激后肩胛间脂肪LPLmRNA的表达量冷应激组呈升高趋势,其中杂交羊和断尾羊与冷应激前对比差异显著且呈现杂交羊>断尾羊>阿勒泰羊;冷应激后三种羔羊腹股沟脂肪LPL的表达量都显著上升且呈现阿勒泰羊>杂交羊>断尾羊。
2.3 冷应激前后3种绵羊血脂指标变化 根据表 4可以看出,冷应激后阿勒泰羊与杂交羊血液中T-CHO含量显著高于应激前,断尾羊应激后T-CHO含量与冷应激前常温条件下相比显著降低;冷应激后阿勒泰羊与断尾羊血液中TG含量升高,阿勒泰羊与冷应激前相比差异显著,冷应激后杂交羊TG含量有所下降;3种羊冷应激后血液中HDL含量高于冷应激前且杂交羊与断尾羊差异显著;3种羊冷应激后血液中LDL显著高于冷应激前。
2.4 冷应激前后3种绵羊屠宰性能变化 根据表 5可以看出,3种羊冷应激后与冷应激前常温条件下相比,宰前活重、胴体重、脂肪重、肌肉重、肉重、骨重、肉骨比、屠宰率、净肉率、背膘厚、GR值、眼肌面积均有所下降,其中胴体重、肌肉重、肉重、骨重、背膘厚、GR值、眼肌面积差异显著,皮重有所上升,脏器变化不明显。
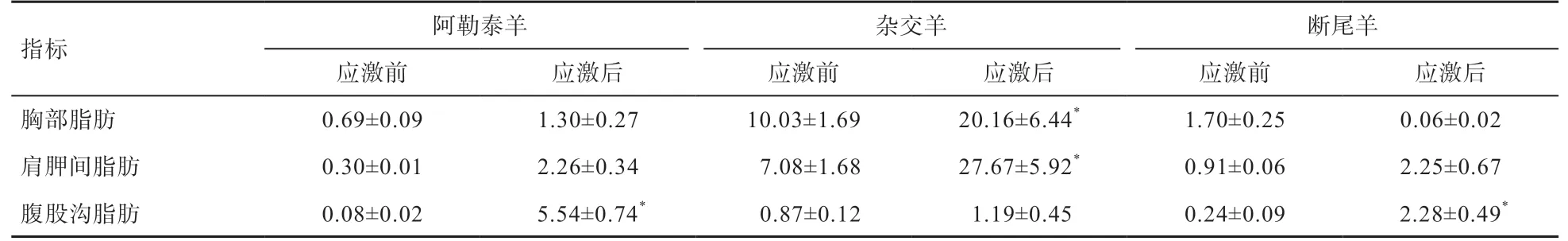
表2 冷应激前后绵羊FAS mRNA 的表达量
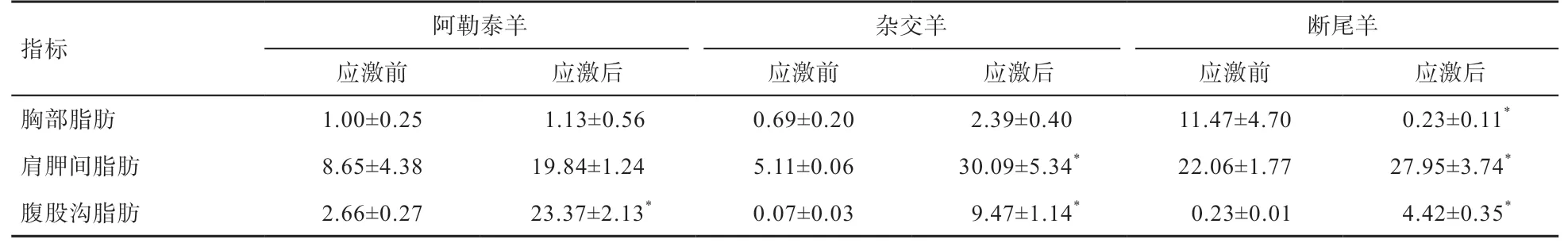
表3 冷应激前后绵羊LPL mRNA的表达量
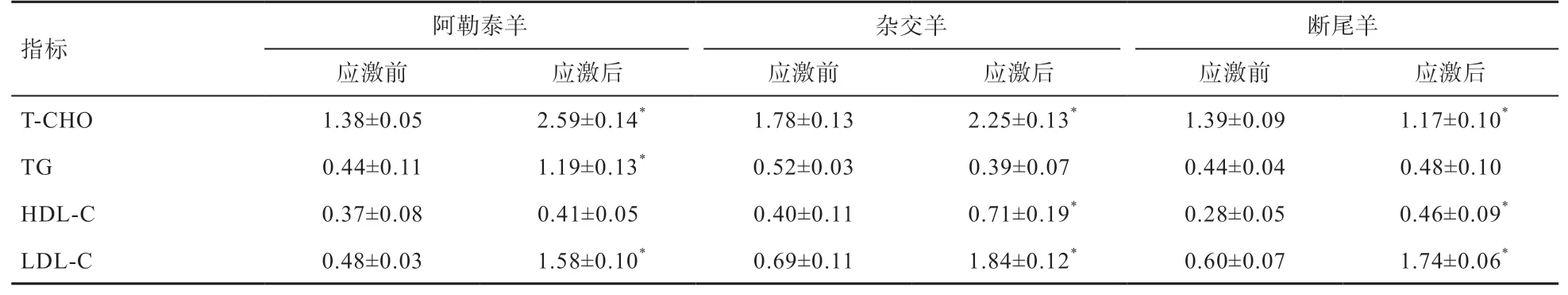
表4 冷应激前后绵羊血脂指标变化 mmol/L
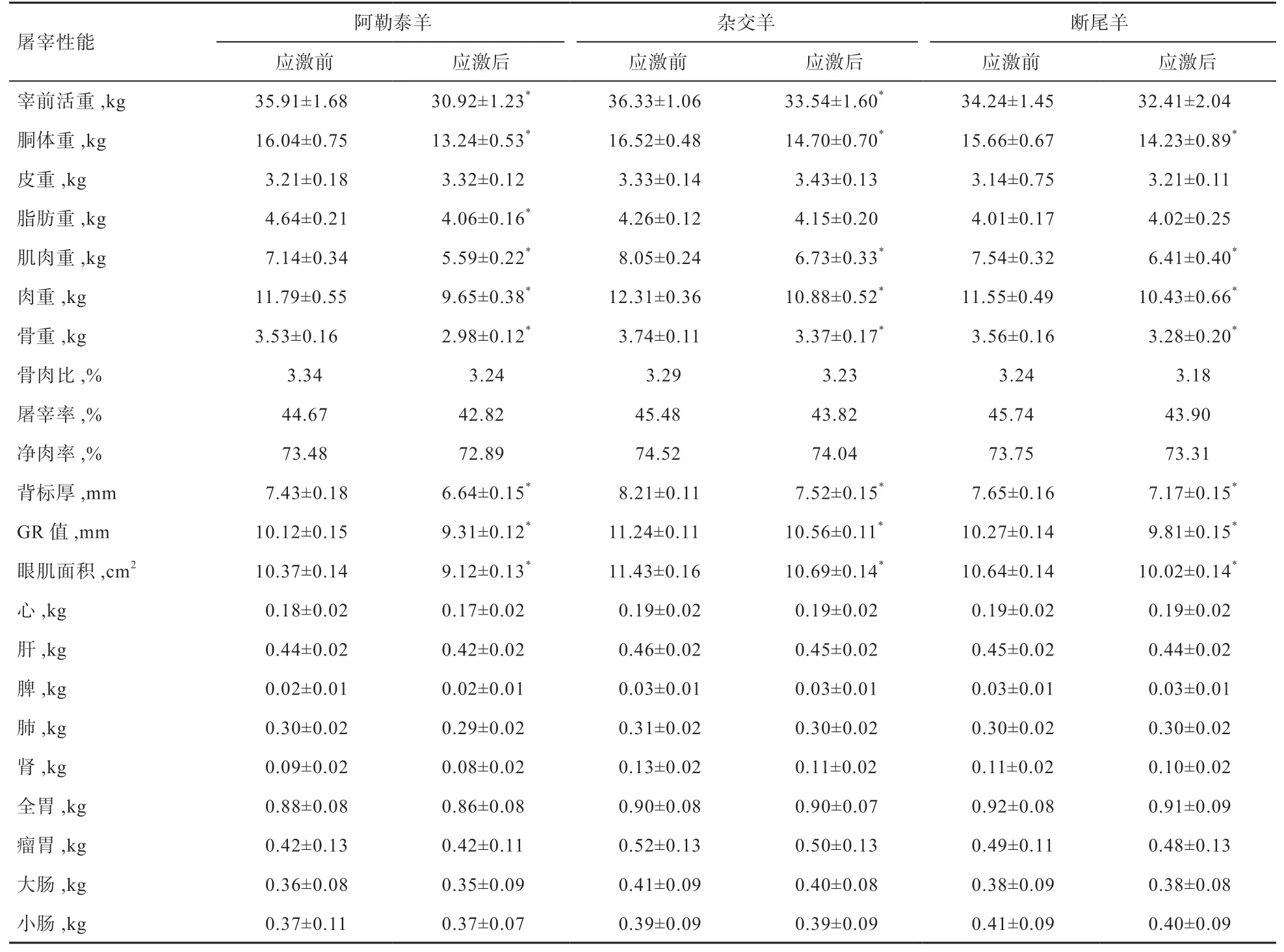
表5 冷应激前后绵羊屠宰性能变化
3 讨 论
3.1 冷应激对绵羊FAS、LPL基因含量变化的影响 机体内脂肪的合成代谢与分解代谢始终处于一个动态平衡状态,其中主要是由TG的酯化和分解2个过程主导,其相对速度决定了脂肪的分解或储存状态。FAS是脂肪酸合成的主要关键酶,其活性的高低直接控制着脂肪合成的强弱,FAS基因是体脂沉积性状和肉质性状的重要候选基因[2-3]。LPL则主要催化乳糜微粒和极低密度脂蛋白中的TG水解成甘油和脂肪酸,其对脂肪酸运输和脂肪细胞能量代谢有重要调节作用。LPL活性的高低是脂肪蓄积程度的最早标志之一。因此通过对FAS和LPL基因的研究有助于深入了解脂肪合成与代谢过程。
张权[4]与杨恒东等[5]对鸡组织LPLmRNA 表达进行研究,结果均显示鸡的肝脏、腹脂和肌肉等组织LPLmRNA 表达量有显著差异,其中杨恒东[5]研究结果中表达量依次为肌肉>腹脂>肝脏,张权[4]的研究结果为肝脏>腿肌>胸肌>腹脂。它在脂肪以及不同部位肌肉中的表达量最终会影响这部分脂肪是究竟是用来储存还是氧化分解提供能[1]。本实验不同品种的绵羊组织LPLmRNA 表达量存在组织差异,而寒冷应激后阿勒泰羊腹股沟脂肪>肩胛间脂肪>胸部肌间脂肪,杂交羊与断尾羊肩胛间脂肪>腹股沟脂肪>胸部肌间脂肪,这与张权[4]、杨恒东等[5]的实验结果不相符,可能是由于实验动物不同,而且前期也没有任何冷处理。本研究中冷应激下阿勒泰羊主要动员腹股沟脂肪,而杂交羊和断尾阿勒泰羊主要动员肩胛间脂肪,说明不同品系绵羊各个部位脂肪LPL含量存在差异,冷应激下动员的脂肪部位也会有所差别,表明LPLmRNA表达量具有组织特异性,且冷应激下主要影响了肩胛间脂肪和腹股沟脂肪的动员,使机体产热量增加,以抵抗冷应激。
FAS是脂肪酸生物合成过程中的关键酶,主要作用是合成长链脂肪酸。多数研究表明,热应激可以增加脂肪沉积的趋势[6],动物体脂沉积所需要的脂肪酸大多是来自脂肪酸的合成。刘梅[7]研究发现,急性热应激显著增加了肉仔鸡肝脏FASmRNA 相对表达水平,从而促进了肝脏的脂肪酸合成,同时急性热应激对腹脂FAS表达量没有显著影响。单体中等[8]研究发现,FAS基因在1 日龄到 28 周龄仔猪腹脂中的表达呈逐渐升高的趋势。本实验结果表明,冷应激后阿勒泰羊与杂交羊胸部脂肪FAS含量升高,其中杂交羊与常温组对比差异显著,而冷应激后断尾羊比常温组表达下降;冷应激后3种羊肩胛间脂肪FAS含量与常温组对比呈升高趋势,其中杂交羊差异显著;冷应激后3种羊腹股沟脂肪FAS含量都增高,且阿勒泰羊与断尾羊与常温组对比差异显著。本实验中,冷应激后阿勒泰羊与断尾羊FASmRNA表达情况为腹股沟脂肪>肩胛间脂肪>胸部肌间脂肪,杂交羊为肩胛间脂肪>胸部肌间脂肪>腹股沟脂肪。
本研究结果发现,冷应激前后肩胛间脂肪和腹股沟脂肪中FAS和LPL基因变化趋势相同,但冷应激前后LPL的表达量的差值要远远高于FAS表达量的差值,这说明了在冷应激下机体耗能增加,脂肪代谢加快,集体总体呈现脂肪消耗大于合成过程。
4.2 冷应激对绵羊血脂指标影响 正常生理状态下,T-CHO浓度与LDL和HDL的含量有关,可能还与类群等因素有关。李柔[9]实验表明,冷应激会使肉鸡体内胆固醇含量升高;而梁鸿雁等[10]实验表明,在冷应激环境中,奶牛乳清胆固醇含量与正常对比无显著变化。这说明冷应激对T-CHO的影响可能与动物种类有关。本研究表明,冷应激后阿勒泰羊与杂交羊血液中T-CHO含量高于应激前且差异显著,机体内T-CHO含量的高低与血脂的代谢过程有关,说明了冷应激可能会对阿勒泰羊和杂交羊血液中胆固醇的代谢造成一定的影响;而断尾羊应激后T-CHO含量与应激前相比显著降低,可能断尾后在冷应激环境下其加速了胆固醇的代谢。
白色脂肪组织中的TG是高等动物主要的能量储备物。任冰稳等[11]观察束缚应激后大鼠血脂和PPARα、L-CPT-ImRNA和蛋白的变化,发现束缚应激后大鼠血清中游离脂肪酸(Free Fatty Acid,FFA)、TG和HDL-C水平升高。本研究结果表明,经过冷应激之后,阿勒泰羊与断尾羊血液中TG含量升高,冷应激后杂交羊TG含量有所下降,这与任冰稳等实验结果相似,说明杂交品系胴体质量发生改变后,其在冷应激过程中其血脂的代谢也会有所差异。
LDL-C可反映低密度脂蛋白(LDL)的多少,HDL-C作用亦是如此。高密度脂蛋白(HDL)是血清蛋白的一种,主要功能是促进脂肪分解,俗称“血管清道夫”。LDL是富含胆固醇的脂蛋白,主要功能是把胆固醇运输到全身各处细胞,过多的 LDL会使胆固醇黏附于血管壁造成各种疾病。有研究表明,不同冷应激持续时间下,肉鸡体内HDL、LDL含量有波动性变化,总体趋向增加[9]。本研究表明,在冷应激条件下3种羊血液中HDL 与LDL含量都高于冷应激前,但阿勒泰羊HDL与冷应激前差异不明显,可能是因为在寒冷环境下,TG分解增多从而导致LDL增多,而HDL与LDL在体内处于动态平衡,所以HDL含量也会有所升高,说明冷应激对3种绵羊HDL与LDL都有一定的影响。
4.3 冷应激对绵羊屠宰性能影响 冷应激不仅影响动物机体的生物化学代谢,也影响动物脂肪沉积,引起骨肉比改变,从而影响其生产性能。有研究报道,严寒环境对动物肉质指数影响较大,使背膘中的单不饱和脂肪酸浓度升高,多不饱和脂肪酸浓度降低,也易产生PSE肉[12]。田允波[13]发现猪饲养在低温条件下时,因为在寒冷环境中生长的时间太长,使其与适宜温度下圈养的猪相比,耳、尾、吻突和鼻以及腿均显示出短小的形态特征,体脂的囤积大部分集中在腹腔里,并且皮下脂肪较少。本实验发现,3种羊冷应激后宰前活重、胴体重、脂肪重、肌肉重、肉重、骨重、肉骨比、屠宰率、净肉率、背膘厚、GR值、眼肌面积均有所下降,其中胴体重、肌肉重、肉重、骨重、背膘厚、GR值、眼肌面积差异显著,皮重有所上升,脏器的变化不明显。说明在寒冷环境中,绵羊为了抵御寒冷,需要更厚的毛皮抵御寒冷以及消耗更多的脂肪来维持正常生理活动,从而会影响其脂肪与肌肉的含量。本研究同时发现,冷应激后3种羊的屠宰率与净肉率均有所下降,说明冷应激对屠宰性能有一定的影响;而冷应激对3种绵羊脏器影响较小,冷应激前后脏器重量未发生大的变化。
4 结 论
本实验通过检测FAS和LPL基因在3种绵羊体内冷应激后的mRNA表达量以及血脂指标发现,3种羊不同部位脂肪代谢效果不相同,从整体上看,阿勒泰羊脂肪代谢速度最慢;此外,3种羊血液指标发生一定变化,并且冷应激对杂交羊和断尾羊影响大于对阿勒泰羊影响。以上结果说明了在寒冷环境下3种绵羊都会消耗一部分脂肪来为机体提供能量去适应外界环境的变化,但杂交羊和断尾羊相较于阿勒泰羊会消耗更多的脂肪来供能。
——山上的村庄

