术前弥散张量成像面神经重建在听神经瘤手术中的应用☆
吴学东 夏海坚 钟东 何大海 史东杰 唐文渊 郑履平 孙晓川
听神经瘤因位置深在、毗邻重要结构,且与面神经关系密切,目前治疗仍存在挑战。肿瘤术前常压迫面神经致其功能受损,同时肿瘤与面神经相对位置的不确定加剧术中面神经保护的困难,导致术后严重面瘫的可能,严重影响患者术后生活质量[1-3]。故在安全切除肿瘤的同时,有效保护面神经功能成为手术的重要目标。若术者术前知晓面神经和肿瘤的毗邻关系,术中便能更具目的性发现并保护好面神经,降低面神经损伤发生率。遗憾的是,目前尚缺乏成熟的术前面神经定位手段[1]。弥散张量成像(diffusion tensor imaging,DTI)可在活体条件下无创显示神经纤维束走行,为实现上述目标提供了可能。国内外已有利用DTI技术行听神经瘤术前面神经重建的报道,但重建技术尚欠成熟,且多为回顾性研究,缺乏系统研究[1,4-6]。本研究旨在通过前瞻性研究,进一步探讨术前DTI面神经重建技术在听神经瘤术中面神经功能保护的具体价值。
1 资料与方法
1.1 研究对象纳入标准:未经治疗的单发听神经瘤患者。排除标准:①有影响面神经功能的其他疾病患者;②合并高血压、糖尿病等慢性疾病患者;③拒绝手术治疗患者。本研究共纳入2017年5月至2019年5月于我院手术的听神经瘤共62例。入院后采用抽签法随机分为DTI组和对照组,其中DTI组30例,对照组32例(表1)。本研究已获重庆医科大学附属第一医院伦理委员会批准。
1.2 影像学检查所有患者入院后常规行岩骨薄层CT检查。对照组予美国GE公司3.0 T MR机器行平扫及增强扫描,DTI组在此基础上加做3D T1WI和DTI序列扫描。DTI序列参数:TR=6400 ms,TE=103 ms,矩阵=128×128,FOV=240 mm×240 mm,层距0 mm,层厚3.5 mm,层数60层,60个弥散方向。扫描数据上传至我院影像PACS系统,通过其自带工具测量肿瘤各向最大径,并收集肿瘤形态学相关信息。
1.3 面神经重建方法将扫描的DICOM数据导入3D Slicer 4.10.1中进行面神经重建。首先将DICOM数据转换成Nrrd格式,通过软件的Diffusion Tensor Estimation模块对原始弥散加权图像数据进行DTI分析,使用Diffusion Tensor Scalar Maps模块生成各向异性分数(fractional anisotropy,FA)图。使用Editor模块绘制感兴趣区 (region of interest,ROI),ROI根据3DT1WI图像选择患侧内听道口和面神经出脑干区,应用Tractography Seeding模块进行面神经的追踪重建。FA下限设定为0.1,上限设定为0.2,以0.01梯度逐渐增加FA值以求获得最佳重建效果,通过调整模块内ROI、FA 阈值、Stopping Track Curvature等大小排除走行方向明显不符的纤维。肿瘤三维重建依据3D T1WI序列应用Segment Volume模块进行,将构建好的肿瘤三维影像与面神经重建结果融合显示,以便直观了解面神经的走行及与肿瘤的位置关系。
1.4 手术方法两组病例均由同一主刀医师经枕下乙状窦后入路行肿瘤切除。使用自发面肌电图监护整个手术过程,使用诱发性面肌电图主动辨识面神经。
对照组病例,在术中电生理监测明确操作区域无面神经走行后,行肿瘤瘤内分块切除,并游离肿瘤各向边界,显露面神经脑干段;再磨开内听道后壁,切除肿瘤并显露面神经内听道段;最后从脑干段及内听道段两侧会师,全切除肿瘤。对于肿瘤和面神经粘连紧密者,酌情行次全切除。
DTI组则根据术前面神经重建结果,有目的性地暴露局部并解剖面神经,在临近面神经走行区域时提前降低双极电凝功率,以减少对面神经可能的热刺激损伤,其余手术原则同对照组。
1.5 DTI面神经重建结果准确性评估手术进程中,利用术中电生理监测确定的面神经走行作为金标准,结合显微镜下观察,与术前利用DTI技术重建的面神经走形路径相比较,评价DTI面神经重建的准确率。根据解剖体位将脑池段面神经与肿瘤的位置关系分为六种:面神经位于肿瘤的上极、下极、腹侧上方、腹侧中央、腹侧下方及肿瘤后方。
1.6 术后评估切除程度评估:所有病例术后3 d行增强MRI检查,根据术中镜下所见及术后影像学结果,将肿瘤切除程度分为全切除/近全切除和次全切除。
面神经功能评定:按House-Brackmann标准对两组病例进行术前及术后2周面神经功能评级。评定者为临床工作2年及以上的2名医师,遵照盲法原则进行,对于分级有异者则由第三名医师综合评定。将面神经功能Ⅰ~Ⅱ级定义为良好。

2 结果


表1 一般资料信息 例
2.2 DTI面神经重建准确性评估DTI组病例全部重建出面神经走行,经过术中镜下观察及电生理监测验证,发现其中27例与术中实际情况相符,有 3例不符,准确率为 90%(27/30),见表 2。该3例均为囊性大型听神经瘤,最大径分别为52.72 mm×39.61 mm、45.65 mm×36.46 mm、36.97 mm×30.65 mm,经术中电生理证实其中2例面神经位于肿瘤腹侧中央、1例位于肿瘤下极,镜下显示面神经菲薄、与肿瘤粘连紧密且难以清晰辨认。
两组病例均无面神经位于肿瘤上极及后方者,经Fisher精确检验,两组面神经与肿瘤的空间毗邻关系无统计学差异(P>0.05),见表2。

表2 两组面神经与肿瘤毗邻关系 例
2.3 DTI面神经重建对于听神经瘤手术的价值DTI组与对照组肿瘤全切/近全切除率分别为93.33%(28/30)和 84.38%(27/32),经 Fisher精确检验,两组无统计学差异(P>0.05);DTI组及对照组平均手术时长分别为(7.17±0.91)h 和(7.89±0.76)h,两组有统计学差异(t=3.402,P=0.001)。



表3 两组面神经功能在术前、术后2周及转归情况 例
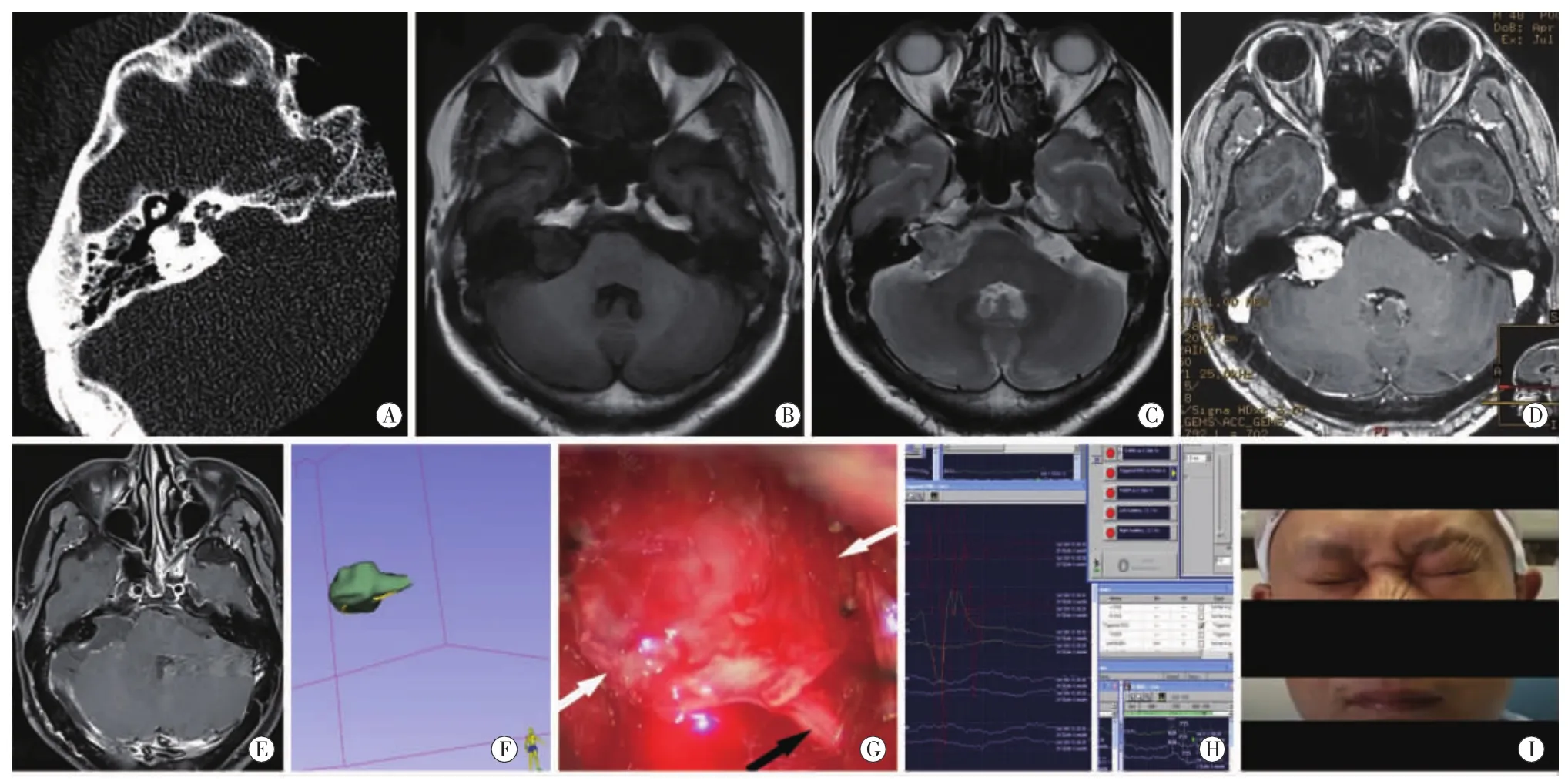
图1 1例 DTI组患者的影像、术中及术后情况 A:右侧岩骨 CT;B:T1WI;C:T2WI;D:T1增强;E:术后 T1增强;F:术前 DTI面神经重建和肿瘤的融合图像,绿色示肿瘤,黄色示面神经,显示面神经位于肿瘤前方;G:术中肿瘤全切后保留的面神经,位于肿瘤前方,与DTI重建结果一致,两白色箭头示面神经在内听道口扇形变薄明显,黑色箭头示面神经脑干端;H:肿瘤全切后电刺激面神经脑干段电活动明显;I:患者术后面神经功能同术前。
3 讨论
随着显微神经外科技术的发展,听神经瘤的治疗目标不但要安全度过围手术期,更要追求面神经功能保留,以提高术后生活质量。目前面神经的定位主要靠术中电生理监测,而电生理监测不可避免存在一定滞后性,故现今面神经解剖及功能的保护仍存在巨大挑战[5]。
DTI可在一定程度上克服颅底骨质和周围脑脊液信号的干扰[7],使术前实现无创面神经重建成为可能。TAOKA等[8]利用DTI技术在听神经瘤中行术前面神经重建的报道,激起了学界对此研究的浓厚兴趣。SATYARTHEE[4]、BORKAR 等[6]的报道进一步提示该技术在听神经瘤围手术期中的价值。但以上研究中DTI重建准确率高低不一,且尚缺乏统一的影像扫描及重建技术流程。我们在实际操作过程中体会到以下细节有助于提高重建质量:①适当增加DTI扫描的弥散方向有助于减少信息丢失;②对无禁忌患者,适当镇静有助于减少因头位摆动所致伪影;③多方位的薄层扫描有利于ROI的准确选取;④动态调节FA值及ROI等参数以确定个体化的最优重建参数。本研究DTI面神经重建的准确率达90%(27/30);重建结果与实际不符的病例均为囊性大型听神经瘤,这可能与其瘤壁完整性较差、面神经变薄明显且与肿瘤粘连更紧密有关[9];相信今后更高场强MR的引入可进一步提高重建准确率。
研究表明,听神经瘤术后面神经功能的恶化与术中对面神经的反复骚扰密切相关[2]。术中面神经的识别主要靠电生理监测,但由于术前无法得知肿瘤与神经的毗邻关系,术中需对肿瘤各界进行探测以识别面神经,确认无面神经电反应后再行肿瘤切除[3]。这不仅耗费了大量手术时间,还增加了面神经损伤的风险,研究显示反复电流刺激易使本已受损的面神经功能进一步下降[10]。本研究中,术前DTI面神经重建使术中面神经解剖及肿瘤切除过程更有的放矢,并大为减少术中电生理的探测次数,这是 DTI组缩短平均手术时长及改善术后面神经功能的主要原因。
通过前瞻性研究,我们发现术前DTI面神经重建对于听神经瘤手术具有重大价值,能够缩短手术时长并有助于面神经功能保护。但本研究还存在一定局限性,作为单中心研究,纳入的病例还非常有限,重建的技术也尚有进一步优化及提高的空间。后续我们将联合其他单位,进一步开展研究,以期最终将该技术在临床普及。

