即早基因c-fos在THP-1单核巨噬细胞亚型极化中的差异表达*
陈启文, 吴国栋, 颜治云, 张文成, 张 梅
(1. 天津中医药大学研究生院, 天津 301617; 2. 武警后勤学院, 天津 300309; 3. 天津市肝脏胰腺纤维化与分子诊疗实验室, 天津 300162; 4. 武警特色医学中心心内科, 天津 300162)
心血管疾病(cardiovascular diseases,CHD)作为危害人群健康的重要疾病之一,近年来呈现出发病率和死亡率逐年上升的趋势,并已经成为引起我国国民死亡的主要原因之一[1]。动脉粥样硬化(atherosclerosis,AS)作为CHD的核心病理基础之一,很长时间以来一直受到多方学者的关注与研究。现有研究仍无法完全阐明AS的发病机制,主流学说认为,AS病理起源于血管内皮细胞的损伤,继而出现大量脂质聚集并沉积于内皮下,形成血管内脂质斑块,随着病程的进展,脂质斑块进一步增大阻塞血管可诱发组织器官缺血性损伤,最终引起一系列包括心脑血管在内的临床疾病发生[2]。近年来,基于病理学基础的研究发现,巨噬细胞作为机体重要的免疫细胞,在AS的发生中具有关键的作用[3,4]。其兼有对炎性损伤及组织修复的双向调节能力,使得其一定程度上左右着AS的发生和发展。具体而言,经典活化型巨噬细胞(M1型)具有诱导炎性反应发生、引发炎性细胞聚集及促使泡沫细胞形成等作用;而选择性活化型巨噬细胞(M2型)则具有显著的抗炎作用,并可通过胞葬作用清除坏死细胞残体,从而发挥组织修复作用。在AS斑块中,M1型巨噬细胞增多可以显著增加临床中CHD的发病率和死亡率;而斑块内M2型巨噬细胞的增加则可一定程度的稳定和修复斑块,缓解甚至于逆转AS的发生和发展[3,5]。因此,如何有效调节巨噬细胞的亚型分化对于AS的斑块形成具有重要的临床研究价值。
原癌基因c-fos是即早基因(immediate early genes,IEGs)家族中的一员,其与另一IEGs成员c-jun共同组成了AP-1转录因子并参与机体细胞功能的多种信号调节中[6]。不仅如此,尚有研究证实,c-fos还具有独立的非基因组效应功能,能够参与如脂质代谢等相关的细胞功能活动中[7]。有研究发现,在单核细胞向巨噬细胞的分化过程中可通过上调c-fos与c-jun的表达[8],促进巨噬细胞相关功能基因的转录及翻译,从而调节单核细胞向巨噬细胞的分化过程,表明c-fos在单核细胞向巨噬细胞的分化中具有重要作用,但对其是否参与巨噬细胞的亚型极化作用仍鲜有报道。因此,本实验旨在探讨c-fos作为单核细胞向巨噬细胞分化的重要调节因子,是否在巨噬细胞亚型分化中发挥作用,为研究调节巨噬细胞的亚型分化,靶向干预巨噬细胞对AS斑块的稳定和修复,抑制斑块的破裂等提供新的理论支持。
1 材料与方法
1.1 实验材料
实验选用人单核细胞白血病细胞株(THP-1)作为研究对象。细胞购自美国典型培养物保藏中心 (American type culture collection, ATCC)。胎牛血清(fetal bovine serum,FBS)、RPMI1640培养基购自美国GIBCO公司;佛波脂(phorbol 12-myristate 13-acetate,PMA)、脂多糖(lipopolysaccharide,LPS)、白细胞介素4(interleukin 4,IL-4)购自德国Sigma公司;CD274抗体、CD86抗体、CD163抗体购自万类生物有限公司;GAPDH抗体和c-fos抗体购自武汉Proteintech公司;其他生化试剂均为进口分装或国产分析纯。
1.2 THP-1单核细胞培养
将冻存的THP-1细胞置于40℃恒温水浴锅快速解冻,而后将细胞悬液移置15 ml无菌离心管,并按1∶9比例与RPMI 1640培养基 (含10%胎牛血清,1%青链霉素混合液)混匀,水平离心机离心获得细胞沉淀,以4 ml含血清的培养基重悬后移入培养瓶中,于37℃、5% CO2孵箱内孵育24 h,并定期观察细胞状态及细胞密度,待镜下观察THP-1细胞铺满培养瓶瓶底时进行细胞换液传代、实验铺板及细胞保种等。
1.3 MTT法检测细胞活性
取对数期生长良好的THP-1细胞接种于96孔板,每孔加入含血清的细胞悬液100 μl,细胞数约2×104cells/well,空白孔用无血清培养基填充。将PMA按预设浓度剂量加入各孔,使得终浓度分别为25 ng/ml、50 ng/ml、100 ng/ml、200 ng/ml、400 ng/ml,同时设置零孔,并设3复孔。将细胞置于37℃、5% CO2孵箱内培养6 h,随后往各孔加入20 μl MTT溶液(5 mg/ml,即0.5%MTT),置于37℃、5% CO2孵箱继续培养4 h后,吸去孔内培养液。向各孔加入150 μl二甲基亚砜,置摇床上低速振荡0.5 min,使结晶物充分溶解。酶标仪OD 560 nm处测量各孔的吸光值。
1.4 实时定量PCR检测基因表达
运用Trizol法提取细胞总RNA,用紫外分光光度计检测260 nm~280 nm处OD值,以确定核酸的纯度及浓度。所提总RNA逆转录成cDNA,以cDNA为模版扩增c-fos、CD274、CD86、CD163,并以GAPDH作为内参照,采用相对定量法计算获得结果,引物序列见表1所示。相对表达量=2-ΔΔCT,ΔΔCt=(Ct目的基因(待测样品)-Ct内参照(待测样品))-(Ct目的基因(校正样品)-Ct内参照(校正样品))。各引物序列均由上海生工生物技术有限公司合成(表1)。
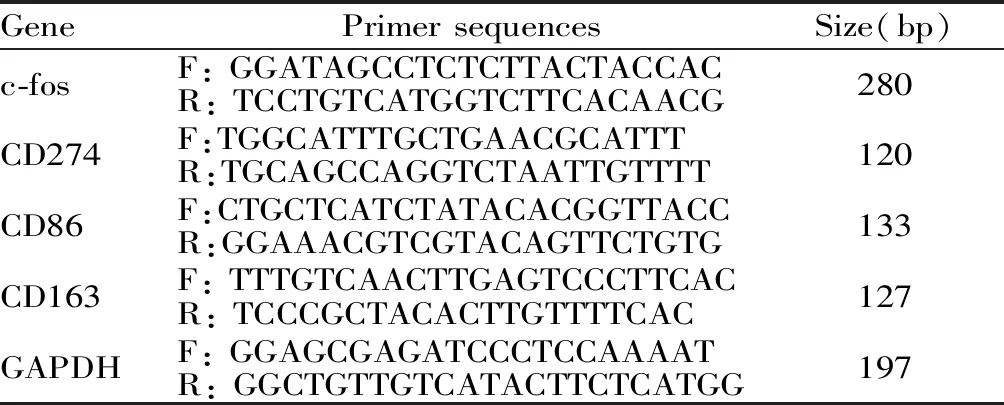
Tab. 1 Primer sequences formation
1.5 免疫蛋白印迹检测蛋白表达
收集PMA、LPS及IL-4刺激构建的模型细胞,提取各组总蛋白,采用BCA蛋白定量试剂盒进行蛋白定量。加入5×SDS上样缓冲液变性蛋白,加样,SDS-PAGE凝胶垂直电泳后,电转移至PVDF膜,5%脱脂奶粉室温封闭1 h,分别以anti-c-fos、anti-CD274、anti-CD86、anti-CD163和anti-GAPDH抗体进行抗原抗体结合,4℃孵育过夜,加辣根过氧化物酶标记的Ⅱ抗,室温孵育1 h,ECL化学发光显影。凝胶成像系统进行图像采集和分析,GAPDH蛋白条带作为内参照,以目的蛋白条带与GAPDH蛋白条带灰度的百分比值作为目的蛋白表达的相对水平。
1.6 统计学处理
2 结果
2.1 PMA对单核细胞向巨噬细胞分化的影响
相关文献报道,T淋巴细胞激活剂PMA可在体外诱导人单核细胞分化为早期巨噬细胞[8,9],因此,实验起始,首先探索了PMA诱导单核细胞分化的最佳溶度。采用MTT法检测不同药物浓度变化对单核细胞分化过程中细胞活性的影响。结果显示,25 ng/ml的PMA即可诱导悬浮的THP-1单核细胞分化为贴壁的巨噬细胞(图1)。随着药物浓度增加,药物毒性逐渐增强,当药物浓度超过100 ng/ml时,大量单核细胞死亡并悬浮于培养基中(表2),更换培养基后,镜下观察可见贴壁的巨噬细胞显著减少,表明PMA药物浓度能够影响实验细胞活性。因此,我们选取25 ng/ml作为PMA的最适诱导浓度。

Fig. 1 The optimal concentration of PMA-induced differentiation of THP-1 monocytes into macrophages. THP-1cells were incubated with different concentrations of PMA (0, 25, 50, 100 200, 400 ng/ml) for 6 h
Tab. 2 Effect of different concentrations of PMA on cell
2.2 PMA诱导 THP-1单核细胞分化过程中c-fos表达变化
为观察c-fos在模型中的变化,检测了PMA诱导THP-1单核细胞分化过程中,c-fos的表达。当PMA刺激在1 h时即可在mRNA水平观察到c-fos的表达上调,并在6 h达到峰值(表3)。而蛋白水平结果较mRNA稍滞后,在3 h时监测到c-fos表达显著上调,并在12 h达到峰值(图2)。该结果提示,c-fos在PMA诱导THP-1单核细胞向巨噬细胞分化的过程中表达上调,其可能在单核细胞向巨噬细胞分化中发挥作用。

Fig. 2 PMA-induced protein expression of c-fos. THP-1 cells were treated with PMA (25 ng/ml) for different time intervals (0, 1, 3, 6, 12, 24 h)
Tab. 3 PMA-induced mRNA and protein expression levels of c-fos at different times n=3)
2.3 LPS诱导巨噬细胞向M1型极化过程中c-fos的表达变化
为了进一步研究c-fos是否参与巨噬细胞极化过程,在PMA诱导THP-1单核细胞向巨噬细胞分化的基础上,探讨c-fos在巨噬细胞亚型分化中的表达变化。参阅相关文献资料,在PMA诱导的基础上,选取了1 μg/ml的LPS作为刺激浓度[10],诱导THP-1巨噬细胞向M1型巨噬细胞亚型分化,并运用实时定量PCR技术及Western blot技术检测M1型特异性标记物的表达以验证细胞的极化模型。其中,CD86被认为是M1型巨噬细胞的特异性标记物,而CD163及CD274则被认为在M2型巨噬细胞中表达[3]。结果显示,LPS刺激24 h能够显著上调M1型特异性标记物CD86蛋白的表达,并抑制了M2型特异性标记物CD163蛋白表达,而CD274在LPS刺激24 h时表现出蛋白表达的降低(图3A和表4)。该结果表明,LPS能够有效诱导了THP-1巨噬细胞向M1型极化。
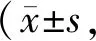
Tab. 4 LPS-induced protein expression levels of CD274, CD86 and CD163 in THP-1 cells n=3)
随后,检测了该极化过程中,c-fos的mRNA和蛋白的动态变化。结果显示,LPS刺激在早期即表现出对c-fos的抑制作用,其蛋白和mRNA水平均显著降低,而后随着刺激时间延长,c-fos的mRNA表达水平逐渐恢复(表5),而LPS对c-fos的蛋白表达抑制时间更长,超过了24 h(图3B)。该结果提示,LPS诱导THP-1巨噬细胞向M1型极化的过程中可抑制c-fos的表达。
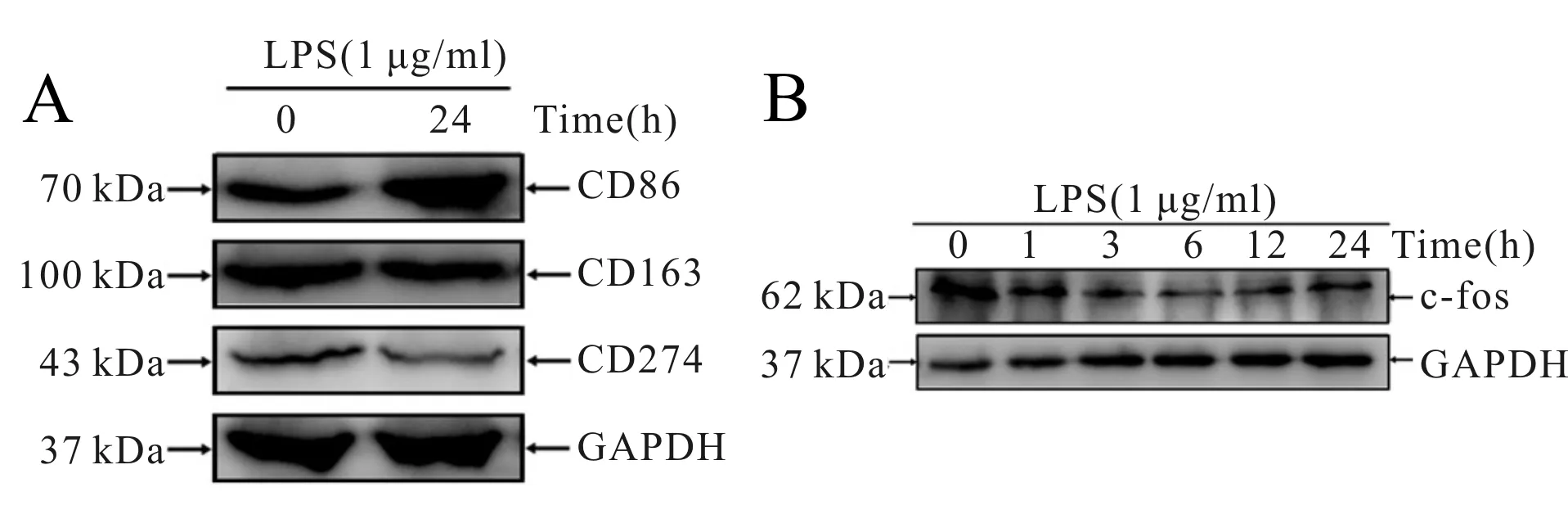
Fig. 3 LPS-induced protein expressions of c-fos, CD274, CD86 and CD163. THP-1 cells were treated with PMA (25 ng/ml) for 6 h and stimulated with LPS (1 μg/ml) for 24 h after changed medium
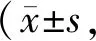
Tab. 5 LPS-induced protein and mRNA expression levels of c-fos in THP-1 cells at different times n=3)
2.4 IL-4诱导巨噬细胞向M2型极化过程中c-fos的表达变化
进一步,为了观察c-fos是否在M2型巨噬细胞的极化过程中发挥作用,我们在PMA刺激构建THP-1巨噬细胞的基础上,运用IL-4(10 ng/ml)[11]诱导THP-1细胞极化为M2型巨噬细胞,并分析了亚型特异性标记物的表达变化。结果显示,IL-4刺激THP-1巨噬细胞24 h后,M2型特异性标记物CD274的蛋白表达升高,CD163同样表现出蛋白水平上调的趋势,而M1型巨噬细胞特异性标记物CD86的蛋白表达降低明显,该结果表明IL-4刺激可诱导THP-1巨噬细胞向M2型极化(图4A,表6)。之后,动态观察c-fos在该过程的表达变化,我们发现,随着IL-4刺激时间延长,c-fos在THP-1巨噬细胞中表现出mRNA和蛋白表达显著上调,并在6h达到峰值(图4B,表7)。该结果提示IL-4在诱导THP-1巨噬细胞向M2型极化的过程中可上调c-fos的mRNA和蛋白表达。

Fig. 4 IL-4-induced protein expressions of c-fos, CD274, CD86 and CD163. THP-1 cells were treated with PMA (25 ng/ml) for 6 h and stimulated with IL-4 (10 ng/ml) for 24 h after changed medium
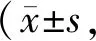
Tab. 6 IL-4-induced protein expression levels of CD274, CD86 and CD163 in THP-1 cells n=3)
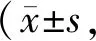
Tab. 7 IL-4-induced protein and mRNA expression levels of c-fos at different times n=3)
3 讨论
巨噬细胞表现出亚型和功能的多样性使得其在AS的病变过程中即充当推动者的作用,又能表现出保护和修复的作用,具有及其复杂的功能调节机制[12]。新进的多项研究聚焦于巨噬细胞的亚型极化及其功能的表达,并取得一定成果。如Ganta等人的研究发现,microRNA-93可通过调控干扰素调节因子-9及其下游通路的表达,促进M2型巨噬细胞极化,从而使缺血肌肉血运重建[13];Chen HH等人的实验则发现,干扰素调节因子2结合蛋白2(interferon regulatory factor 2-binding protein 2,IRF2BP2)可通过抑制巨噬细胞向M1型极化,减少巨噬细胞引发的炎症反应,并可降低AS的易感性[14]。表明调节亚型极化对于AS及其引起的CHD等相关疾病具有重要的临床价值。
c-fos作为AP-1调节因子重要的组成部分,是细胞功能调节的重要因子之一。其作为即早基因,在受到相关刺激调控后即可快速表达,并通过调节下游相关基因的转录和翻译,调控细胞的生长、发育和分化等功能[7,15,16]。既往研究已经证实,c-fos在机体单核细胞向巨噬细胞的分化的过程中与c-jun共同表达并参与细胞分化调节,但在巨噬细胞亚型分化中是否有作用鲜有报道。因此,本实验旨在观察c-fos在巨噬细胞亚型极化中的表达变化,探究c-fos是否在巨噬细胞亚型极化中也发挥作用。本文结果显示,c-fos在PMA诱导THP-1单核细胞向巨噬细胞分化的过程中表现出显著上调的趋势,说明c-fos在单核细胞向巨噬细胞分化的过程中即以发挥相关的调节作用,这与既往的研究结果相同。随后,本实验参考既往研究的方法,选取LPS(1 μg/ml)及IL-4(10 ng/ml)作为药物刺激,诱导THP-1巨噬细胞向M1型或M2型极化,并观察c-fos在该过程中的表达变化。结果显示,c-fos在LPS诱导巨噬细胞向M1型极化的过程中表达显著降低,其蛋白抑制时长甚至超过了24 h;而在IL-4刺激诱导巨噬细胞向M2型极化的过程中,c-fos表达显著升高。运用实时定量PCR及Western blot技术对细胞亚型标记物进行分析的结果显示,LPS诱导巨噬细胞极化表现出与M1亚型相关的CD86表达上调和M2亚型相关的CD163、CD274表达降低,表明LPS刺激有效诱导了THP-1巨噬细胞向M1亚型极化;反之,IL-4刺激后,细胞则表现CD163、CD274的上调和CD86的降低,表明IL-4刺激诱导了THP-1巨噬细胞向M2亚型极化的过程。综合上述结果,推测c-fos很可能在巨噬细胞的亚型极化中发挥着重要作用,其在M1型极化中表达降低,在M2型极化中的升高可能预示着c-fos具有调节并促进M2型形成,抑制巨噬细胞向M1型极化的作用。
综上所述,本实验结果表明c-fos在巨噬细胞亚型分化中的差异表达,并推测c-fos在不同亚型极化中可能具有相反的作用。这很有可能成为巨噬细胞的亚型及功能调节的一个新作用靶点,值得更进一步的深入研究。由于巨噬细胞亚型功能在AS中表现出的双向调节作用,因此巨噬细胞亚型极化在AS及其相关疾病的临床预防和治疗中具有较好的前景。

