金属纳米材料的植物生物效应及其多组学研究进展
陈 春 ,刘 爽 ,韦革宏 *
金属纳米材料(MNMs)是目前应用最为广泛的一类纳米材料,按其化学成分的不同可分为:金属、金属合金及金属化合物3大类[1],商品化MNMs多以金属单质与金属氧化物居多[2]。近年来,伴随着纳米技术在农业领域中的快速发展,肥料、农药、兽药以及饲料等纳米化农业投入品的使用也日益增多,这类投入品的直接使用将会引起MNMs在农业生境中的暴露加剧[3];人类日常使用的洗涤产品、化妆品及个人护理品等中的MNMs,首先会伴随生活污水的排放进入污水处理厂,然后通过污水灌溉或污泥农田施用等方式潜入土壤中;另外,大气中存在的MNMs也可通过团聚沉降或降水等方式迁移潜入土壤,最终土壤将成为大多数MNMs的最终归宿[4]。存在于土壤中的MNMs会对土壤生态系统产生何种效应,已经引起国内外学者的广泛关注,现有研究表明MNMs在植物体内的生物富集会沿陆地食物链逐级放大,从而可能对整个陆地生态系统产生潜在的环境风险[5]。组学技术的快速发展则为探究MNMs植物毒性效应提供了新的思路,结合传统植物毒理学手段,有望更加准确与深入阐释MNMs毒性的分子机制。
1 MNMs传统植物毒理学研究
关于MNMs植物效应方面的研究,传统毒理学方法主要采用叶面喷施、水培或土壤基质染毒的方式,观察MNMs暴露胁迫下植物生长、亚细胞以及生理生化水平层次上的生物效应。
1.1 植物生长水平
植物生长效应的评价指标一般包括发芽率、茎长、根长、叶片数和生物量等。早期国内外学者陆续开展了典型纳米颗粒(ZnO、Ag、CuO、CeO2等)对大豆、水稻、小麦、苜蓿、黄瓜等作物生长影响的研究[6-9]。在营养液、砂质或土壤等不同暴露基质中,某些纳米颗粒(NPs)暴露浓度超过某一阈值时,便会对植物生长造成一些负面效应,主要表现为种子萌发和根伸长受到抑制以及生物量的显著减少等。通常水培基质中NPs的效应浓度水平要远低于土壤,这是由于NPs进入土壤之后会发生溶解、团聚等化学变化。而土壤复杂的理化因素也会影响NPs的稳定性与生物可利用性[10-11]。其中,土壤pH值是影响土壤中可溶性金属离子类MNMs毒性效应的关键因子,研究发现酸性土壤中NPs对植物的毒性强度要高于碱性土壤,这是由于酸性条件MNMs金属离子的释放速率与移动性增强[12-13];此外,土壤离子强度或有机质含量也会影响NPs在土壤中的环境行为,离子强度的升高可引起NPs团聚速率的增加[14],有机质中腐植酸等物质可吸附于NPs颗粒表面,增加NPs表面静电斥力,从而减缓NPs的团聚效应[15-16],促使NPs在植物体内迁移,提高生物可利用性,最终加剧植物的毒性水平。研究发现粗砂暴露条件下,500 mg·kg-1CuO NPs和500 mg·kg-1CeO2NPs不会对胡萝卜生长产生胁迫,但是相同浓度ZnO NPs暴露则显著抑制了胡萝卜总生物量的积累,这表明同一种植物对于不同种类MNMs暴露的响应与耐受程度存在差异[17];同一种MNMs暴露对于不同种类植物生长方面的效应压力也有所不同,例如水培条件下1600 mg·L-1ZnONPs暴露可导致紫花苜蓿和番茄种子的萌发率受到显著抑制,而黄瓜种子的萌发率反而提高,表明在种子萌发阶段不同种类植物对于MNMs暴露胁迫的响应表现与耐受力存在差异[18]。
1.2 亚细胞水平
植物亚细胞结构主要包括细胞壁、细胞膜、细胞核和细胞器(线粒体、叶绿体、内质网等)。对于植物亚细胞结构的观察,不仅能帮助判别NPs是否进入植物体内,了解NPs的入胞方式以及掌握其在细胞内的转运等关键信息,还能确定MNMs作用的靶标器官并定位损伤组织,这也是探析NPs植物毒性机理的必要基础。目前研究发现植物细胞可通过吞噬或胞饮等内吞作用摄取NPs,并且证实了ZnO、Ag、CuO、TiO2、ZVI(纳米零价铁)等多种MNMs能够进入植物根细胞并在细胞内积累[19-22]。NPs的纳米尺寸效应与其独特的表面活性效应,赋予其更易穿过植物细胞屏障的能力。NPs首先附着于植物初生根表面,随植物的生长发育进入根尖、侧根原基及根毛区域中,并且通过细胞间隙或胞间连丝,伴随养分运输到木质部,进而纵向易位到茎叶;粒径稍大的NPs可能会堵塞细胞孔隙或诱导细胞表面形成更大孔隙,从而影响根部的水分及养分运输[23-25]。此外,NPs也可直接通过角质层或气孔被植物叶片吸收,凭借维管组织运输到植株其他部位[26-27]。进入叶肉细胞的NPs会导致叶绿体肿胀,类囊体损伤及质体小球增多变大,这些生物学现象皆反映出叶绿体可能是MNMs作用的靶位点之一,但具体作用机制有待于进一步研究[28-29]。植物生理生化变化与形态结构紧密相连,MNMs的暴露胁迫除了影响植物细胞形态结构发生变化外,还伴随着复杂的生理生化变化。
1.3 生理生化水平
大量研究证实MNMs暴露胁迫对植物的毒性机制之一是产生氧化胁迫。植物在抵御氧化胁迫时,一方面会通过产生如还原型谷胱甘肽(GSH)等小分子有机物来消耗体内的活性氧簇(ROS),另一方面会通过诱导体内一系列抗氧化酶的活性来清除ROS。ROS主要包括单线态氧(1O2)、超氧阴离子自由基(O-2·)、过氧化氢(H2O2)和羟基自由基(HO·)等,其通常产生于植物细胞叶绿体、线粒体及过氧化物酶体等亚细胞结构中[30]。植物抗氧化的第一道防线是通过超氧化物歧化酶(SOD)催化O-2·产生歧化产物H2O2,而后由过氧化氢酶(CAT)、过氧化物酶(POD)或抗坏血酸过氧化物酶(APX)等进一步清除H2O2。同时,抗坏血酸、谷胱甘肽、类胡萝卜素、生育酚及酚类化合物等小分子代谢物也参与植物ROS的清除[31]。低水平ROS可作为信号分子参与植物防御反应,传递信息至抗氧化防御系统,从而诱导抗氧化酶活性升高;然而,当ROS水平超出抗氧化防御系统的清除能力时,便会导致抗氧化酶蛋白组分发生氧化损伤,从而使抗氧化酶水平逐渐下降,进而破坏抗氧化酶系统。同时,植物体内积累的ROS会进一步与脂类、蛋白质、核酸等生物大分子直接反应导致机体氧化损伤。测定植物体内抗氧化酶酶活和脂质过氧化水平,通常可以表征植物抵御MNMs胁迫的能力以及机体氧化损伤的程度。多数研究皆发现MNMs暴露可诱导大豆、豌豆、水稻、拟南芥等植物细胞中ROS的产生,进而引起一系列的植物防御反应,主要表现为丙二醛(MDA)水平升高、抗氧化酶活性改变、叶绿素水平降低以及氧化应激损伤程度加剧等[32-35]。兰丽贞等[36]研究发现在水培条件下,随着TiO2NPs暴露浓度增加(0.05~1.5 mg·L-1)与暴露时间(0、7 d和14 d)延长,拟南芥叶片及根部中SOD水平呈逐渐下降的趋势,同时植物体内MDA含量呈递增趋势;Çekiç等[37]发现高剂量Ag NPs(80 mg·L-1)在水培暴露条件下可引起番茄体内SOD、APX活性显著降低,并引发DNA损伤和脂质过氧化作用,继而对番茄植物造成一定的毒害。
2 MNMs植物生物效应的多组学研究
2.1 转录组学(Transcriptomics)
转录组学是基于RNA水平研究细胞基因表达及调控规律的一门学科[38],目前检测技术主要分为两大类:(1)基于杂交的DNA微阵列(Microarray);(2)基于测序分析的大规模平行测序技术(MPSS)、表达序列标签技术(EST)、基因表达系列分析技术(SAGE)和RNA测序技术(RNA-Seq)等。其中,RNA-Seq由于其高通量、高分辨率、低背景且不依赖于基因组信息等优势,而被广泛应用于转录组学研究[39-40]。近年来,转录组学在植物逆境胁迫、抗病防御及发育调控等方面的应用越来越广泛。已经有不少学者通过转录组学技术,得到植物体在某些MNMs暴露胁迫下的植物差异转录图谱和代谢通路,并筛选出某些关键表达差异基因,相关部分研究列于表1。MNMs的暴露可诱导植物某些基因在转录水平的差异表达,这些差异基因主要与植物体内响应非生物胁迫(氧化胁迫、水分胁迫、盐胁迫和渗透胁迫等)和生物胁迫(伤口刺激和病原体入侵),重金属解毒及转运和DNA复制、转录及翻译调控相关。在水培基质中,ZnO NPs(4 mg·L-1与 100 mg·L-1)[41-42]、Ag NPs(5 mg·L-1)[43]、CuO NPs(10 mg·L-1)[44]暴露下的拟南芥,500 mg·L-1ZnO NPs[45]暴露下的玉米体内SOD、POD等抗氧化酶基因的表达皆会受到诱导而显著上调;1 mg·L-1Cu NPs暴露胁迫下,小麦体内参与苯丙烷代谢(合成酚类化合物清除ROS)与脯氨酸代谢(植物体一种有效抗氧化剂[46])相关的基因表达显著上调[47]。此外,暴露在含有1400 mg·kg-1ZnONPs、180 mg·kg-1Ag NPs和5000 mg·kg-1TiO2NPs的土壤中(老化6个月后),蒺藜苜蓿体内与抗氧化胁迫相关的基因也会表现出显著上调[48]。这些现象都表明MNMs暴露诱导了植物抗氧化防御系统的响应。质膜内在蛋白与水通道蛋白可介导植物水分与养分的跨膜和长距离运输,其相关基因的响应表达可能是由于MNMs纳米尺度的物理作用引起水通道堵塞,从而导致植物发生水分胁迫。同时,4 mg·L-1ZnONPs[41]、10 mg·L-1CuONPs[44]水培暴露可导致拟南芥体内与根发育相关的基因(包括细胞壁修饰、根形态发生和根毛发育等)下调表达,表明了MNMs会破坏根表细胞并抑制植物根的发育;而10 mg·L-1Al2O3NPs水培暴露则显著增加了拟南芥体内与根发育和伸长相关基因的转录表达[49],体现了植物对于不同种类MNMs胁迫在转录水平响应表达的特异性。重金属转运及解毒蛋白(锌转运蛋白、金属硫蛋白和重金属ATP酶等)在植物重金属吸收及解毒调控中发挥着关键作用,这类基因的显著上调表明MNMs释放的重金属离子可能是其产生毒性的一种主要机制[50-52]。研究还发现ZnONPs在水培暴露(4、100 mg·L-1)下可以引起拟南芥微管蛋白相关基因的下调表达,而拟南芥微管的重组与微管蛋白单体的加速降解存在一定的联系,这些微管蛋白又参与细胞分裂过程,可能预示MNMs会影响植物的细胞分裂,从而给植物生长带来负面的影响[41-42,53]。
转录组学虽然可以展现转录水平植物对MNMs暴露的响应,但其仅能反映基因表达的中间状态,而蛋白质作为基因的最终产物,在全面分析基因表达的过程中具有不可替代的作用。另外,由于存在转录及翻译后的调控与修饰,基因的转录和其产物蛋白的表达有时存在不一致性,并且利用转录组学研究无参考基因组的非模式植物时,一些测序转录本难以进行注释,因此需借助蛋白质组学进一步完善,以期更加全面地阐释植物对MNMs暴露的响应机制[54]。

表1 植物响应MNMs暴露的转录组学研究的主要发现Table 1 Transcriptomic response of plant exposed to metal nanomaterials(MNMs)
2.2 蛋白质组学(Proteomics)
蛋白质是生物体生命活动的主要承担者,是基因功能的执行者。蛋白质组学是通过鉴定生物体全套蛋白质的组成及表达水平,从细胞水平研究其变化规律、修饰情况以及相互作用的一门学科[55-56]。蛋白质组学分析的主要流程分为:蛋白质的分离纯化、鉴定以及生物信息学分析。蛋白质的分离技术主要包括电泳和色谱。鉴定技术一般分为质谱和同位素标记定量技术。生物信息学分析主要是指通过数据库对蛋白质结构和功能进行科学预测。目前,蛋白质氨基酸序列数据库有PIR(国际蛋白质序列数据库)、SWISS-PROT(瑞士,经过注释的蛋白质序列数据库)等,蛋白质结构数据库主要有PDB、SWISS-2DPAGE(瑞士,经过注释的二维聚丙烯酰胺凝胶电泳数据库)等[40,57-58]。近期采用蛋白质组学技术研究MNMs植物效应的相关结果归纳于表2。GSH在植物应对外界胁迫过程中起着关键作用,不仅能够清除细胞内的活性氧自由基,还能通过与细胞内的重金属离子螯合起到解毒作用。Ag NPs水培暴露下的水稻(30~60 mg·L-1)[59]与芸芥(10 mg·L-1)[60],其植物体内多种与 GSH合成相关的蛋白酶水平皆显著提升,表明植物通过增加GSH的合成来抵御MNMs引起的氧化胁迫;PYK10(β-葡萄糖苷酶23)是植物细胞为抵御外界环境胁迫而形成的一种新型内质网衍生结构,它是内质网体(ER Body)的主要组成成分,机械损伤或外源植物激素均可诱导ER Body的产生。10 mg·L-1Ag NPs水培暴露可导致芸芥根部PYK10水平升高,表明MNMs暴露可能对芸芥根部造成一定的机械损伤[60-63]。光合作用、三羧酸循环以及糖酵解等代谢途径是植物体内主要的产能途径,25 mg·kg-1Cu NPs和Fe NPs土壤暴露下的小麦体内参与糖酵解相关蛋白的上调表达[64]、10 mg·L-1Ag NPs水培暴露下的烟草[65]及小麦[66]体内参与糖酵解及ATP合成相关蛋白的上调表达,菜豆体内光系统相关蛋白在250、2000 mg·kg-1CeO2NPs土壤暴露下被显著激活[67],这些产能途径的激活可以帮助细胞产生更多的ATP与还原力(如NADPH),从而迅速为植物合成防御化合物提供能量。此外,还有一些与蛋白质折叠与易位相关的蛋白质(例如蛋白酶体、NAC转录因子和内质网腔结合蛋白等)的表达水平也发生了变化,表明MNMs胁迫会干扰蛋白质的转运及翻译后修饰[59-60,66-68]。然而,由于转录、转录后及翻译后调节机制、蛋白表达时间的滞后性以及测序背景噪音等原因,使转录组及蛋白组数据之间的相关性并不高。考虑到植物小分子代谢物是其上游基因与蛋白质功能性变化的最终体现,借助植物代谢组学可广泛筛选一些差异代谢物,从而能够更直接准确地了解植物体在逆境胁迫下的生理状态,并建立代谢组学与植物表型之间的内在联系[70-71]。
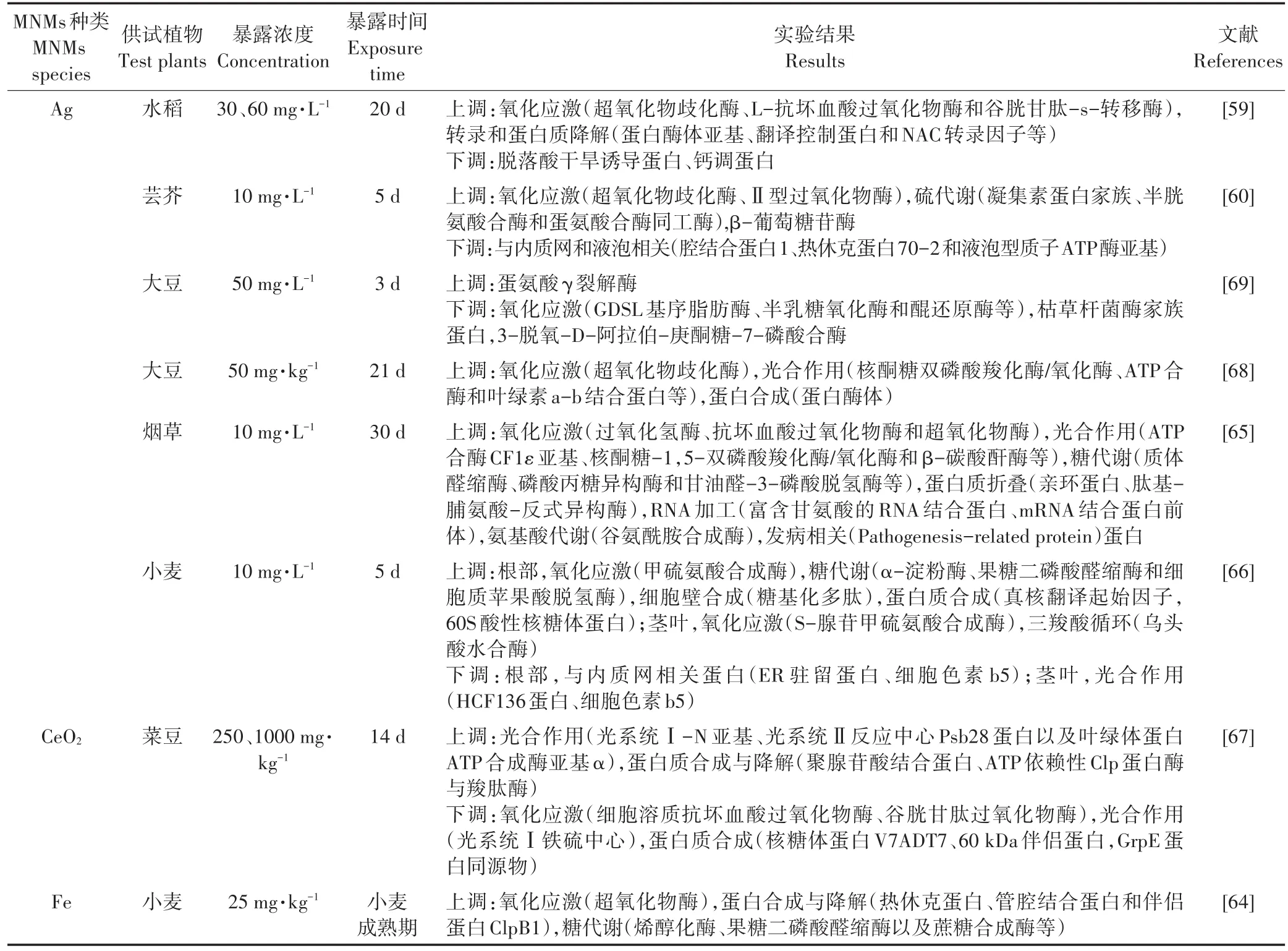
表2 植物响应MNMs暴露的蛋白质组学研究的主要发现Table 2 Proteomics response of plant exposed to metal nanomaterials(MNMs)
2.3 代谢组学(Metabolomics)
生物体的代谢物通常由多种性质不同的小分子化合物组成,是细胞调节过程的终端产物,能直观反映生物体对环境变化的响应[72-73]。代谢组学可灵敏地反映生物体在逆境胁迫下代谢水平的细微变化,通过明确代谢物对各种应激源的响应,建立与生物体表型之间的内在关联。代谢组学根据其研究目的主要分为靶向代谢组学和非靶向代谢组学:靶向代谢组学只对特定的已知代谢物进行定量分析,常用于对已知代谢途径进行深入探究;非靶向代谢组学可对生物体内源性代谢物进行系统分析,获取特定实验条件下的差异代谢物,在生物标志物与代谢通路的发现等方面应用较为广泛[74-75]。目前代谢组学普遍采用的研究手段包括两类:核磁共振和质谱-色谱联用技术。核磁共振技术具有无需样品前处理、无损性、无偏向性、实时动态等优点,但灵敏度相对较低;而质谱-色谱联用技术因其灵敏度高、分辨率好,且能同时检测多种组分等优点,逐渐被广泛应用于代谢组学领域,其中应用最为广泛的是气相色谱-质谱技术和液相色谱-质谱技术[71,76-77]。有关MNMs植物效应代谢组学近期研究的主要发现总结于表3。Ag NPs叶面喷施后(10、100 mg·L-1)的黄瓜[78]、Cu NPs土壤(200、400、800 mg·kg-1)[79-80]及水培暴露(10、20 mg·L-1)下的黄瓜[81]、CeO2NPs土壤暴露(250、2000 mg·kg-1)下的菜豆[67]以及TiO2NPs水培暴露(100、250、500 mg·L-1)下的水稻[82],这些植物体内酚类化合物的水平均显著升高。酚类化合物是植物体内一类具有抗氧化活性的次级代谢产物,它们的积累可能是植物抵御MNMs氧化胁迫的策略之一[78]。氨基酸是植物初级代谢的重要组成部分,也是植物体内氮代谢的主要形式,Ag NPs叶面喷施(10、100 mg·L-1)[78]、Cu NPs土壤暴露(200、400、800 mg·kg-1)[79-80,83]和水培暴露(10、20 mg·L-1)[81]都会诱导黄瓜体内氨基酸的组成发生变化,表明MNMs可能会干扰植物体的氮代谢过程。Ag NPs暴露后的拟南芥(12.5 mg·kg-1土壤暴露)[84]、黄瓜(10、100 mg·L-1叶面喷施)[78],Cu NPs水培暴露(10、20 mg·L-1)后的黄瓜[81]以及TiO2NPs水培暴露(100、250、500 mg·L-1)后的水稻[82]体内苹果酸、琥珀酸、异柠檬酸等三羧酸循环中间体发生积累,而三羧酸循环是植物体氧化产能的主要途径之一,植物体可能通过这种方式为植物抵御MNMs胁迫和修复受损大分子等提供足够的能量。此外,10、20 mg·L-1Cu NPs水培暴露与10、100 mg·L-1Ag NPs叶面喷施处理后,黄瓜体内壬酸(膜损伤的指标)和十五烷酸水平(磷脂双分子层的主要组分)分别受到显著上调,这些现象可能预示着细胞膜完整性遭到破坏[78-81]。
3 MNMs与植物相互作用机制
植物体在长期适应外界环境的过程中形成了多种防御与耐受机制,如改变自身形态结构、调节基因表达和改变代谢物水平等,从而保护植物细胞免受各类胁迫的影响。目前研究表明MNMs产生植物毒性的来源主要是颗粒的尺度效应、表面活性以及自身释放的游离金属离子[86]。这种来源途径的不同也造成了不同种类MNMs的毒性差异。对于金属离子溶解度大的MNMs如ZnONPs、Ag NPs等,其植物毒性主要与其释放出的金属离子所关联,而对于部分难溶性或溶解度低的MNMs如TiO2NPs、SiO2NPs,其与细胞的直接接触以及表面光敏特性等被认为是导致细胞毒性的主要因素[87]。

表3 植物响应MNMs暴露的代谢组学研究的主要发现Table 3 Metabolomics response of plant exposed to metal nanomaterials(MNMs)
由此推测MNMs与植物体相互作用的机制主要包括以下几个方面(图1):(1)MNMs颗粒物理过程引发的机械效应。进入土壤中的MNMs一部分会黏附于植物根表,并在转运过程中与细胞屏障发生摩擦、阻塞等一系列相互作用,从而引起细胞壁、细胞膜组分破损以及胞间连丝等细胞通道的堵塞[88]。进入细胞内部的MNMs还可能与纳米及微米尺寸的细胞结构发生相互作用,这也被看作是纳米颗粒产生毒性效应的一种方式[89],通常这种相互作用会干扰膜表面的电子传递,造成线粒体和叶绿体等细胞器结构损伤,直接影响植物能量及光合代谢,严重时甚至会造成细胞死亡[90]。(2)MNMs释放的金属离子的化学作用(氧化还原活性、催化活性等)。有研究发现,MNMs与其对应的金属离子在相同暴露条件下诱导的植物转录组基因表达谱十分相似,这表明MNMs释放的金属离子引发的生物效应是纳米材料毒性的主要来源之一[42-44]。组成MNMs核心金属的类型可以影响MNMs被植物摄取的方式、在细胞内作用的靶标等关键因素,从而对MNMs的最终毒性起到决定性作用[91]。例如Fe2+会与H2O2反应生成高反应活性的HO·,从而导致细胞内的有机大分子发生氧化损伤;Ag+会与蛋白质的巯基结合导致蛋白质变性失活;某些金属离子会竞争性替代植物体某些成分的核心金属原子,破坏植物细胞金属离子稳态,例如Ag+可以通过竞争性替代质体蓝素中的Cu2+来影响光合作用[92],ZnONPs释放的Zn2+可以替代叶绿素中心的Mg2+,导致光合核心的改变,进而导致植物毒性[93]。(3)氧化胁迫损伤。这是目前普遍接受的MNMs产生植物毒性的主要机制之一,大多数研究也发现MNMs暴露后植物体抗氧化酶酶活以及相关编码基因在转录表达水平的变化,这些皆已表明MNMs暴露可诱导植物体抗氧化防御系统的响应。化学合成的MNMs表面通常残留有还原基团,环境中氧原子或羟基的存在会使MNMs具有表面电荷,并且由于小尺寸而增大的比表面积增加了MNMs与细胞内各种物质反应的几率,这些因素都决定了MNMs具有极强的表面活性[94-95],在接触植物细胞后,高反应性的MNMs会诱导ROS产生,引发植物氧化胁迫。植物体内存在一套复杂的抗氧化防御系统,用于维持体内ROS的动态平衡,当氧化还原稳态失衡时,ROS会进一步造成蛋白质、DNA、生物膜及其他组分等发生氧化损伤,并干扰细胞信号转导[96-97]。此外,大量积累的ROS也会通过阻碍叶绿素合成及加速叶绿素降解两种途径最终导致植物叶绿素含量下降,从而对植物光合作用产生负面效应[98]。(4)影响植物基因复制、转录及蛋白质合成,干扰植物碳氮代谢。MNMs胁迫下植物体与DNA复制(组蛋白、核小体组装等)相关基因在转录水平的下调,蛋白水平上协助蛋白质折叠与易位(热休克蛋白、伴侣蛋白),调控转录及翻译(转录因子、翻译控制蛋白、翻译起始因子等)的蛋白水平的波动,这些都印证了MNMs对植物体转录及翻译过程的干扰。基于转录表达水平层次,1 mg·L-1Cu NPs水培暴露下的小麦[47]和500 mg·L-1ZnONPs水培暴露下的玉米[45]体内与氮代谢有关基因的上调,MNMs混合土壤暴露(1400 mg·kg-1ZnO NPs、180 mg·kg-1Ag NPs和5000 mg·kg-1TiO2NPs,老化6个月后)下蒺藜苜蓿根部与结瘤固氮和氮代谢相关的基因表达的下调[48],以及代谢水平层次上,Ag NPs(10、100 mg·L-1,叶面喷施)[78]、Cu NPs(10、20 mg·L-1,水培暴露[81];200、400、800 mg·kg-1,土壤暴露[83])均导致黄瓜体内氨基酸组成发生变化,这些都表明MNMs对于植物体氮代谢过程产生了影响。蛋白质组学与代谢组学研究还显示碳代谢(光系统、三羧酸循环和糖酵解)相关的蛋白与其代谢物水平也会受到MNMs暴露胁迫的显著干扰[64,82]。

图1 MNMs与植物的相互作用Figure 1 Schematic representation of MNMs and plants interactions
4 存在问题及前景
近年来,越来越多的学者将组学手段应用于MNMs植物毒理研究中,现有的研究结果已经发掘了部分植物响应MNMs的差异基因、差异蛋白以及差异代谢物等,并预测了部分相关代谢通路,为我们后续进一步研究MNMs植物毒性的分子机理提供了新的思路,就目前研究来看,仍有以下几个问题亟待解决:
(1)目前大部分研究仅局限使用单一组学技术,然而生物体代谢通路及调控错综复杂,且基因、蛋白与代谢物的表达具有时空差异,单一组学数据通常具有一定的片面性,因而仅依靠一种组学研究手段难以获取完整的生物学信息,未来开展MNMs植物毒性内在分子机制的探究,仍需要采用多种组学整合手段。此外,如何将庞大的多组学数据与植物表型数据进行科学的整合分析,建立植物基因、蛋白及内源代谢物与表型变化之间的联系也是未来研究的重点。
(2)当前大多数研究采用水培或砂土作为培养基质而非真实土壤,培养条件多是受控的实验室或温室而非真正的自然条件,且研究多集中于MNMs高浓度急性短期暴露实验,考虑到实际存在土壤中MNMs的现实浓度,并且由于MNMs进入土壤中会发生溶解、聚集、吸附等一系列化学反应,目前亟需开展更贴近实际环境中MNMs的低浓度长期土壤暴露实验,以获取更加科学有效的数据。
(3)MNMs的植物生物效应还取决于以下几个因素:MNMs本身特有的性质(MNMs种类、形状、粒径、表面结构以及稳定性与溶解性等理化特征),植物生理因素(如植物的不同种类、植株不同生长阶段和不同组织器官响应与耐受程度各异),实验设计因素(如MNMs的施用方式、暴露浓度、暴露基质和暴露时间等差异)。但目前绝大多数研究在实验所用MNMs的理化性质、暴露浓度、暴露基质、供试植物种类及生长阶段等方面难以达到统一,导致大量实验结果不具可比性,需要对MNMs的来源、制备方法、供试植物的选择以及暴露条件的设计等进行规范化,建立一套标准系统的MNMs植物毒理研究方法。
(4)植物-土壤-微生物是一个不可分割的有机整体,MNMs对于植物的影响并不是孤立的。土壤提供植物与微生物生活的物质基础,土壤微生物又促进土壤养分的循环与转化,并通过氮素固定、影响根发育以及抑制植物病原菌等一系列途径,直接或间接地影响植物的生长,而植物通过产生根系分泌物选择与调节根际微生物的数量种类和定殖能力。关注MNMs暴露下植物应激表现与土壤养分功能以及土壤微生物群落变化响应之间的内在耦联作用,对于准确表征真实环境中MNMs植物效应具有现实意义。

