海藻及其混伪品中17种氨基酸的含量测定
张晓萍 张文 戚鹏飞 朱仁愿 李洁 张彩霞 邱国玉

摘 要 目的:建立海藻及其混伪品中17种氨基酸的含量测定方法并进行聚类分析,为海藻药材的质量控制提供依据。方法:取18批样品(S1~S6为真品、S7~S18为混伪品),经酸水解后,采用氨基酸全自动分析仪测定氨基酸含量。色谱柱为LCAK06/Na型磺酸基强酸性阳离子交换树脂分离柱,流动相为缓冲液-再生液系统(梯度洗脱),流速为洗脱泵0.45 mL/min、衍生泵0.25 mL/min,检测波长为440 nm(脯氨酸)、570 nm(其余氨基酸),进样量为50 μL。采用PASW Statistics 18.0软件,以“平方Euclidean距离”为度量标准使用组间联接的聚类方法对 18批样品进行聚类分析。结果:17种氨基酸均分离良好,空白无干扰;其质量浓度与峰面积的线性关系良好(r均大于0.998),線性范围上下限分别为48.06 μg/L(胱氨酸)、1.501 μg/L(甘氨酸);精密度、重复性、稳定性试验RSD均小于2%;平均加样回收率为90.60%~101.56%(RSD为0.88%~2.15%,n=6)。海藻及其混伪品样品中均检出17种氨基酸,其中谷氨酸、天冬氨酸、亮氨酸、丙氨酸、甘氨酸、缬氨酸的含量相对较高。聚类分析结果显示,18批样品可以聚为4类,S1~S6为一类,S7~S9为一类,S10~S12 、S16~S18为一类,S13~S15为一类,与海藻真品与其混伪品的鉴定结果相一致。结论:该方法操作简便、快速、准确度高、重复性好,可用于海藻及其混伪品的氨基酸定量分析及真伪区分。
关键词 海藻;混伪品;阳离子交换色谱法;柱后衍生;氨基酸
ABSTRACT OBJECTIVE: To establish the method for content determination of 17 kinds of amino acids in Sargassum and its adulterants, and to carry out cluster analysis, so as to provide reference for quality control of Sargassum. METHODS: Totally of 18 batches of sample (S1-S6 as certified product, S7-S18 as adulterants) were collected. After acid hydrolysis, amino acids contents were detected by using automatic amino acid analyzer. The separation was performed on LCAK06/Na sulfonic acid cation exchange resin column with mobile phase consisted of buffer-regeneration system (gradient elution) at the flow rate of 0.45 mL/min (elution pump) and 0.25 mL/min (derivative pump). The detection wavelengths were set at 440 nm (proline) and 570 nm (other amino acids), and the sample size volume was 50 μL. PASW Statistics 18.0 software was used, and cluster analysis was conducted by using group connection method of cluster analysis with “square Euclidean distance” as the measurement standard. RESULTS: 17 kinds of amino acids were well separated without interference from blank sample. The linear relationship between mass concentration and peak area was good (all r were over 0.998), and the upper and lower limits of the linear range were 48.06 μg/L (cystine) and 1.501 μg/L (glycine), respectively; RSDs of precision, reproducibility and stability tests were lower than 2%. The average recoveries were between 90.60%-101.56%(RSDs were 0.88%-2.15%,n=6). 17 kinds of amino acids were detected in Sargassum and its adulterants, among which the contents of glutamic acid, aspartic acid, leucine, alanine, glycine and valine were relatively high. Results of cluster analysis showed that 18 batches of sample were clustered into 4 categories, i.e. S1-S6 into one category; S7-S9 into one category; S10-S12, S16-S18 into one category; S13-S15 into one category; which was consistent with the identification result of Sargassum and its adulterants. CONCLUSIONS: The method is simple, rapid, accurate and reproducible, and can be used for the quantitative analysis and identification of amino acids in Sargassum and adulterants.
KEYWORDS Sargassum; Adulterants; Cation exchange chromatography; Post-column derivatization; Amino acids
海藻为海产藻类植物的总称。中药海藻(以下简称“海藻”)始载于《神农本草经》,列为中品,具有软坚散结、消痰、利水之功效,多用于瘿瘤、瘰疬、睾丸肿痛、痰饮水肿等症[1]。2015年版《中国药典》(一部)收载的海藻为马尾藻科植物海蒿子[Sargassum pallidum(Turn.)C.Ag.]或羊栖菜[S. fusiforme(Harv.)Setch.]的干燥藻體,前者习称“大叶海藻”,后者习称“小叶海藻”[2]。但是目前市场上除药典收载的品种外,尚有铜藻[S. horneri(Turn.)C. Ag.]、亨氏马尾藻[S. henslowianum C. Ag.]、瓦氏马尾藻[S. vachellianum Grev.]和海黍子[S. kjellmanianum Yendo.]等其他藻类植物冒充海藻大量流通,不仅干扰了药材市场的正常运行,还会影响用药的安全有效性[3-6]。
海藻富含多种功效性成分,如多糖、无机元素、氨基酸、脂肪酸、蛋白质、维生素、甾体等[7-11],具有抗肿瘤、抗凝血、抗氧化、增强免疫等药理作用[12]。2015年版《中国药典》中海藻含量测定项下收载了以岩藻糖为对照品、用紫外分光光度法测定海藻中海藻多糖含量的方法[2]。研究表明,海藻中粗蛋白含量为8.00%[11]。考虑到氨基酸作为组成蛋白质的基本单位,且有文献研究表明,甘氨酸、精氨酸等与心血管系统健康密切相关[13-14],海藻中的氨基酸与其生物活性也具有一定相关性[15],因此拟将该类成分含量作为海藻药材的质量评价指标之一。此外,国内目前有关于海藻中海藻多糖提取及含量测定的研究[9],以及藻类产品中植物激素[16]、微量元素[17]、脂肪酸[18]、外源性有害物质重金属[19]、农药残留量[20]等的研究,但尚未见从中药材真伪鉴别角度对海藻及其混伪品中所含氨基酸类成分进行分析的研究报道。基于此,本试验采用阳离子交换色谱柱结合柱后衍生法,对海藻及混伪品中的17种氨基酸含量进行测定,并采用聚类分析方法对样品进行统计分类,以期为海藻药材的质量控制及深入研究提供参考。
1 材料
1.1 仪器
S-433D型氨基酸全自动分析仪(包括S5200型全自动进样器、S4300型氨基酸反应模块、S7130型溶剂存放单元、S2100型梯度泵等)、LCAK06/Na型磺酸基强酸性阳离子交换树脂分离柱(4.6 mm×150 mm,5 μm)均购自德国Sykam公司;ME204/02型万分之一天平、S220-K型酸度计[梅特勒-托利多仪器(上海)有限公司];DHG-9070A型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);N-WVAP112型氮吹仪(美国Organomation公司);Milli-Q IQ7000型超纯水系统[密理博(中国)有限公司]。
1.2 药品与试剂
氨基酸混合标准溶液(H型):含有天冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、谷氨酸(Glu)、丙氨酸(Ala)、甘氨酸(Gly)、胱氨酸(Cys)、缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)、苯丙氨酸(Phe)、组氨酸(His)、赖氨酸(Lys)、精氨酸(Arg)、脯氨酸(Pro)等17种氨基酸混合对照品(德国Sykam公司,批号:09070113,每种氨基酸浓度均为2.5 μmol/mL);甲醇为色谱纯,茚三酮、柠檬酸、柠檬酸三钠、硼酸、乙醇、浓盐酸、氢氧化钠及其他试剂均为优级纯,水为超纯水。
1.3 药材
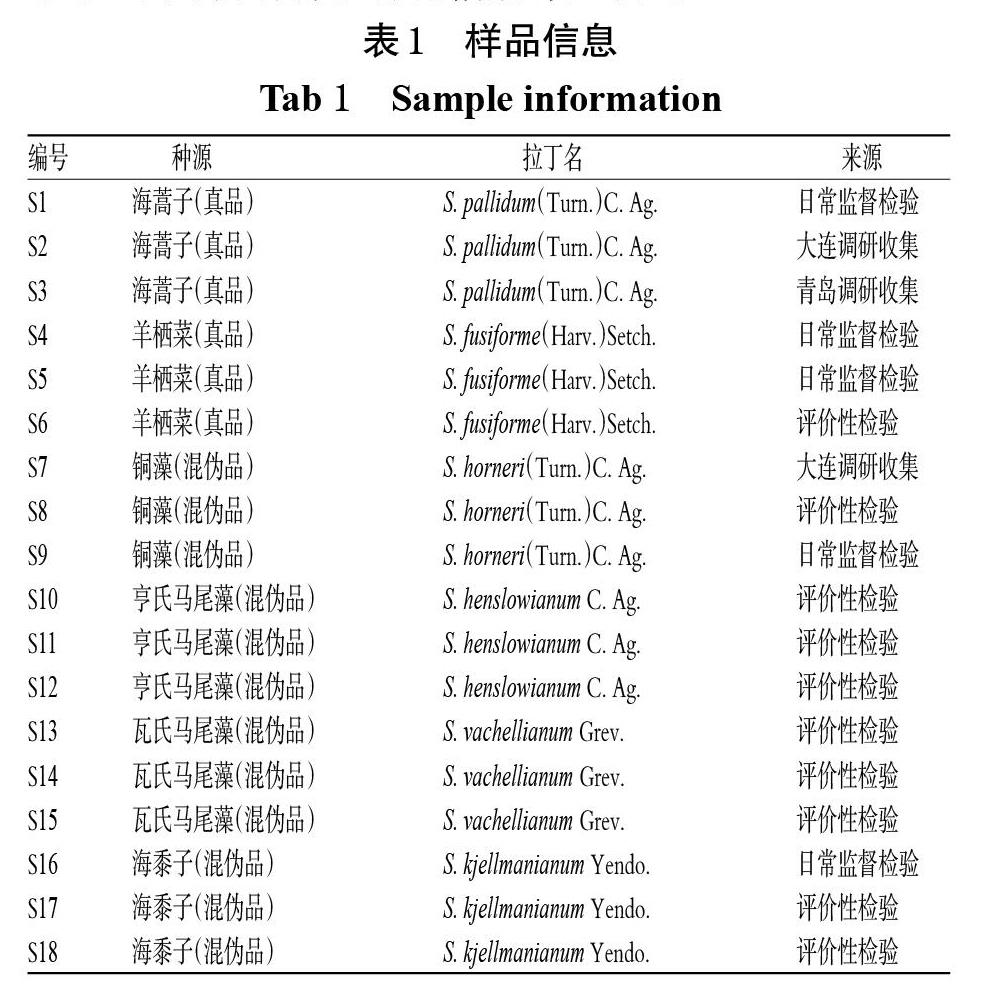
海藻及其混伪品样品来源于兰州市食品药品检验所日常监督检验、2017年甘肃省中药饮片专项抽验评价性检验以及项目组产地调研收集的样品,经兰州市食品药品检验所张彩霞副主任中药师鉴定,分别为马尾藻属植物海蒿子、羊栖菜、铜藻、亨氏马尾藻、瓦氏马尾藻、海黍子[21]的干燥藻体。样品信息详见表1。
2 方法与结果
2.1 溶液的制备
2.1.1 试液 (1)缓冲液A:分别称取柠檬酸三钠11.8 g、柠檬酸6 g,置于1 L量瓶中,加适量水溶解,再加甲醇65 mL和浓盐酸6 mL,加水定容,摇匀,用浓盐酸调节pH至3.45,经0.45 μm滤膜滤过,即得。(2)缓冲液B:分别称取柠檬酸三钠19.6 g、氢氧化钠3.1 g、硼酸5.0 g,置于1 L量瓶中,加适量水溶解并定容,摇匀,用浓盐酸调节pH至10.85,经0.45 μm滤膜滤过,即得。(3)再生液C:分别称取氢氧化钠20.0 g、乙二胺四乙酸0.2 g,置于1 L量瓶中,加适量水溶解并定容,摇匀,经0.45 μm滤膜滤过,即得。(4)样品稀释液:称取柠檬酸三钠11.8 g,置于1 L量瓶中,加入浓盐酸10.4 mL,用水溶解并稀释至1 L,摇匀,用浓盐酸调节pH 至2.20,经0.45 μm 滤膜滤过,即得。(5)钾钠缓冲液:量取水500 mL,加入醋酸钾196.0 g、三水乙酸钠272.0 g后,缓缓搅拌使溶解,再加入乙酸200 mL,用水定容至1 L,经0.45 μm 滤膜过滤,即得。(6)茚三酮溶液:量取甲醇600 mL,加入茚三酮20 g、苯酚2 g,不断搅拌至茚三酮完全溶解,经0.45 μm 有机滤膜滤过,然后向滤液中加入钾钠缓冲液400 mL,并转移至棕色试剂瓶中,从底部吹入氮气约3~5 min,即得。
2.1.2 混合对照品溶液 精密吸取氨基酸标准溶液0.4 mL至10 mL量瓶中,加样品稀释液稀释并定容,作为混合对照品溶液(单个氨基酸浓度均为100 μmol/L)。
2.1.3 供试品溶液 称取样品粉末(过三号筛)约0.5 g,精密称定,置于20 mL水解管中(切勿沾壁),精密加入6 mol/L盐酸10 mL,真空脱气,在充氮气状态下封口,置于110 ℃电热鼓风干燥箱中水解20 h;取出,摇匀,放冷至室温;打开水解管,精密移取1 mL水解液置于25 mL烧杯中,80 ℃水浴蒸干,残渣以15 mL样品稀释液溶解完全,经0.45 μm滤膜滤过,即得。
2.2 色谱条件
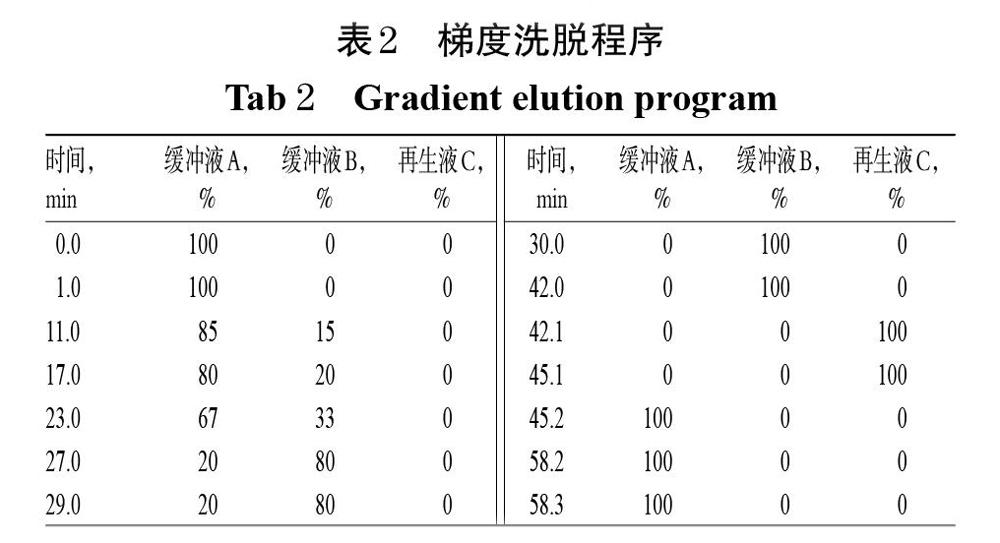
采用氨基酸全自动分析仪进行测定[22]。色谱柱为LCAK06/Na型磺酸基强酸性阳离子交换树脂分离柱;流动相分别为缓冲液A、缓冲液B、再生液C,梯度洗脱(程序见表2),流速为0.45 mL/min;衍生液为茚三酮溶液,流速为0.25 mL/min;检测波长为440 nm(Pro)和570 nm(其余16种氨基酸);进样量为50 μL。
2.3 方法学考察
2.3.1 系统适用性试验 分别精密吸取“2.1”项下混合对照品溶液、供试品溶液(编号:S7)适量,并以样品稀释液为空白,按“2.2”项下色谱条件进样测定。结果显示,混合对照品溶液和供试品溶液中17种氨基酸均分离良好,空白无干扰,色谱图见图1。
2.3.2 线性关系考察 精密吸取氨基酸标准溶液5份,分别加样品稀释液配制成单个氨基酸浓度均为20、40、80、120、200 μmol/L的系列对照溶液,按“2.2”项下色谱条件进样测定,记录峰面积。以峰面积(y)为纵坐标、氨基酸质量浓度(x,单位换算为μg/L)为横坐标,进行线性回归,得标准曲线方程,详见表3。结果表明,17种氨基酸在各自质量浓度范围内线性关系均良好(r>0.998)。
2.3.3 精密度试验 取“2.1.2”项下混合对照品溶液,按“2.2”项下色谱条件连续进样6次,记录峰面积。结果,17种氨基酸峰面积的RSD为0.08%~1.52%(n=6),表明仪器精密度良好。
2.3.4 重复性试验 精密称取同一样品(编号:S7)5份,每份0.5 g,按“2.1.3”项下方法制备供试品溶液,按“2.2”项下色谱条件进样测定,记录峰面积,以外标法计算含量。结果,17种氨基酸含量的RSD为0.50%~1.98%(n=5),表明本方法重复性良好。
2.3.5 稳定性试验 取“2.1.3”项下同一供试品溶液(编号:S7),分别于室温下放置0、2、4、6、8、10、12、16、20、24 h时按“2.2”项下色谱条件进样测定,记录峰面积。结果,17种氨基酸峰面积的RSD为0.80%~1.51%(n=10),表明供试品溶液在室温下放置24 h内稳定性良好。
2.3.6 加样回收率试验 精密称取已测得含量的样品(编号:S7)6份,每份0.5 g,精密加入“2.1.2”项下混合对照品溶液1 mL,按照“2.1.3”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并计算加样回收率,详见表4。结果表明,该方法准确度良好。
2.4 样品含量测定
取18批样品(S1~S18),按“2.1.3”项下方法制备供試品溶液,按“2.2”项下色谱条件进样测定,以外标法计算含量。各样品平行测定3次,取平均值,结果见表5。
表4 加样回收率试验结果(n=6)
Tab 4 Results of recovery tests (n=6)
[编号 氨基酸 加样回收率范围,% 平均加样回收率,% RSD,% 1 Asp 97.41~101.82 99.25 1.90 2 Thr 95.76~101.62 98.75 2.15 3 Ser 97.52~103.40 99.74 2.11 4 Glu 98.39~102.51 100.03 1.44 5 Gly 98.54~101.82 100.38 1.38 6 Ala 97.44~100.58 99.44 1.30 7 Cys 88.44~92.88 90.60 1.92 8 Val 93.41~99.18 95.81 2.08 9 Met 93.52~98.38 95.97 1.63 10 Ile 96.80~99.24 97.96 1.03 11 Leu 99.58~102.98 101.56 1.45 12 Tyr 93.52~96.23 95.11 1.07 13 Phe 95.81~98.18 97.11 0.88 14 His 92.92~96.43 95.09 1.66 15 Lys 92.48~98.05 96.36 2.14 16 Arg 96.71~99.20 97.93 1.06 17 Pro 96.24~98.90 97.63 0.93 ]
2.5 聚类分析
采用Excel 2007软件汇总含量测定原始数据。结果显示,海藻真品及其混伪品中均含有所测出17种氨基酸,且各氨基酸成分含量与总氨基酸含量的变化趋势保持一致,其中Glu、Asp、Leu、Ala、Gly、Val含量相对较高,且包括2种人体必需氨基酸。采用PASW Statistics 18.0软件,根据17种氨基酸含量使用组间联接的聚类方法对18批样品进行聚类分析,以“平方Euclidean距离”为度量标准,绘制海藻及其混伪品中氨基酸含量的树状图,见图2。
由图2可知,18批样品可聚为4类,S1~S6一类,S7~S9聚为一类,S10~S12、S16~S18聚为一类,S13~S15聚为一类,与种源鉴定结果相符,表明本方法可将海藻与其混伪品区别。
3 讨论
3.1 氨基酸分析检测方法的选择
由于大多数氨基酸本身不具有紫外吸收和荧光发射的特性,所以通常需要将其衍生化后再采用仪器测定,常用方法主要为高效液相色谱法[23]、气相色谱法[24]、分光光度法[25]、近红外法 [26]、高效阴离子交换色谱积分脉冲安培检测法[27]、氨基酸分析仪测定法等[22],各有优缺点。例如,气相色谱法是将氨基酸衍生为易气化的物质进行分析,虽然方法灵敏度高、分析时间短,但衍生试剂种类少、衍生操作复杂;近红外法虽然样品前处理简便,但检测灵敏度低、定量准确度差。氨基酸分析仪测定法作为液相色谱分析法中重要的一类,专为氨基酸分析而设计,它是一种柱后衍生法,先采用阳离子交换树脂分离氨基酸混合物,再以柱后茚三酮衍生法进行样品检测。该方法前处理过程简单、操作简便、检测稳定性和重复性好。为此,本试验采用氨基酸分析仪检测海藻及其混伪品中氨基酸含量。
3.2 取样量、水解时间及温度的考察
参考文献报道的藻类植物氨基酸含量[28-29],本课题组对样品取样量、水解及温度进行了考察:分别称取不同量(0.1、0.2、0.5、1.0 g)的样品,依法水解反应后制备供试品溶液,以各氨基酸成分的峰形及响应值为指标,选取最佳取样量;同时,考察不同水解时间和温度对氨基酸测定的影响。结果表明,当取样量为0.5 g时,各色谱峰峰形及响应良好;不同的水解温度和时间对水解程度有重要的影响,其中110 ℃加热20 h可以完全水解氨基酸,最终确定了“2.1.3”项下样品处理条件。
3.3 测定结果和聚类分析的意义
由图2可知,18批样品可分为4类,与样品的种质鉴定结果具有一致性:海藻真品海蒿子、羊栖菜为一类;其混伪品铜藻为一类,亨氏马尾藻、海黍子为一类,瓦氏马尾藻为一类。海藻为常用的中药材,市场流通混伪品较多。由于海藻为海生植物,不便于观察其生长特性,且随着生长期的延长其叶的性状特征变异较大(从初生叶的披针形叶到次生叶的丝状叶、多形叶在同一植株上同时存在),干燥的药材或饮片多皱缩、卷曲或破碎,这些都给海藻的鉴定带来了困难,使混伪品泛滥有了可乘之机,大量涌入市场。通过对海藻及其4种混伪品中氨基酸成分的含量测定,确定了海藻中含有的氨基酸种类及含量差异;同时,聚类分析结果证明,药典收载的药用来源的马尾藻属植物海蒿子、羊栖菜聚为一类,而铜藻、亨氏马尾藻、瓦氏马尾藻、海黍子的氨基酸含量与真品差异较大,都不能作为海藻代用品使用。
综上所述,本试验通过对中药海蒿子、羊栖菜及其马尾藻科混伪品铜藻、亨氏马尾藻、瓦氏马尾藻、海黍子中氨基酸成分进行定量测定和真伪区分,为全面反映其氨基酸组成及含量提供了数据支持,同时为海藻的全面深入研究提供了实验基础。
参考文献
[ 1 ] 楼之岑,秦波.常用中药材品种整理和质量研究:北方编:第1册[M].北京:北京大学医学出版社,2003:1-38.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:295.
[ 3 ] 崔征,李玉山,肇文荣,等.中药海藻商品药材的调查及原植物鉴定[J].中国药学杂志,1995,30(8):459-460.
[ 4 ] 董焱,李玉山,崔征,等.中药海藻及几种类同品的性状和组织构造鉴别[J].中药材,2002,25(4):239-242.
[ 5 ] 王虹熙,郭庆梅,周凤琴,等.海藻及其混伪品性状显微比较研究[J].中国海洋药物,2016,35(3):49-56.
[ 6 ] 刘辉.海藻及其常见伪劣药品的鉴别[J].内蒙古中医药,2014(29):109-109.
[ 7 ] 管华诗,王曙光.中华海洋本草:第2卷[M].上海:上海科学技术出版社,2009:241-247.
[ 8 ] 许福泉,冯媛媛,郭雷,等.大叶海藻化学成分研究[J].安徽农业科学,2013,41(15):6658-6659.
[ 9 ] 张倩茹,王强.中药海藻质量评价研究[J].中国野生植物资源,2007,26(2):60-62.
[10] 王威,李红岩,王艳艳,等.褐藻羊栖菜化学成分的研究[J].中草药,2008,39(5):657-661.
[11] 肖培根,李大鹏,杨世林.新编中藥志:第3卷[M].北京:化学工业出版社,2001:896-905.
[12] 张丽斌.羊栖菜中多酚的提取制备和体外抗氧化活性研究[D].厦门:集美大学,2013.
[13] 周琼,陆大祥,付咏梅,等.甘氨酸对小鼠心肌缺血性损伤的防治作用研究[J].中国病理生理杂志,2002,18(4):360-362.
[14] 韩静,赵有玺,刘雪翠,等.精氨酸在心血管疾病中的作用[J].氨基酸和生物资源,2003,25(4):66-68.
[15] MATSUBARA K,MATSUURA K,BACIC A,et al. Antico-agulant properties of a sulfated galactan preparation from a marine green alga,Codium cylindricum[J]. Int J Biol Macromol,2001,28(5):395-399.
[16] 李艳,徐继林,郑立洋,等.高效液相色谱-三重四极杆质谱法同时测定羊栖菜 5个部位中 10 种植物激素含量[J].色谱,2014,32(8):861-866.
[17] 陈耀祖,潘远江,莫卫民.东海药用海藻化学成分分析研究:Ⅰ:羊栖菜中微量元素分析[J].浙江大学学报(自然科学版),1996,30(4):471-473.
[18] 周佩佩,周书娟,孙琪,等.柱前衍生HPLC-MS法测定海藻中脂肪酸[J].分析试验室,2015,34(10):1134-1140.
[19] 陈帆,陈世理.海洋药用羊栖菜中总砷含量的分析[J].温州师范学院学报(自然科学版),2002,23(6):37-39.
[20] 孟娣,谭志军,刘永涛,等.水产品中农药残留限量标准的对比分析[J].中国农学通报,2015,31(14):56-63.
[21] 曾呈奎,陆保仁.中国海藻志:第3卷[M].北京:科学出版社,2000:52-54.
[22] 王棘,潘雪妍,杨宏伟.HPLC法和氨基酸分析仪(AAA)法测定肠外营养注射液(25)中18种氨基酸的含量的比较[J].药物分析杂志,2012,32(6):1085-1089.
[23] 郑重,孙琦,石永伟,等.高效液相色谱-串联质谱法直接定量分析植物酵素中多种氨基酸成分[J].色谱,2015,33(3):309-313.
[24] 张红漫,于文涛,欧阳平凯,等.气相色谱-质谱法测定中药沙苑子中的氨基酸[J].氨基酸和生物资源,2004,26(2):62-64.
[25] 胡月芳,黄志强,李金芳.毛细管电泳-电化学检测法测定淮山中8种必需氨基酸含量[J].分析测试学报,2016,35(4):471-475.
[26] 苗雨田,杨悠悠,王浩,等.全自动氨基酸分析仪法测定不同年份黄酒中游离氨基酸的含量[J].食品安全质量检测学报,2015,6(4):1154-1161.
[27] 吴伶俐,刘娜,徐鹏,等.离子色谱-积分脉冲安培检测法测定榴莲中的 17 种氨基酸[J].安徽农业科学,2009,37(8):3357-3359.
[28] 张尔贤,肖湘.几种南海海藻的氨基酸分析[J].氨基酸杂志,1989(3):37-39.
[29] 曹增梅,王伟伟,陈娟,等.几种大型野生海藻游离氨基酸组成分析[J].大连海洋大学学报,2018,33(4):467-471.
(收稿日期:2019-07-25 修回日期:2019-12-25)
(编辑:段思怡)

