长白山白桦山杨次生林细根形态特征和解剖结构对氮沉降的响应
洪梓明,邢亚娟,闫国永,张军辉,王庆贵
1 黑龙江大学农业资源与环境学院,黑龙江省寒地生态修复与资源利用重点实验室,哈尔滨 150080 2 黑龙江省林业科学研究所,哈尔滨 150081 3 中国科学院沈阳应用生态研究所,沈阳 110016
一般认为,细根是指直径≤2 mm的根系组分,而直径>2 mm则为粗根。作为树木养分吸收和水分运输的重要器官,细根不断地进行着呼吸作用与养分周转,因此其在陆地生态系统碳(C)、氮(N)循环中发挥着重要作用[1- 2]。有研究显示,在全球范围内,如果细根每年周转一次,约消耗陆地生态系统净初级生产力(NPP)的33%[3]。细根作为树木根系中最为活跃的部分,其养分和水分吸收直接影响着生态系统的能量流动和物质循环。在全球N沉降加剧背景下,外源N添加会对树木根系生长产生复杂影响。对于细根长度,先前研究发现外源N添加可能促进[4]或抑制[5]细根生长。其中,Eissenstat和Yanai的最优化理论[6]认为N添加能增加细根长度以扩大与土壤的接触面积,并能触及更深层土壤以便充分吸收养分和水分来促进细根生长。而抑制细根生长的原因有两方面:第一,当土壤N含量丰富时,就不需要消耗大量能量生产更长的细根去吸收养分[7];第二,N沉降降低了土壤pH值,使得土壤酸化[8],导致土壤中游离铝离子(Al3+)浓度增加,可能抑制细根根尖分生组织细胞分裂,进而影响细根长度。陈海波等[9]通过研究水曲柳(Fraxinusmandshurica)苗木根系解剖结构时发现,N添加处理可能会导致单位长度上细胞数量减少,从而使根长缩短。除了细根长度,外源N添加也能够促进细根直径增加,其原因有二。首先,土壤中Al3+增加会促进细根直径增粗[10];其次,由于土壤N含量增加,细根需要增加中柱直径来促进养分和水分的运输,与闫国永等[11]低N显著促进兴安落叶松(Larixgmelinii)前三级细根中柱直径生长的研究结论一致。同时,谷加存等[12]研究结果显示,无论是热带还是温带树种,细根直径受皮层厚度的影响较大,而受中柱直径的影响较小。由于形态结构中的细根长度、直径与解剖结构中的中柱直径、皮层厚度具有紧密联系,因此,本研究拟通过研究植物根系形态和解剖来确定N沉降对其地下过程的影响。
对于植物根系问题的研究一直处于不断探索当中。贾淑霞等[13]通过研究兴安落叶松与水曲柳细根时发现,形态结构与其生理功能紧密相连。形态特征是以往细根研究的主要内容,但其研究结果往往具有单一性。常文静和郭大立[14]对我国温带、亚热带和热带45个树种根系形态进行研究时发现,根序变化仅能解释其直径变异的53%;王向荣等[15]研究水曲柳前五级根时发现,根序仅能解释直径变异的83%。近年来,随着细根研究的进一步深入,如果只从形态特征来探究其根系的生理功能已经不能满足当前研究的需要。谷加存等[16]认为,细根直径的变异主要来源于皮层厚度和维管束直径的变化。陈海波等[8]研究水曲柳苗木根系时发现不同N浓度条件下根长度的变化可能与细胞数量的变化有关。植物形态变化决定其功能作用,而功能作用归根到底是其生理生化的外在表现。因此,对于细根相应组分化学计量学的进一步研究才能解释其外在形态与功能的相应变化。例如,McCormack等[17]研究发现,植物根系寿命与根系C∶N正相关。也有研究表明N∶P是植物生长养分限制的敏感性指标,可作为判断生态系统健康与否的有效工具[18]。如“生长速率假说”认为:生物体为满足快速生长阶段的需要,将会投入更多富含P的rRNA来支持蛋白质的合成,rRNA作为植物的一个主要P库,随着含量增加将直接导致细胞中P浓度的增加,从而使植物表现出低的C∶N、C∶P和N∶P[19]。因此,在目前全球气候变化的背景下,外源N的输入可能改变细根化学组分的含量进而影响细根形态特征和生理功能。上述研究只考虑了某两个或多个因子之间的耦合关系,并没有系统性地论述细根形态特征、解剖结构、生理功能以及元素含量变化与外源N添加的耦合关系。目前,随着细根研究的不断深入,已经从单一的形态研究发展到形态特征、解剖结构、生理功能和元素含量耦合的系统性研究[20- 21]。
森林生态系统具有丰富的物种多样性。有研究表明,每个树种在遗传、生活史、生境和物候以及生态功能方面均存在着明显的差别[22]。相比于室内试验,野外原位试验更贴近N沉降现状,能够囊括土壤N有效性、植物根系自身特性、环境因素、土壤动物等因子的综合作用。白桦与山杨都属于长白山地区天然次生林典型先锋树种,均十分耐寒冷、瘠薄,天然更新能力强。但白桦较适宜生长在潮湿、偏酸性的土壤中,山杨喜干旱、偏中性的土壤。本试验以长白山天然次生林白桦和山杨为研究对象,通过野外采集完整根系样品,测定其前三级细根形态、解剖与C、N、P参数,并分别探究两树种各参数之间的相互耦合关系,以完善温带天然次生林细根对N沉降响应机制的研究。在前人研究的基础上,我们提出以下假设:1)依据累积-稳定效应假说,长期施N可能抑制根系生长,增加细根直径;2)由于根系直径变异的控制因素不同,N添加下细根直径增加可能是由中柱直径增加引起;3)尽管白桦和山杨同为先锋树种,但由于白桦(喜微酸性土)和山杨(喜中性土)的生理差异,可能导致白桦细根随着氮浓度梯度升高,呈现先促进后抑制生长的现象;而山杨细根随着氮浓度梯度升高,呈现不断抑制生长的现象。
1 材料与方法
1.1 试验地点
试验地点位于吉林省白山市抚松县露水河林业局(42°82′49″ N,128°85′45″ E)。海拔920 m,属典型季风性气候,冬季寒冷干燥,春秋季短暂而干燥,夏季潮湿温暖。年平均气温和降水量分别为2.78 ℃和871.6 mm。2004年至2007年该地平均大气N沉降量为2.45 g N m-2a-1。其中湿N沉降约占75%。土壤为深棕色森林土壤,基岩为覆盖着砾石和黄土的花岗岩,上层主要为黄土。属于天然次生阔叶林,主要树种有白桦(B.platyphylla)、山杨(P.davidiana)、加杨(P.koreana),伴有散生的水曲柳(F.mandschurica)、红松(P.koraiensis)、色木槭(Acermono)、簇毛槭(A.barbinerve)、旱柳(Salixmatsudana)、枫桦(B.costata)、榆树(Ulmusjaponica),平均树龄约40年。主要灌木树种是珍珠梅(Sorbariasorbifolia)、东北山梅花(Philadelphusschrenkii)、五味子(Schisandrachinensis)、溲疏(Deutziascabra)、卫矛(Euonymusalatus)。
1.2 试验设计
控制试验共设置了9个30 m×30 m的样方,每个样方相距20 m,并在底部用聚乙烯塑料板隔断至土壤母质层(约60cm),以防止相邻样方不同N添加的相互影响。共设置3个N添加梯度,每个3次重复,即对照(CK)、低N(TL)、高N(TH),分别按0、2.5、5.0 g N m-2a-1进行外加N(NH4NO3)处理(不包括大气N沉降量)。根据 N添加水平,于2006年5月起,在植物生长季内(5—9月)每月月初将每个样方所施的NH4NO3首先溶解于20 L纯净水中,再混合于180 L水中,以背式喷雾器人工均匀喷洒在林地上。每个对照样地则喷洒同样200 L的纯净水,保持水分一致性。于2017年7月植物生长季在每个样方内随机选取白桦和山杨各3株,在距离树干1m处用平板利锹分别挖取白桦和山杨完整根段(包含前1—5级的根序)各27束,并依序放入写好标签的封口袋中,再置入冷藏箱(2—3℃)运回实验室。将根系清洗后,放入装满FAA固定液((FAA:70%酒精(90 mL)+100%冰醋酸(5 mL)+38%甲醛(5 mL))的塑料瓶中进行固定,于4 ℃冰箱中保存待用。
1.3 形态测定与解剖学观察
挑选完整的根段样品,按照Fitter和Stickland[23]的方式对根进行分级,依序放入已标记好根序标签且装有FAA固定液的玻璃瓶内,在最短的时间内用CanonLide 120扫描仪完成图像扫描。然后放入65度的烘箱内烘至恒重(48 h),测定各根序生物量(m干,g),密封于1号塑料袋内以便于化学含量测定。将扫描完成的图像采用WinRHIZO软件(加拿大Regent Instruments公司)进行形态特征分析,包括根长(L)、平均直径(D)、表面积(S)。
采用上述方式用70%酒精分出一、二和三级根各30个。依序装入标记好根序标签且盛有70%酒精的玻璃瓶内,然后进行石蜡横切片制作,每个处理等级根序制作7个样本。用番红-固绿染色(木质化细胞壁和细胞核染成红色,薄而具有纤维素的细胞壁和细胞质染成绿色),加拿大树胶封片。使用Leica DM4000B LED显微镜镜检,每个样本观察10个视野。并使用Leica Application Suite Version4.6.2软件拍照和测量皮层厚度(d皮,μm)、皮层细胞层数(n层)、中柱直径(d中,μm)和中柱内的导管数量(n导,个)与直径(d导,μm),计算维根比(中柱直径/根直径)。
1.4 C、N、P含量测定
分别将封于1号塑料袋内两树种各处理的前三级根序依次混合。用TOC/TN分析仪(Multi N/C 3100,Analytikjene AG,Germany)灼烧测得样品总有机碳(TOC)含量。用消煮法称取0.03 g根系样品制成溶液,用TOC/TN分析仪(Multi N/C 3100,Analytikjene AG,Germany)测得样品总N(TN)含量。使用钼锑抗比色法测定根系总P(TP)含量。
1.5 数据分析
采用单因素方差分析不同N添加对白桦和山杨细根形态、解剖和化学含量的影响,随后通过LSD法确定不同水平N添加1—3级根形态特征、解剖结构和根系化学成分之间的差异(P<0.05)。数据统计和作图采用SPSS 19.0(SPSS Inc,Chicago,USA)软件完成。
2 结果与分析
2.1 不同水平N添加对细根化学组分的影响
由表1可见,白桦、山杨TOC含量在不同N水平下均无显著差异。白桦TN含量在TL和TH均显著升高(P<0.05,表1),在TL下增加了约19.68%,在TH下增加了约18.80%。而山杨仅TL出现了显著降低(P<0.05,表1),降低约11.26%。TP含量在所有处理下都无显著差异。

表1 N添加对白桦、山杨1—3级根C、N、P含量及其比值的影响
物种间的差异均不做比较;不同字母代表在P<0.05水平上的差异显著
2.2 不同水平N添加对细根形态特征的影响
N添加显著增加了白桦前三级根平均直径(P<0.05),在TL时,一级根增加34.22%,二级根增加39.65%,三级根增加29.90%;在TH时,一级根增加13.36%,二级根增加35.10%,三级根增加14.58%。但TH相比于TL,细根直径的增加量呈现降低趋势,其中一、三级根显著降低(P<0.05),一级根降低15.54%,三级根降低11.79%。前三级根平均长度在N添加下并没有一致的变化趋势。平均表面积在不同N添加下均显著增加(P<0.05),在TL时,一级根增加33.09%,二级根增加55.56%,三级根增加110.96%;在TH时,一级根增加22.87%,二级根增加20.55%,三级根增加69.13%,而TH相比于TL均显著降低(P<0.05),一级根降低7.68%,二级根降低22.50%,三级根降低19.81%。由此可见,在外源施N添加下,白桦通过改变细根直径来影响其表面对营养物质的吸收过程以适应环境的变化(图1)。
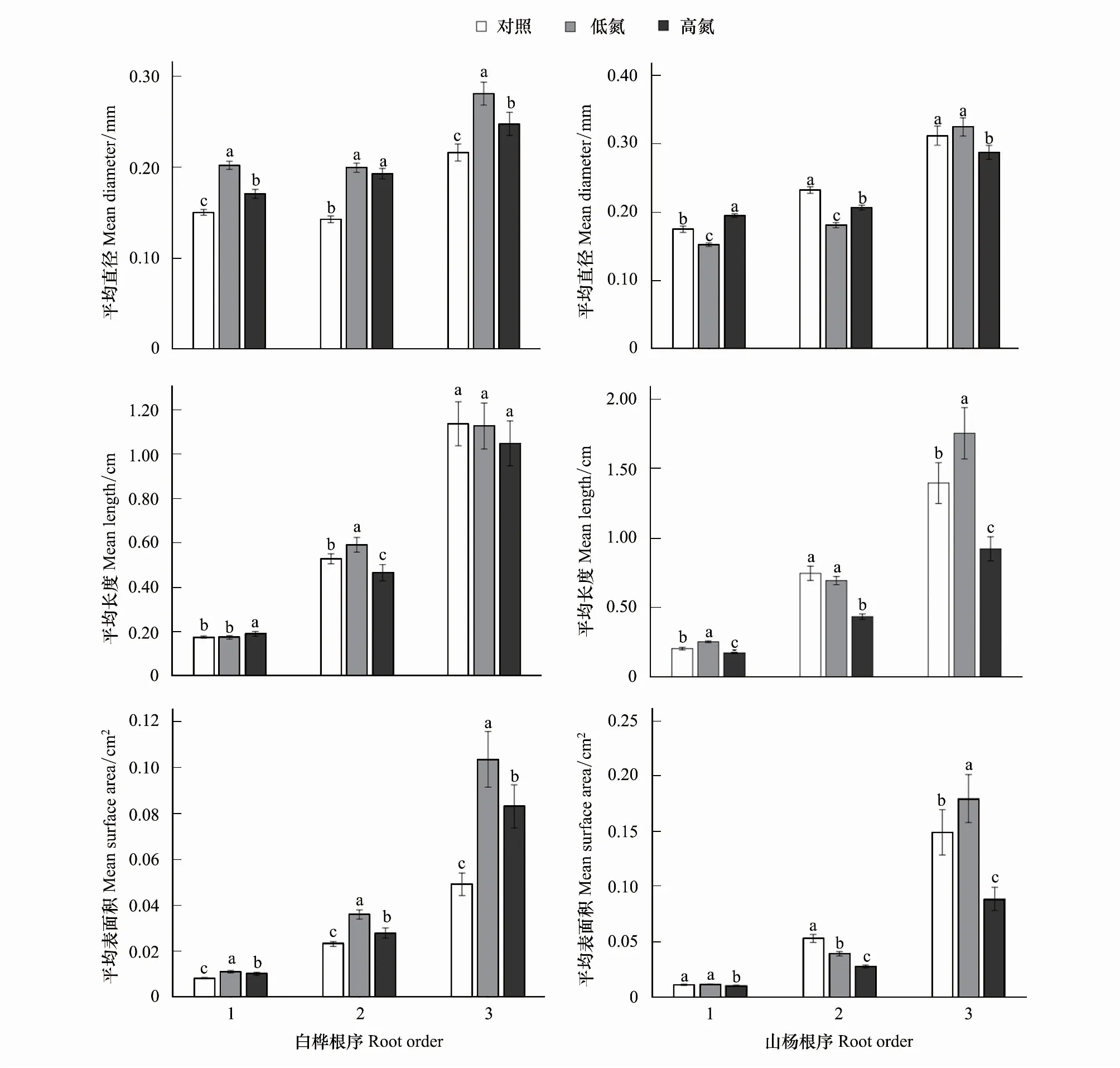
图1 不同N水平白桦、山杨1—3级细根平均直径、平均长度、平均表面积的变化Fig.1 Changes of average root diameter, average length and average surface area Betula platyphylla and Populus davidiana 1—3 fine roots in different nitrogen levels
山杨一、二级根平均直径在TL时显著降低(P<0.05),其中一级根降低12.96%,二级根降低22.18%,三级根无明显变化;而一、二级根TH相比于TL显著增加(P<0.05),三级根显著降低(P<0.05),其中一级根增加28.06%,二级根增加14.27%,三级根降低11.46%。一、三级根平均长度在TL时显著增加(P<0.05),其中一级根增加24.12%,三级根增加25.66%,二级根无显著变化;而前三级根平均长度在TH下相比于CK和TL均显著降低(P<0.05),相比于CK,一级根降低16.15%,二级根降低41.76%,三级根降低了33.91%;相比于TL,一级根降低32.44%,二级根降低37.36%,三级根降低47.41%。平均表面积TH相比于CK和TL均显著降低(P<0.05)。相比于CK,一级根降低7.88%,二级根降低47.75%,三级根降低40.39%;相比于TL,一级根降低11.57%,二级根降低29.35%,三级根降低50.51%,而在TL下,一级根无显著变化,二级根显著降低26.05%(P<0.05);三级根显著增加20.44%(P<0.05)。与白桦不同,山杨在外源N添加下其长度和直径均作出积极响应以适宜其生长环境的变化(图1)。
2.3 不同水平N添加对细根解剖结构的影响
白桦前三级根皮层细胞直径在N添加下均显著增加(P<0.05),在TL时,一级根增加72.77%,二级根增加53.22%,三级根增加39.96%;在TH下,一级根增加57.74%,二级根增加46.33%,三级根增加30.16%。白桦皮层厚度在TL时,一级根无显著变化,二、三级根均显著降低(P<0.05),二级根降低13.21%,三级根降低25.41%。白桦中柱直径在N添加时均显著增加(P<0.05),在TL时,一级根增加54.26%,二级根增加38.32%,三级根增加49.64%,在TH时,一级根增加27.10%,二级根增加14.96%,三级根增加18.78%。而TH相较于TL均显著降低(P<0.05),一级根降低17.61%,二级根降低16.89%,三级根降低20.62%。白桦维根比在N添加时均显著增加(P<0.05),在TL时,一级根增加23.02%,二级根增加20.39%,三级根增加16.70%;在TH时,一级根增加16.97%,二级根增加5.79%,三级根增加9.02%。此外,TH相比于TL均显著降低(P<0.05),一级根降低4.91%,二级根降低12.13%,三级根降低6.59%。由此前白桦细根直径的变化可知,其主要通过皮层厚度与中柱直径的协同作用来促使细根直径发生改变(图2)。
山杨前三级根皮层细胞直径在TL时仅一、二级根显著下降(P<0.05),一级根下降40.80%,二级根下降28.17%,三级根无显著变化;而TH时,二、三级根均显著增加(P<0.05),二级根增加17.37%,三级根增加103.45%;TH相比于TL均显著增加(P<0.05),一级根增加76.54%,二级根增加63.39%,三级根增加139.27%。山杨皮层厚度在TL时,仅一、二级根显著下降(P<0.05),一级根降低32.45%,二级根降低33.06%,三级根无显著变化;在TH时,一、三级根显著增加(P<0.05),一级根增加14.02%,三级根增加110.58%;TH相比于TL均显著增加(P<0.05),一级根增加68.78%,二级根增加50.81%,三级根增加88.53%。山杨中柱直径在TH时显著下降(P<0.05),相比于CK,二级根下降12.01%,三级根下降41.08%;相比于TL,一级根下降11.81%,三级根下降41.37%。山杨维根比在TL时,一、二级根显著增加(P<0.05),一级根增加46.02%,二级根增加14.67%,三级根无显著变化;TH相比于TL均显著降低(P<0.05),其中一级根降低30.58%,二级根降低13.31%,三级根降低31.99%。结合此前山杨细根直径的变化可知,山杨主要通过改变皮层细胞直径来促使其皮层厚度发生变化以适应外源N添加改变(图2)。
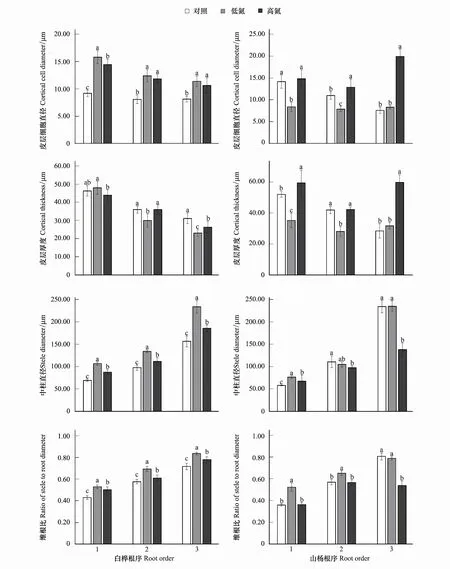
图2 不同N水平白桦、山杨1—3级细根皮层细胞直径、皮层厚度、中柱直径、维根比的变化Fig.2 Changes of cortical cell diameter, cortical thickness, stele diameter, ratio of stele to root diameter of fine roots of Betula platyphylla and Populus davidiana 1—3 fine roots in different nitrogen levels
白桦导管个数和导管平均直径在TL时均显著增加(P<0.05),导管个数增加130%,导管平均直径增加25.05%;TH相比于TL均显著降低(P<0.05),导管个数降低60.14%,导管平均直径降低17.85%。

图3 不同N水平白桦、山杨3级细根导管个数和导管平均直径的变化Fig.3 Changes of mean diameter of grade 3 fine roots in Betula platyphylla and Populus davidiana in different nitrogen levels
山杨导管个数和导管平均直径在TL时显著增加(P<0.05),其中导管个数增加47.92%,导管平均直径增加73.60%。在TH时,山杨导管个数相较于CK和TL均显著降低(P<0.05),相较于CK降低72.88%,相较于TL降低81.67%;而导管平均直径相较于CK无显著变化,但相较于TL显著降低32.27%(P<0.05)(图3)。
3 讨论
树木的形态结构与其生理功能具有紧密联系[24],而N沉降能显著影响植物细根的生存策略[25]。先前研究主要将根系分为粗根(直径>2 mm)和细根(直径≤2 mm)两部分[26],认为细根主要起水分和养分吸收的功能,而粗根起储藏、运输、支撑的作用,但目前有研究认为这种结论存在一定的不足。近期研究显示,假如采用直径大小对细根进行划分,将会在某种程度上忽视个体根在整个根序上的差别。由于不同根序上的个体根在解剖、形态和生理功能上都存在明显的差异性,因而采用直径阈值来对根系组分进行划分,缺乏对根系功能方面的充分考虑,这将会阻碍对细根结构和功能的准确理解[17,27- 29]。谷加存等[16]认为由于1—3级根都具有初生构造和完整的皮层组织结构,主要起水分和养分吸收的功能,因此被定义为吸收根,并建议采用功能划分的方法来充分判定树木细根系统内结构和功能的异质性,进而更加客观地评价根系所蕴含的生态学过程及其影响。通过以上观点,本研究分析了不同N添加对白桦和山杨1—3级细根的形态特征和解剖结构的影响,并探讨了与元素含量之间的耦合关系。
3.1 N沉降对细根C、N、P元素的影响
本研究表明外源N输入显著改变了细根N含量,但并没有明显改变C、P含量(表1)。进一步分析表明:白桦细根C∶N在TL和TH均显著降低,其原因在于外源N输入促进细根呼吸[30],使细根周转加快,细根N含量升高,导致细根C∶N减小。白桦和山杨C∶P随着N浓度增加均无显著变化,说明土壤P含量并没有随着外源N的输入而处于紧缺状态,符合前人的研究结论:在寒冷的气候下,由于生长季较短,物种生长速率较快,温带物种组织中的P含量比热带物种丰富[31]。此外,Koerselman和Meuleman[32]通过对湿地植被施肥试验的研究表明,N∶P<14可以认为是受N限制,N∶P>16是受P限制。本实验中N∶P均小于14,没有受到P元素限制。此外,白桦和山杨C∶P与N∶P随着N浓度升高成增加趋势,与“生长速率假说”认为植物应表现出低的C∶P和N∶P[19]不相符。但有学者研究发现,高等植物能够储存额外的养分从而改变生长速率和N∶P之间的关系[19,33- 35],本研究恰好验证了这一观点。
3.2 N添加下细根形态特征与解剖结构的耦合关系
目前有大量研究显示,在温带森林中,土壤N的可用性能够显著影响细根的形态特征[36- 38]。许多研究发现通过外源添加N显著改变了细根的长度[4- 5]和直径[10,14]。本实验中白桦细根在N添加下平均直径均显著增加(符合我们的假设1),山杨细根在N添加下平均直径和平均长度均发生显著变化(图1)。物种间变化趋势的不同可能反映了不同树种的营养需求不一致,也可能反映了树种间为适应变化的环境而采取不同的营养觅食策略[39- 40]。此外,细根的形态特征与其解剖结构有着十分紧密的联系。一般认为,皮层厚度的降低使得营养物质进入中柱运输部位的距离缩短[41],而导管平均直径和个数显著增加引起的中柱直径增粗[28]使得皮层吸收的营养物质能够更有效地进行运输,进而改变了细根的形态结构。本实验中白桦皮层厚度在N添加下呈现出下降的趋势(图2),中柱直径在施N处理下均显著增加(符合我们的假设2)。显然,白桦通过增加中柱直径和降低皮层厚度来提高维根比,从而满足外源N添加处理后的生长促进状态。与谷加存等[12]的研究结论:根径受皮层厚度的影响较大,而受中柱直径的影响较小不一致,其主要原因是谷加存等关注物种之间比较,并未关注施加外源N后其动态变化。另外,在木本植物中已经发现了根直径与中柱大小的正相关关系[11,42]。白桦在TH与TL比较时,中柱直径的变化与细根直径的变化相契合(显著降低),而二、三级根皮层厚度显著增加。由此,我们推测白桦在TH时处于“营养过剩”状态。山杨在施N处理下皮层厚度与中柱直径无一致变化趋势。白桦、山杨次生林细根在不同N添加下形态特征和解剖结构的适应性仍需进一步研究(图2)。
一般而言,在吸收根中皮层厚度的变化可以用来评估植物适应变化的环境[43],而皮层厚度的变异来源有皮层细胞直径和皮层层数两个方面。本实验中白桦皮层厚度在TL时显著降低(一级根除外),而皮层细胞直径显著增加。可见,TL通过减少皮层层数来促进白桦皮层厚度的降低使得营养和水分吸收效率增加,促进细根生长。而山杨在TH相较于TL时,皮层厚度与皮层细胞直径均显著增加,在TL时又具有相同的变化趋势(图2)。由此可见,山杨主要通过影响皮层细胞直径来改变皮层厚度。
3.3 N添加对细根功能的影响
有研究证实,吸收根可以通过改变根形态和解剖特征来优化其功能,以适应土壤条件诸如水分[7,44- 45]和重金属含量[46- 48]的变化。在根直径方面,先前很多研究[49- 51]认为:N供应不足,会对叶片CO2同化产生影响,导致分配到根系中的光合产物减少,从而增加细根衰老和死亡的概率,而直径增粗可以降低这种反应的危险系数。本研究中山杨一、二级根平均直径在TL时(N供应充足)显著降低,三级根有增加趋势,这充分验证了上述研究结论。在根长度方面,许多研究表明根长度是体现根吸收效率的重要指标[52- 53]。山杨在TL时平均长度显著增加以充分吸收养分,在TH时又显著降低从而减小养分吸收速率[6](图1)。可见,植物能够通过调节自身形态以适应外界的环境变化。
还有部分研究显示导管与细根运输能力显著相关。Senock和Leuschner[54]观察到树液流速和柳叶桉根部的最大液流速率分别与平均导管直径和总导管横截面积成正相关。在鳄梨根部也验证了液流速率与总导管横截面积的正相关性[55]。本实验中两树种三级细根在TL时导管个数和导管平均直径(导管横截面积)均显著增加(图3)。表明了导管的形成能够积极感受土壤环境中N含量的可用性。有实验证实,在N含量较高的情况下植物会增加他们的运输能力[43]去平衡植物吸收和运输之间的关系[56- 57],避免营养物质积累在根系系统中[58]。另一方面,本实验中白桦中柱直径(图2)符合其导管的变化趋势,显然,其中柱直径的增加主要来源于导管的直接作用。山杨在TH时中柱直径的变化符合其导管变化规律。在TL时中柱直径无显著变化,但导管平均直径和导管个数均显著增加。我们猜测TL使得山杨不再需要大量的韧皮部来积极运输有机物和矿质元素离子,反而需要更多的导管来支持植物体内不需要能量的水分运输的充分需要。然而,具体变化原因还需进一步探索。
此外,还发现一个有趣的现象。山杨皮层厚度在TH相较于TL时显著增加(图2),而导管个数和导管平均直径(导管横截面积)显著降低(图3)。同时,其平均表面积也相应地显著降低(图1),根据营养吸收-运输假设[43],推测,山杨在TH时明显感受到了环境的改变所产生的胁迫压力,因此,其改变了自身的营养吸收和转运策略来适应当前环境变化[39- 40,56- 57],以降低其破坏力。山杨皮层厚度的改变恰好验证了我们对其全N的实验结果:TL时为显著低值(表1)。这符合植物组织解剖研究结果[59]:皮层作为初生组织,主要由薄壁细胞构成。其特点是养分浓度高(大部分是以蛋白质形式存在的N),代谢速率快(主要是通过离子吸收、同化及转运到其他组织)(图3,图4)。
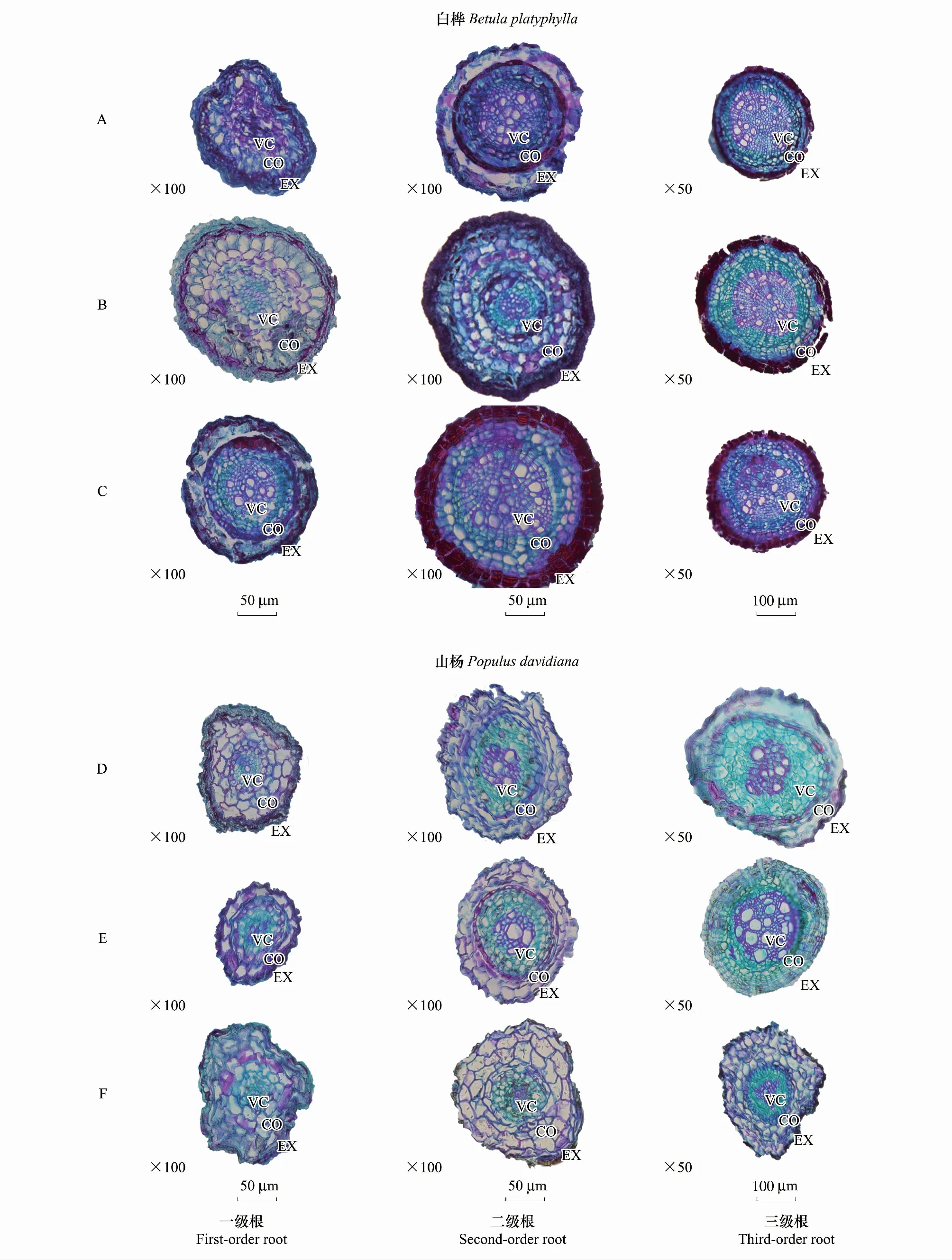
图4 不同N水平白桦(A-CK、B-LN、C-HN)、山杨(D-CK、E-LN、F-HN)1—3级细根解剖结构图片Fig.4 Anatomy and structure picture of Betula platyphylla (A-CK, B-LN, C-HN) and Populus davidiana (D-CK, E-LN, F-HN) 1—3 fine roots in different nitrogen levelsVC,中柱;CO,皮层;EX,外皮
白桦、山杨都属于先锋树种,均十分耐寒。白桦通常生长于湿润并呈酸性的土壤环境中,山杨偏爱排水良好且呈中性的土壤。由于人为添加N,改变了白桦和山杨细根的生存环境,使得其性状发生改变。鉴于白桦自身的喜酸性特征,其在TL时长度无明显变化而直径显著增加,可能原因是酸性土壤中Al3+浓度增加进而抑制细根根尖分生组织细胞分裂[8,10]。在TH时土壤酸性进一步增强,Al3+浓度过高,产生了铝毒效应,影响其生长,因此呈现出TH直径增加量明显小于TL且长度逐渐降低的现象。相反,由于山杨呈现出较为“中性”的特征,在TL时山杨直径生长受到抑制,而长度显著增加,土壤中Al3+浓度效果不显著,其原因可能是白桦作为“缓冲树种”,在TL时生长加快而吸收了大量人为添加的N,进而调节土壤pH值,使其酸性减弱。然而在TH时,白桦自身生长也受到抑制,从而导致“缓冲效应”消失,因此铝毒效应显著,致使山杨细根长度显著下降而皮层厚度显著增加(符合我们的假设3)。据此,随着目前全球气候变化背景下的N沉降进一步延续,长白山地区白桦山杨天然次生林会持续展现出其自身的适应机制,从而为完善植物根系的响应研究提供数据支持。
4 结论
本研究对长白山试验样地内白桦和山杨两树种前三级细根进行形态、解剖和化学组分测定后,得到结论如下:白桦和山杨的细根对N沉降的反馈机制不同,白桦主要通过细根中柱直径和皮层厚度来体现,而山杨通过细根长度和皮层厚度两方面来体现;TL时,两物种都是通过抑制前三级细根皮层厚度生长来加速水分与营养物质的吸收,不同之处在于白桦通过增加皮层细胞直径但减少皮层层数来达到皮层厚度的降低,而山杨主要是通过削弱皮层细胞直径的生长而促使皮层厚度的降低;TH时,山杨细根生长受到抑制,只能通过增加皮层厚度降低导管横截面积来抵御过高的N浓度对其自身生长的危害。因此,植物能够通过感知潜在的外界环境变化而改变其根系解剖结构,从而影响根系外在的形态特征进而优化其生理功能。

