加味芍药甘草汤调控β-catenin/EGFR对子宫腺肌细胞凋亡的影响❋
姜心禅,陈晓波,郭宇丹
(1.广东药科大学中医学院,广州 510000;2.广东药科大学附属第一医院,广州 510000;3.广州中医药大学,广州 510000)
近年来,子宫腺肌病(adenomyosis,AM)的发病率逐年增高,患者的平均年龄降低,育龄期女性比例显著增加[1],临床多以子宫弥漫性增大、不孕、痛经或不规则阴道出血等原因就诊[2]。目前除全子宫切除外,尚无根治的方法[3],这对育龄期女性的身心健康造成了严重影响。前期研究表明,加味芍药甘草汤通过调控P53/LIF/STAT3信号通路,能够抑制子宫腺肌细胞增生[4]。本研究则在此基础上进一步探讨加味芍药甘草汤治疗AM的作用机制。
1 材料与方法
1.1 材料来源
选择2018年7月至2018年12月在广州中医药大学第一附属医院接受全子宫切除术的子宫腺肌病患者3例(年龄42~54岁),术前3个月未服用激素。手术室无菌获取子宫腺肌症病灶组织约2 cm3,置于冰浴PBS缓冲液中,所取病例均在术后30 min内通过病理检查确诊。本次研究已获得我院伦理委员会批准,患者及家属签署知情同意书。
1.2 主要试剂
磷酸缓冲盐溶液(PBS)、高糖培养基(DMEM)、Ⅰ型胶原酶、2.5 g/L胰蛋白酶、胎牛血清(FBS)购自美国Gibco公司;米非司酮片购自北京紫竹药业有限公司;二甲基亚砜(DMSO)、中药饮片(芍药、甘草、当归、三七和延胡索)购自广州中医药大学中药房;免疫组化试剂盒和DAB显色试剂盒,购自博士德生物技术有限公司;鼠抗波形蛋白单克隆抗体、鼠抗人广谱角蛋白单克隆抗体、鼠抗人平滑肌肌动蛋白单克隆抗体,均购自北京中杉金桥生物技术有限公司;4%多聚甲醛溶液,购自LEAGENE公司;Annexin V-FITC细胞凋亡检测试剂盒,购自上海贝博生物有限公司;TS-8型转移脱色摇床,购自江苏省海门其林贝尔仪器制造有限公司;β-catenin兔单克隆抗体、p-EGFR(Tyr1068)兔单克隆抗体,购自CST公司;甘油醛-3-磷酸脱氢酶,购自GAPDH,SantaCruz公司;BCA法蛋白含量检测试剂盒,购自南京凯基生物发展有限公司;RIPA裂解液,购自杭州碧云天生物科技有限公司;JEM-1200EX透射电镜,购自日本JOEL公司;UCT超薄切片机,购自德国LEICA公司;转移电泳槽,购自上海天能科技有限公司;蛋白电泳仪和垂直电泳槽,购自美国Biorad公司。
1.3 实验药物的配制
中药高浓度组和中药低浓度组:加味芍药甘草汤(芍药15 g,甘草6 g,延胡索15 g,当归10 g,三七10 g)水提液用无血清的DMEM分别配制成高浓度40 mg/ml和低浓度20 mg/ml的含药培养液[4];西药组:用DMSO溶解25 mg米非司酮片,以无血清的DMEM配成 1×10-5mol/L 的贮备液;空白组:高糖DMEM培养基。
2 方法
2.1 子宫腺肌细胞的原代培养和传代
在无菌操作台上用眼科剪取标本中心部位,剪成1 mm3置于25 cm2培养瓶,加0.1 %I型胶原酶适量,置于37 ℃温箱消化5~6 h。终止反应时加10 %胎牛血清的DMEM培养基,过滤后1000 rpm离心8 min弃上清,重复3次;用10%胎牛血清的DMEM培养基制成5×105个细胞/ml的细胞悬液,5 ml/瓶,37 ℃、5% CO2温箱培养。
当细胞铺满培养瓶底部90 %左右时,需要进行细胞传代。吸出培养液并以PBS洗净,将加入1 ml的0.25 %胰蛋白酶培养瓶放入37 ℃、5 %CO2培养箱中3 min。在显微镜下观察细胞形态决定终止消化的时间。加入含10 %胎牛血清的DMEM培养液后吹打细胞,800 rpm离心6 min。弃上清后加入含10 %胎牛血清的DMEM培养液制成1×105个细胞/ml的细胞悬液,接种于新培养瓶中。
2.2 细胞的免疫组化鉴定
第一次传代细胞消化制成5×105个细胞/ml的细胞悬液,接种在12孔板中的爬片上,于37 ℃、5 %CO2培养箱中培养,24 h后加入含10 %胎牛血清的高糖DMEM培养液,继续培养3 d后,以PBS冲洗3次,4 %多聚甲酸固定30 min;0.5 %Triton X-100孵育20 min,PBS清洗3次;3 %H2O2去离子水室温孵育15 min,PBS清洗3次;滴加5 %BSA液以封闭,室温放置30 min,加入相应的一抗(平滑肌蛋白抗体、波形蛋白抗体、角蛋白抗体)后,4 ℃过夜;加生物素化二抗,于37 ℃中30 min,PBS清洗;滴加链霉素化亲和素试剂,置于37 ℃中30 min,PBS清洗;DAB显色:加入试剂后在镜下观察,控制显色程度;滴加蒸馏水终止染色,洗净后苏木素复染10 min,滴加蒸馏水使反应终止;取出爬片脱水、透明、封片、读片、拍片,用PBS代替一抗作为阴性对照。
2.3 透射电镜观察加味芍药甘草汤对细胞凋亡的影响
各组细胞经药物干预后制成细胞悬液,加入等体积2.5%戊二醛固定液,2000 r/min离心10 min弃上清。加入胎牛血清和戊二醛入离心管,2000 r/min离心10 min弃上清。以2.5%戊二醛固定30 min后,PBS缓冲液清洗3 min×3 次,加1 g/L四氧化锇固定30 min弃固定液,PBS缓冲液清洗3 min×3 次,乙醇梯度脱水后包埋,聚合72 h切片、染色,透射电镜下观察并拍片。
2.4 流式细胞术检测加味芍药甘草汤对细胞凋亡的影响
将细胞消化离心后种入6孔板里,放至5 %CO2、37 ℃培养箱中,至其融合度约90 %舍弃原培养液,加无血清的高糖DMEM培养液,放至5 %CO2,37 ℃培养箱中24 h,使细胞生长同步化。加入各组药物后再培养24 h取出,用预冷的PBS洗1次弃上清;加适量0.25%的胰蛋白酶3 min(镜下观察其形态变化),加2倍体积的含10 %胎牛血清DMEM培养液,终止反应;轻轻吹打贴壁细胞,1000 g离心5 min制成细胞悬液。加入5 μL Annexin V-FITC轻轻混匀后,于4 ℃避光条件下孵育15 min。加入10 μL 碘化丙啶后轻轻混匀,于4 ℃避光条件下孵育5 min,1 h内上机检测。
2.5 划痕实验检测加味芍药甘草汤对细胞迁移能力的影响
在6孔板中接种各组细胞,待融合度约为90 %时弃培养液,用PBS洗2次,加入无血清的DMEM饥饿处理24 h。弃培养液用10 μL枪头划痕,PBS洗2次后于倒置显微镜下摄片。等间距得在划痕边缘取6点测量宽度,取其平均值,记为0 h时划痕宽度;每空中加入相应药物作用24 h后,再以相同的观察点测量宽度。划痕愈合率(%)=(0 h宽度-24 h宽度)/0 h宽度×100%。
2.6 Western blot检测加味芍药甘草汤对细胞中β-catenin、EGFR和p-EGFR蛋白的表达
收集细胞用冷PBS清洗2遍后,加入含蛋白酶抑制剂的RIPA裂解,12000 g 4 ℃离心15 min,取上清液测定蛋白含量,-80 ℃保存。蛋白用沸水煮5 min,SDS-PAGE胶电泳分离蛋白,用电转移法使蛋白转移至PDVF膜上,5 %的脱脂牛奶封闭2 h后孵育对应的2种一抗,4 ℃摇床过夜。PBST清洗后孵育二抗,室温下轻摇2 h。ECL法发光,用Image QuantLAS4000(GE Healthcare)测定灰度值。
2.7 统计学方法
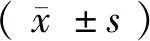
3 结果
3.1 原代培养细胞鉴定
经免疫细胞化学法(角蛋白、波形蛋白、平滑肌肌动蛋白)鉴定(如图 1),所培养的3例原代细胞均为子宫腺肌细胞。
注:A.角蛋白;B.波形蛋白;C.平滑肌肌动蛋白(图中箭头指出的棕褐色部分均为相应蛋白表达位置)图1 免疫细胞化学法鉴定子宫腺肌细胞比较
3.2 AM细胞超微结构的变化

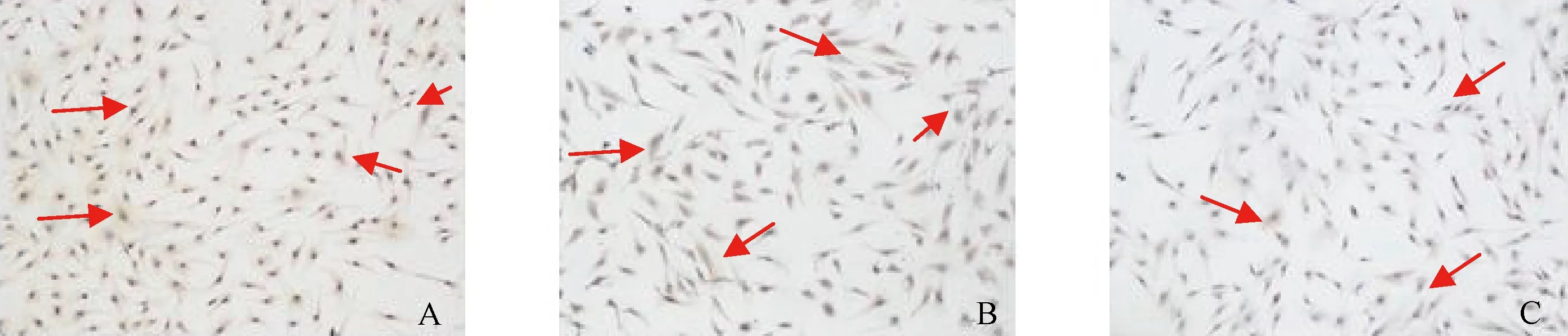
注:A.中药高浓度组(染色质块状边集并出现凋亡小体和大量空泡);B.中药低浓度组(染色质散落于核膜下,有空泡样改变);C.西药组(核仁稍缩小,染色质部分凝聚);D.空白组(细胞未见凋亡改变)图2 各组药物干预24 h后子宫腺肌细胞超微结构比较
图2示,各组药物作用24 h后,中药高浓度组细胞胞体变小,胞质浓缩,胞内核仁缩小,线粒体出现大量空泡,染色质呈块状凝聚并散落分布等改变,有明显的凋亡表现;中药低浓度组细胞核仁缩小,染色质边聚于核膜下,部分线粒体空泡样变;西药组细胞核仁稍有缩小,部分染色质凝聚,线粒体有空泡样变趋势;空白组细胞核中常染色质多,胞浆中可见正常的线粒体、内质网等细胞器,无细胞凋亡变化。
3.3 细胞凋亡率测定
中药高、低浓度组细胞的凋亡率明显高于空白组,差异有统计学意义(P<0.05)。中药高浓度组或中药低浓度组与西药组之间比较,差异无统计学意义。
3.4 AM细胞迁移能力的改变
各组药物作用24 h后,西药组、空白组细胞不同程度地向中间迁移,而中药高浓度组细胞间隙反而增大。迁移率如表2所示,高浓度和低浓度的加味芍药甘草汤均能抑制AM细胞的迁移,与空白组比较差异有统计学意义(P<0.05),与西药组比较差异有统计学意义(P<0.05)。

表1 加味芍药甘草汤对子宫腺肌细胞凋亡率影响比较

表2 加味芍药甘草汤对子宫腺肌细胞迁移率影响比较
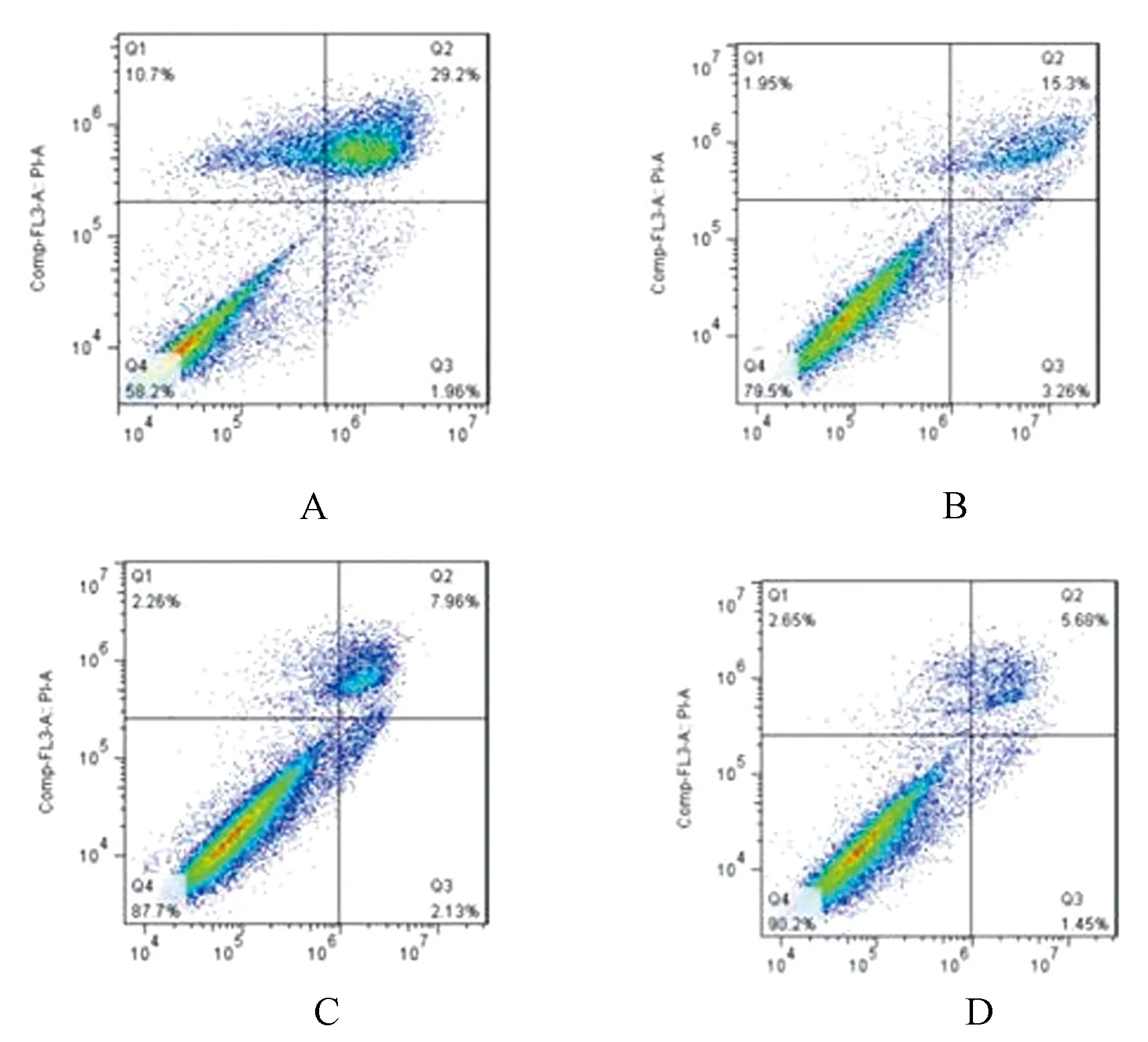
注:A.中药高浓度组;B.中药低浓度组;C.西药组;D.空白组图3 AM细胞凋亡流式图
3.5 AM细胞中β-catenin、EGFR和p-EGFR蛋白的表达量
图4示,中药高浓度组和中药低浓度组细胞中β-catenin、EGFR和p-EGFR蛋白的表达均低于西药组和空白组,与空白组比较差异有统计学意义(P<0.05)。

表3 加味芍药甘草汤对子宫腺肌细胞中β-catenin、EGFR和p-EGFR蛋白表达的影响

注:a.中药高浓度组;b.中药低浓度组;c.西药组;d.空白组图4 AM细胞中β-catenin、EGFR和p-EGFR蛋白表达
4 讨论
子宫腺肌病的发病机制尚不确定[6],唯一根治的方法只有全子宫切除术,然而术后患者将丧失生育能力,目前接受度很低[3]。中医药治疗本病可以保留患者的生育能力,同时能够缓解引导不规则出血、痛经等不适,有效地降低西药和手术治疗的副作用,具有不可替代的优势[5]。
子宫腺肌病属于中医学“癥瘕”范畴,多是由于瘀血蓄积于胞宫、阻滞气血冲任所致,故临床多表现为下腹部肿块、行经腹痛、经期延长和不孕等。针对瘀血阻滞、不通则痛的病机,临床当以活血化瘀为主,辅以行气止痛。加味芍药甘草汤正是以活血行气、化瘀止痛为法,由缓急止痛的经方芍药甘草汤化裁而来,并结合前期临床疗效观察、中药水煎剂HPLC指纹图谱分析、细胞实验和动物实验优化组方[7-9],筛选出白芍、炙甘草、当归、三七、延胡索5味药组成本方。研究显示,加味芍药甘草汤水提液能够下调芳香化酶,阻断病灶局部E2正反馈循环,并通过抑制c-Fos/c-Jun、P53/LIF/STAT3、RAS/MAPK/ERK等信号通路,降低子宫腺肌病病灶细胞的异常增殖,阻碍子宫腺肌病的发展[4,10-11]。
细胞凋亡是机体为维持内环境的平衡和稳定,由基因控制的细胞自主的有序死亡,然而肿瘤细胞的显著特性之一就是异常增殖。因此许多抗肿瘤药物都会从促进肿瘤细胞凋亡或抑制肿瘤细胞增殖的角度进行研究。本研究显示,经加味芍药甘草汤处理后,子宫腺肌细胞的超微结构出现核仁缩小、染色质边聚、凋亡小体形成等凋亡样改变,有效促进了子宫腺肌细胞凋亡,同时抑制细胞迁移。
细胞行为学的变化与蛋白的表达息息相关,通过前期文献研究发现,表皮生长因子受体EGFR(epidermal growth factor receptor,EGFR)是调控细胞增殖的关键因子,参与多条信号通路,诱导细胞的增殖、分化和侵袭等过程,在肿瘤形成过程中具有重要意义[6]。同时β-catenin与EGFR关系极为密切,在EGFR的作用下,β-catenin聚集于核内诱导细胞增殖;另一方面,β-catenin直接靶向EGFR并激活下游信号通路,两者之间存在相互作用[12]。此外,β-catenin在子宫腺肌病上皮细胞中表达升高,异常激活的β-catenin诱导子宫内膜上皮间质化,促进子宫腺肌病的发生[13],通过抑制Wnt/β-catenin 信号通路,有效控制子宫腺肌细胞增生[14]。同时考虑到EGFR只有磷酸化形成p-EGFR后才能真正发挥调控信号通路的作用,所以检测经中药处理后细胞内β-catenin、EGFR和p-EGFR蛋白的表达。研究结果显示,加味芍药甘草汤对于降低EGFR、p-EGFR和β-catenin的表达是有显著性差异的,提示在EGFR和p-EGFR表达降低后,抑制β-catenin在核内的表达,促进细胞凋亡;同时β-catenin表达水平降低后,减弱对EGFR的靶向激活作用,也加速细胞凋亡的发生。本研究进一步阐释了加味芍药甘草汤治疗子宫腺肌病的作用机制,为临床治疗本病提供了新思路与实验基础。

