秋葵微粉对小鼠肠道内环境的影响
辛松林 陈援援 邱秀艳 周慧超 吴玉姣
(四川旅游学院食品学院,四川 成都 610100)
黄秋葵,又名秋葵(Abelmoschusesculentus),一年生锦葵科(Malvaceae)草本植物,在我国多省份均有较大的种植面积[1]。刘雪蕊[2]研究表明,黄秋葵中可溶性总糖含量为30.88%,还原糖含量为1.97%,粗纤维含量为31.22%。肠道中的可溶性多糖可有效提高粪便持水力,利于排粪便量的增加;而不溶性多糖可以通过促进肠道蠕动,缩短粪便及有毒物质在肠胃道的停留时间。果胶、纤维素和半纤维素等非淀粉多糖在哺乳动物的大肠中均能被细菌发酵降解,促进短链脂肪酸(short chain fatty acids,SCFA)的产生,增加肠道益生菌,抑制肠道有害菌群的生长[3-5]。人类肠道内微生物的数量约是人类体细胞和生殖细胞的10倍[6],肠道菌群对人类健康具有重要作用。肠道微生物不仅参与宿主主要化学物质的代谢[7],还与肠道疾病密切相关[8]。目前,关于秋葵改善动物肠道的研究报道较少。张海文等[9]报道日粮中添加黄秋葵粉能有效促进儋州公鸡对饲粮营养物质的代谢率。吴佳静等[10]报道,以秋葵叶粉喂养海兰褐蛋鸡后能改善蛋鸡肠道微生物菌群和肠道组织结构。本试验采用热风干燥、微粉碎制备秋葵微粉,对小鼠进行连续6 周的秋葵微粉灌胃试验,观察和检测小鼠肠道内环境健康相关指标的变化,旨在综合评价秋葵微粉对小鼠的肠道改善能力,为其在食品添加剂、医疗、保健用品等方面的开发利用提供依据。
1 材料与方法
1.1 试验材料与试剂
SPF 级KM 小鼠,雄性,体质量18~22 g,购自成都达硕实验动物中心,动物证号:SCXK(川)2015-030;秋葵品种川秋葵1号,四川省植物工程研究院选育品种。
色谱级甲醇,美国Fisher公司;粪便基因组DNA 提取试剂盒,天根生化科技(北京)有限公司;乙酸、丙酸和丁酸(纯度大于99.0%),梯希爱上海化成工业发展有限公司;其他试剂为分析级,成都市科龙化工试剂厂。DNA 提取试剂盒,E.Z.N.A@Stool DNAkit,Omega Bio-Tek公司;MiSeg Reagent kit V3,美国illumina公司。
1.2 仪器与设备
PHS-25 酸度汁,上海雷磁仪电科学仪器股份有限公司;MiSeq 测序仪,美国illumina公司;1260 高效液相色谱仪,美国Agilent公司;XDW-2C 小型低温超微粉碎机,济南达微机械有限公司;Sartorius BP121s电子天平,北京赛多利斯科学仪器有限公司;HX-200型高速中药粉碎机,浙江省永康市溪岸五金药具厂;TDZ5-W5型离心机,湖南湘仪实验室仪器开发有限公司;XW-80A型涡旋混合器,上海青浦沪西仪器厂;YXQG02 手提式压力蒸汽灭菌器,山东新华医疗器械股份有限公司;FX101-3型电热鼓风干燥箱,上海树立仪器仪表有限公司。
1.3 试验方法
1.3.1 秋葵微粉准备 鲜秋葵→预处理→护色处理→热风干燥→粗粉碎→微粉碎→过筛→成品→干燥、避光、密封(24℃)保存,备用。
果荚长度:7.0 cm左右。预处理:选择无腐烂、无病虫害的新鲜秋葵,清洗、沥干、去蒂,横切成0.5 cm左右小段。护色处理:采用90℃水烫漂新鲜秋葵30 s。热风干燥条件:温度51.0℃、时间7.4 h。微粉粒度:150 目。密封室温(24℃)避光贮藏待用。
1.3.2 秋葵微粉基本成分测定 粗蛋白质含量测定参照GB/T 5009.5-2016[11];粗灰分含量测定参考GB/T 5009.4-2016[12];粗脂肪含量测定参照GB/T 5009.6 -2016[13];水分含量测定参照GB/T 5009.3-2016[14];可溶性总糖含量测定采用苯酚硫酸法,以葡萄糖计[15];多糖(以膳食纤维计)含量测定参考GB/T 5009.88-2014[16];果胶含量测定参考李加兴等[17]的方法。
1.3.3 动物喂养 将小鼠随机分为4 组,即对照组(等体积生理盐水)、秋葵微粉低剂量组(450 mg·kg-1d-1)、中剂量组(900 mg·kg-1·d-1)和高剂量组(1 800 mg·kg-1·d-1),每组10 只。灌胃6 周,1次·d-1,自由摄食和饮水,灌胃后观察小鼠的精神状态、活动、觅食量等情况。
1.3.4 样品采集 小鼠动物喂养试验结束前连续3 d每日上午10 点左右收集小鼠粪便。
小鼠末次灌胃后禁食12 h,采用脱颈椎法处死小鼠,分别取小鼠盲肠、结肠及其内容物,用0.9%生理盐水清洗盲肠和结肠,并称量记录。
1.3.5 指标测定
1.3.5.1 pH值测定 精密称取1.3.4 中的小鼠粪便0.5 g,溶解于10 mL 蒸馏水中,搅拌均匀,静置10 min,取上层清液,用酸度计测定pH值。准确称取盲肠和结肠内容物0.100 g,加入2 mL 蒸馏水混匀后静置10 min,取上清液测定其pH值。
1.3.5.2 SCFA 测定 参考杨光等[18]的方法。提取各组小鼠结肠及盲肠中粪便样品作为液相色谱仪测定样品。色谱条件:色谱柱:TR-FFAP(30 m×0.32 mm×0.25 μm)。测 定 采 用 程 序 升 温:初 温80℃,以10℃·min-1速度升至110℃,保持1 min,采用不分流方式,然后以5℃·min-1速度升至135℃,保持1 min,再以5℃·min-1的速度升至145℃,保持1 min,再以20℃·min-1速度升至230℃,保持1 min。火焰离子化检测仪(flame ionization detector,FID)温度为250℃,进样口温度为220℃;载气为氮气,流速为1 mL·min-1。进样量1 μL,自动进样。
1.3.5.3 DNA 提取和测序 采用DNA 提取试剂盒提取各组小鼠结肠及盲肠内容物中的微生物总DNA[19]。对样品进行PCR 扩增、产物纯化、文库制备与库检及MiSeq 上机测序。利用overlap 将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的有效数据。由于序列数量庞大,本试验对最终获得有效数据进行97%的相似度聚类,为了降低假阳性率,过滤singleton 序列,获得最终的OTU 丰度及代表序列,进行多样性分析、物种分类注释和差异分析等。
1.4 数据处理
试验数据用平均数±标准差表示,统计分析使用SPSS 19.0 软件,P<0.05表示存在显著差异。
2 结果与分析
2.1 秋葵微粉基本成分的测定
在最优工艺条件下制备的秋葵微粉的得率为18.47%。由表1可知,秋葵微粉含有丰富的多糖,包括果胶、可溶性多糖和不可溶性多糖等成分。研究指出食用富含多糖的食品可以有效预防肠道疾病,促进肠道恢复和提高机体免疫力[20]。
2.2 秋葵微粉对小鼠体重的影响
由表2可知,秋葵微粉灌胃小鼠1 周后,各剂量组小鼠体重与对照组差异不显著;2~6 周,秋葵微粉各剂量组的小鼠体重与对照组均呈极显著差异(P<0.01)。第6 周,对照组小鼠体重增加了49.05%,而秋葵微粉高、中、低剂量组小鼠增重不明显,分别增加了1.21%、0.33%、0.87%。这可能是因为秋葵富含的多糖[21-22]、果胶[23]等成分能够让小鼠具有饱腹感,同时秋葵热量较低,因此剂量组小鼠体重增长缓慢。此外,秋葵微粉本身具有一种特殊的气味,可能会影响小鼠的摄食;试验过程中发现,各剂量组小鼠的摄食量少于对照组。预测秋葵微粉可作为减肥代餐,但需要做进一步研究证实。

表1 秋葵微粉的基本组分(n=3)Table1 Base constituent of okra powder(n=3)
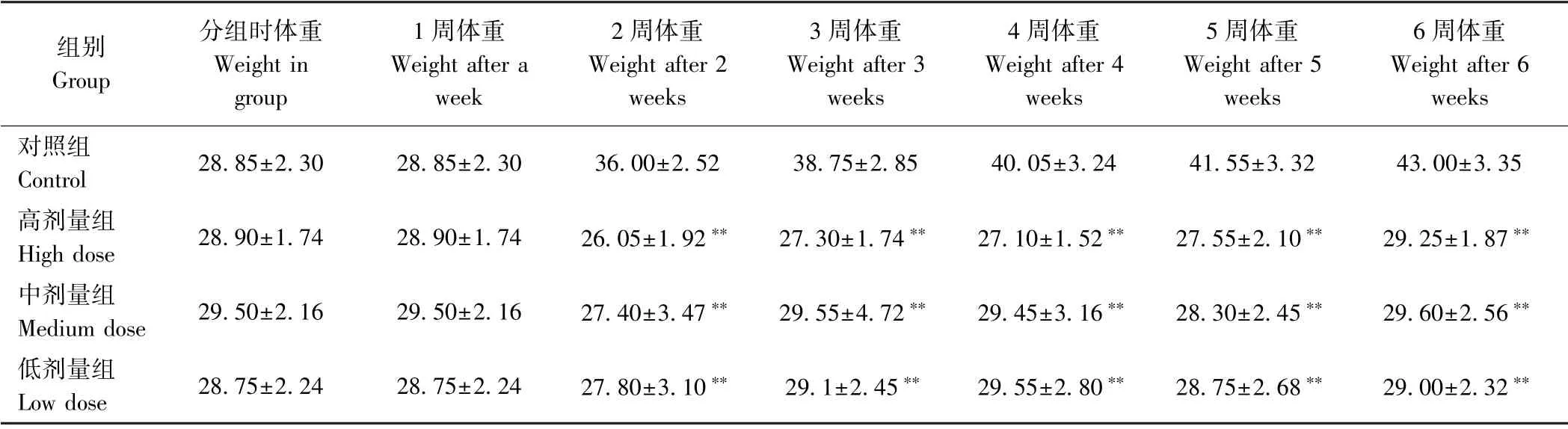
表2 秋葵微粉对小鼠体重的影响(n=10)Table2 Effect of okra powder on body weight of mice(n=10)/g
2.3 秋葵微粉对小鼠粪便质量、水分和pH值的影响
由表3可知,秋葵微粉灌胃小鼠6 周后,与对照组相比,各剂量组小鼠粪便质量均降低,但无显著差异(P>0.05),可能与小鼠自由摄食量有关,因为秋葵微粉富含膳食纤维、粘性多糖及果胶,进入小肠、大肠后充分吸水使小鼠具有饱腹感,从而减少自由摄食量,这从小鼠体重的变化已得到证实。与对照组相比,各剂量组小鼠粪便水分含量均增加,高、中、低剂量组分别增加了31.19%、20.29%、16.80%,其中高剂量组与对照组差异显著(P<0.05),说明秋葵微粉具有较强的亲水性。与对照组相比,各剂量组小鼠粪便pH值均极显著降低(P<0.01),可能与肠道微生物发酵水溶性多糖和促进SCFA 产生有关[24-25]。
2.4 秋葵微粉对小鼠结肠、盲肠质量的影响
由表4可知,与对照组相比,低剂量组小鼠结肠质量显著降低(P<0.05),中剂量组盲肠质量显著降低(P<0.05)。这与前人研究结果不一致,吕钟钟等[26]研究发现给小鼠喂食豆渣、竹笋、及海藻等复合多糖能够增加其结肠和盲肠质量;杨光等[27]采用多糖强化冻干山楂果灌胃小鼠,发现高剂量组盲肠质量增加了19.61%,结肠质量增加了14.58%。这可能与秋葵微粉能增加小鼠饱腹感有关,在试验过程中观察到各剂量组小鼠摄食量均较小,从而导致体重增加缓慢。另外,试验过程中观察到各剂量组小鼠的首粒粪便时间缩短,表明秋葵微粉可有效改善肠道内容物的质量。这可能与秋葵微粉中的多糖富含亲水基团有关,2.3部分的试验结果也证实了秋葵微粉具有较强的持水能力。此外,高分子多糖在肠道内可形成一定的渗透性纤维层,可吸收某些物质,从而提高肠内容物的质量。与对照组相比,各剂量组盲肠和结肠内容物pH值均下降,但无统计学意义(P>0.05)。

表3 秋 葵微粉对小鼠粪便质量、水分和pH值的影响(n=10)Table3 Effect of okra powder on fecal weight,water content and pH value in mice(n=10)

表4 秋葵微粉对小鼠盲肠、结肠的质量和pH值的影响(n=10)Table4 Effect of okra powder on cecum and colon weight and pH value in mice(n=10)
2.5 秋葵微粉对小鼠肠道菌群的影响
2.5.1 菌群多样性分析 按97%的序列相似性聚类为OTUs (operational taxonomic units)[28],得到每个cluster的序列及其代表序列(即为OTU)。由表5可知,各剂量组盲肠内容物菌群的OTU数量均极显著高于对照组(P<0.01),其中OTU数量最多的为中剂量组(8 173.00),对照组最少(2 511.80),表明各剂量组小鼠盲肠内容物中菌群的相对丰度较高。Alpha 多样性主要用于反映物种丰富度、均匀度和测序深度[29]。Chao1 指数用于估计样品中所含OTU数目,数值越大表明菌群相对丰度越大。结果表明,Chaol值最高的为中剂量组(2 834.36),高剂量组最低(2 400.12),对照组的Chaol值与高、低剂量组均无显著差异(P>0.05)。Simpson 指数越高表示样品物种多样性越高。对照组Simpson值在4 组样品中最小(0.98),各剂量组Simpson值均为0.99。Shannon 指数主要用于描述OTU的无序度和不确定性,不确定性越高表明多样性指数越高[30]。4 组样品中中剂量组的Shannon值最大(8.50),低剂量组次之(8.30),对照组再次之(8.20),高剂量组最低(8.13)。Observed species 指数表示样品中含有的OTU数目,中剂量组的OTU数目最多(1 803),高剂量组的OTU数据最少(1 586)。各剂量组与对照组相比,其Shannon 指数、Observed species 指数和Simpson 指数均未表现出显著差异(P>0.05)。综上,小鼠经过6 周灌胃秋葵微粉后,其肠道菌群的多样性高于对照组,且秋葵微粉中剂量组的盲肠内容物菌群相对丰度在各剂量组中最高。
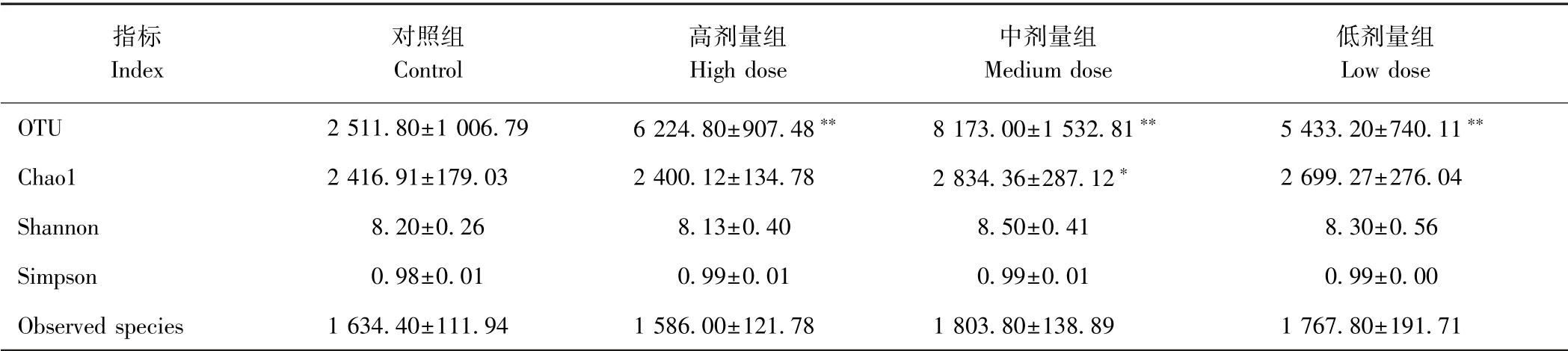
表5 小鼠盲肠内容物菌群的OTU数量及Alpha 多样性(n=10)Table5 OTU number and Alpha diversity of cecal content flora in mice(n=10)
由表6可知,各剂量组结肠内容物菌群的OTU数量均高于对照组,但无显著差异(P>0.05);其中OTU数量最多的为高剂量组(7 906.00),对照组最少(3 466.60),表明各剂量组小鼠结肠内容物中菌群的相对丰度较高。Chaol值最高的为中剂量组(2 876.21),且极显著高于对照组(P<0.01);低剂量(2 714.16)显著高于对照组。4 组样品的Simpson值均为0.99。对照组的Shannon值最小(8.28),各剂量组Shannon值均高于对照组(P>0.05),且随着秋葵微粉剂量增加而增大。中剂量组物种数目最多(1 876.00),对照组的物种数目最少(1 653.00)。各剂量组与对照组之间Shannon 指数、Observed species指数及Simpson 指数差异均不显著(P>0.05)。表明秋葵微粉具有改善小鼠肠道菌群多样性的作用。
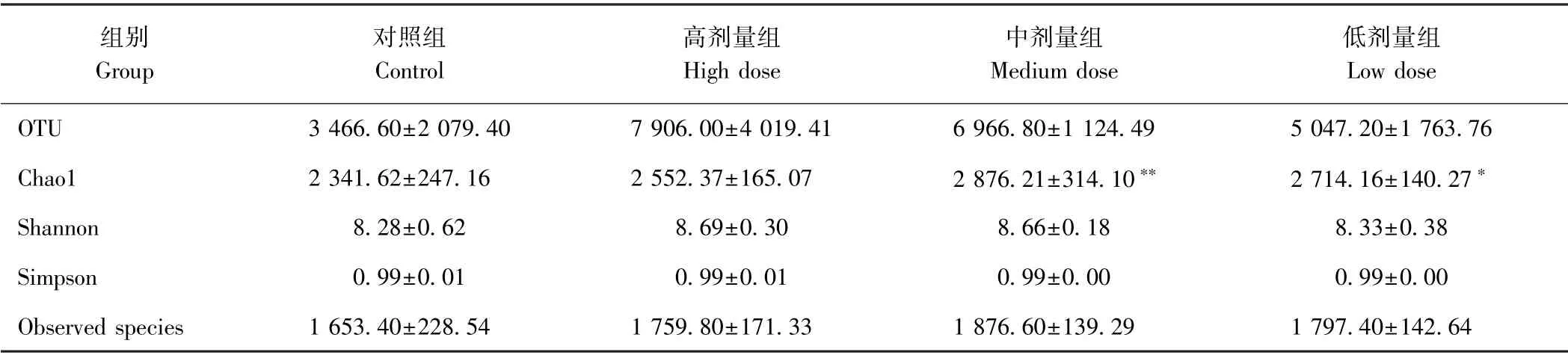
表6 小鼠结肠内容物菌群的OTU数量及Alpha 多样性(n=10)Table6 OTU number and Alpha diversity of mouse colonic flora in mice(n=10)
2.5.2 菌群构成分析 根据样品物种丰度表,默认选取丰度最高的20个属群,将其余的属群设置为其他(Others),计算相对丰度,并以此绘制样品相对丰度堆叠柱状图。该柱状图虽然可以直观看到不同样品的属群丰度情况,但是无法直接观察样品之间的相似性远近。为此,在柱状图的基础上,根据样品间Bray-Curtis距离进行聚类分析。最终,将样品聚类结果和样品相对丰度柱状图整合展示。
由图1-B可知,对照组结肠内容物(JA)、低剂量组结肠内容物(JB)、中剂量组结肠内容物(JC)以及JD(高剂量组结肠内容物)4 组样品的微生物组成在属的水平上,以未分类毛螺菌(Lachnospiraceae_unclassified)、未分类紫外单胞菌(Porphyromonadaceae_unclassified)、未分类乳酸杆菌(Lactobacillus)和未分类瘤胃球菌(Ruminococcaceae_unclassified)为主要物种,所占比例均在55.64% 以上。肠道菌群主要归属厚壁菌门和拟杆菌门[30-31]。Lactobacillus是对人体肠道有益的微生物,JA 中占5.74%,而在JB、JC和JD 中的比例分别为20.73%、13.39%和24.84%,表明秋葵微粉有助于小鼠肠道Lactobacillus的增殖,其中JD的增加效果最为突出。拟杆菌(Bacteroides)在对照组中占1.29%,而在高、中、低各剂量组中所占比例均下降,分别为0.46%、1.13%和0.76%。枝菌(Alistipes)可能导致肠道炎症,在JA 中占1.71%,在JB和JC 中降至1.02%和1.53%,而在JD 中升高至2.05%。支原体(Allobaculum)致人体炎症及并发症(不孕不育),在JA中含量高达4.98%,JC 中为2.90%,其在JB 中仅为0.70%,而在JD 中未检出。以上结果表明,小鼠摄入秋葵微粉有利于肠道益生菌增殖,同时对病原菌的生长也有一定的抑制作用,从而起到改善小鼠其肠道菌群的作用。
对照组盲肠内容物(MA)、低剂量组盲肠内容物(MB)、中剂量组盲肠内容物(MC)以及高剂量组盲肠内容物(MD)4 组样品的微生物组成在属的水平上,仍以Lachnospiraceae_unclassified、Porphyromonadaceae_unclassified、Lactobacillus和Ruminococcaceae_unclassified为主,所占比例均在53.67%以上。Lactobacillus在MA 中占7.31%,而在MB、MC和MD中的比例随着秋葵微粉剂量增加而增加,分别为25.01%、26.52%和31.82%。Bacteroides在MA 中占0.55%;在MB和MD 中占比例均下降,分别为0.43%和0.17%;在MC 中占0.61%,略有增加。Alistipes在MA 中占1.10%,而在MB、MC和MD 中的比例均降低,分 别为0.46%、0.60%和0.31%。MA 中Allobaculum所占比例高达5.80%,MB为0.18%,MC为3.62%,MD为0.02%。以上结果与小鼠结肠内容物的菌群分布结果类似。
由图1-A可知,低剂量组结肠内容物和高剂量组结肠内容物在细菌群落物种组成上较为接近;低剂量组盲肠内容物和中剂量组盲肠内容物在细菌群落物种组成上较为接近;而结肠对照组内容物和盲肠对照组内容物在物细菌群落种组成上较为接近。进一步说明秋葵微粉摄入量会影响小鼠肠道菌落结构的变化。
2.6 秋葵微粉对小鼠盲肠及结肠内容物中SCFA含量的影响
乙酸、丙酸和丁酸是小鼠盲肠内容物中含量最高的3种SCFA。由表7可知,与对照组相比,高、中、低剂量组盲肠内酵解产物SCFA含量均提高,乙酸含量明显高于其他2种SCFA,因为乙酸是多糖在肠道内发酵后的最主要产物。与对照组相比,高、中、低剂量组盲肠内乙酸含量分别提高了15.85%(P>0.05)、222.58%(P<0.01)和67.08%(P<0.01);丙酸含量分别极显著提高了236.43%、199.96%、269.94%;丁酸含量分别极显著提高了 174.17%、589.59%、161.25%。说明秋葵微粉可有效促进盲肠内容物的发酵,促进盲肠内酸性物质增加,降低其pH值,有利于盲肠微生物生存。

图1 属水平上各样本细菌群落变化的距离聚类树(A)和相对丰度图(B)Fig.1 Bray-curtis distance(A) and relative abundance(B) of bacterial community changes in different samples at genus level

表7 秋葵微粉对小鼠盲肠内容物中SCFA含量的影响(n=10)Table7 Effect of okra powder on the content of short chain fatty acids in cecal contents of mice(n=10)
由表8可知,与对照组相比,各剂量组小鼠结肠内容物中SCFA含量均增加,乙酸含量也高于其他2种SCFA。结肠中SCFA的含量较盲肠中低,这是由于内容物从盲肠到结肠的过程中,SCFA 不断被肠粘膜细胞吸收。与对照组相比,高、中、低剂量组盲肠内乙酸的提高率分别为3.45%、11.96%和6.11%;丙酸含量提高率分别为47.17%、29.95%和72.45%;丁酸含量提高率分别为19.27%、30.37%和13.34%。此结果与小鼠盲肠内容物中SCFA含量上升趋势一致,进一步说明秋葵微粉具有短时间内大幅度提高结肠内容物质酵解反应速度的作用,乙酸、丙酸和丁酸在结肠中大量产生可有效降低结肠内pH值,促进益生菌繁殖,抑制有害菌生长,保护肠道健康。
3 讨论
大量研究证实,多糖可改善肠道微生态,将蒲公英多糖[32]、桑叶多糖[33]用于肠道菌群失调的小鼠,均能一定程度上恢复小鼠肠道的微生态平衡;牛膝多糖用于断奶仔猪免疫应激模型中,能够使仔猪乳酸菌、大肠埃希菌、肠球菌维持在正常水平[34];芦荟多糖用于试验性大鼠结肠炎模型,能够缓解结肠黏膜炎症状态[35]。大量研究证实多糖可改善肠道产酸,将大豆低聚糖用于不同膳食模式下的健康成人,发现在高动物性食物模式下的肠道SCFA 总量明显增加,以乙酸和丁酸最为突出[36]。Melliana 等[37]将12种膳食纤维用于人体肠道微生物体外发酵,发现上述12种膳食纤维均能促进产生SCFA。庞秋芳等[38]将直肠菌群对瓜尔豆胶、果胶进行体外发酵试验,发现2种植物胶均能促进产生SCFA。本试验采用热风干燥、微粉碎技术处理新鲜秋葵得到的秋葵微粉,其多糖含量高达43.65%,推测秋葵微粉具有改善动物肠道作用应该与其富含多糖密切相关。
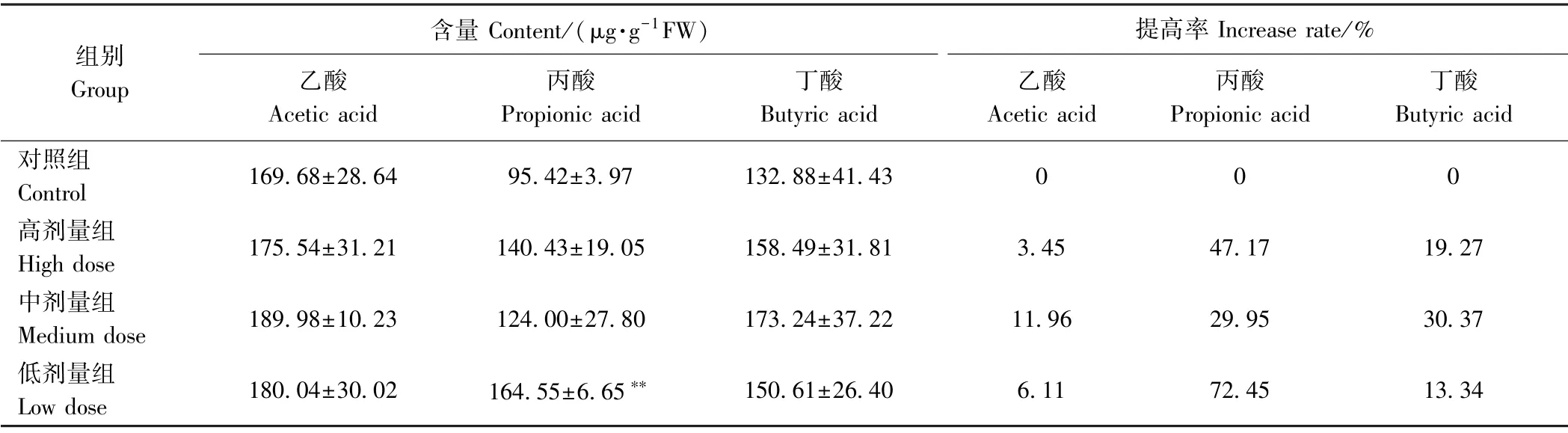
表8 秋葵微粉对小鼠结肠内容物中SCFA含量的影响Table8 Effect of okra powder on the content of short chain fatty acids in colon contents of mice(n=10)
研究表明,微生态调节剂并不是剂量越高效果越好,过高剂量的摄入在诱导双歧杆菌增殖的同时,会减少丁酸产生菌的数量,诱导菌群多样性下降[29-30]。本研究发现,小鼠过量摄食秋葵微粉会干扰其体重的增长,可能与秋葵微粉本身的特殊气味以及低能量、饱腹感有关。因此,综合考虑生产成本和改善肠道的效果,低剂量更为适宜。
4 结论
秋葵微粉具有提高小鼠肠道内容物保水性,降低肠道内容物及粪便pH值的作用,可促进肠道内酵解作用,提高肠道菌群的多样性,抑制Alistipes、Allobaculum等有害菌的增殖,促进Lactobacillus等有益菌的增殖;促进肠道乙酸、丙酸和丁酸等SCFA含量明显增加,预防有害微生物繁殖引起相关肠道疾病。3个剂量的秋葵微粉对调节小鼠肠道健康均有显著效果,其中,低剂量秋葵微粉(450 mg·kg-1·d-1)更具实际应用价值。

