新生儿化脓性脑膜炎并发脑白质损伤危险因素分析
王海如 秦梓健 王 斌 欧阳学军
南方医科大学珠江医院儿科中心 广州市炎症与免疫性疾病重点实验室(广东广州 510280)
新生儿化脓性脑膜炎是指在新生儿期由不同颅内细菌感染导致的临床上较为常见的中枢神经系统疾病,其发病率约0.006%~0.100%,病死率高达15%~30%[1]。由于新生儿期是大脑发育的关键时期,新生儿化脓性脑膜炎极易引起脑白质损伤(white matter damage,WMD),影响大脑正常发育进程,导致癫痫、听力障碍、智力或运动障碍等神经系统后遗症状[2-3],对家庭及社会造成沉重的负担。因此早期判断新生儿化脓性脑膜炎预后情况,并尽可能减少神经系统后遗症的发生一直是新生儿科关注的焦点。本研究通过对170例足月化脓性脑膜炎新生儿的临床资料的回顾性分析,探讨新生儿化脓性脑膜炎并发WMD 的高危因素,为临床早期预测WMD发生提供理论依据。
1 对象与方法
1.1 研究对象
选取2008年1月至2018年1月南方医科大学附属珠江医院新生儿重症监护病房(NICU)收治的170例足月化脓性脑膜炎新生儿的临床资料进行分析。研究对象入选标准:①发病年龄≤28天;②出生胎龄≥37周;③主要诊断明确为新生儿化脓性脑膜炎;④所有患儿都有相关诊疗记录。排除标准:①并发有脊柱裂、脑脊膜膨出等先天性颅脑畸形;②并发有严重的代谢综合征,如顽固性低血糖、高氨血症等;③出生时有窒息复苏史,可能合并新生儿缺氧缺血性脑病;④疗程结束前或出院前未能完善影像学检查;⑤住院时间短,诊断未明确前家属要求自动出院。
对临床高度怀疑脑膜炎的新生儿行脑脊液检查,新生儿化脓性脑膜炎诊断标准:①脑脊液培养或涂片阳性;②脑脊液白细胞数(cerebrospinal fluidwhite blood cell,CSF-WBC)>20×106/L,脑脊液蛋白(cerebrospinal fluid-protein,CSF-Pro)>1.0 g/L,脑脊液葡萄糖(cerebrospinal fluid-glucose,CSF-Glu)<1.7 mmol/L)[3-4]。
根据患儿入院首次头颅影像学判断是否合并WMD,分为WMD组(化脓性脑膜炎并发WMD)和对照组(化脓性脑膜炎未合并WMD)。
1.2 方法
1.2.1 临床资料收集 为了明确足月化脓性脑膜炎新生儿并发WMD 的风险因素,收集以下临床资料:起病年龄、性别、分娩方式、入院前高热(体温>39 ℃),入院前惊厥表现、入院时意识改变、高胆红素血症(总胆红素≥221 μmol/L)、入院时前囟张力改变、首次CSF-WBC>500×106/L、首次CSF-Pro>2 g/L、首次CSF-Glu<1.1 mmol/L、首次脑脊液乳酸脱氢酶(CSFLDH)>300 U/L、入院后首次C反应蛋白(CRP)升高(>100 mg/L)、细菌培养阳性。
1.2.2 WMD诊断 磁共振成像(MRI)主要包括下述表现:①侧脑室周围白质水肿,伴或不伴皮层下白质及灰质损伤;②侧脑室周围及背侧软化灶形成;③损伤后灰白质丢失、萎缩及脑发育障碍[6]。
1.2.3 脑电图诊断 异常脑电图分为轻度、中度以及重度。轻度异常表现为背景活动成熟轻度延迟,局灶性电衰减,少量或者轻度异常背景上少量的局灶性或者多灶性放电;中度异常表现为持续普遍性电压降低,单一节律或者其他形式的电发作;重度异常表现为局灶性或者一侧性周期性放电,半球间过度不同步和/或不对称,占50%以上,严重低电压甚至电静息,爆发-抑制,弥漫性慢活动[7]。
1.2.4 脑干听觉诱发电位(BAEP)判断标准 参照《脑诱发电位学》标准[8]:①Ⅰ、Ⅲ、Ⅴ波潜伏期以及波间期值为>+3 s 为异常;②V/I 比值<0.5,各波幅波幅差>50%,各波幅潜伏期以及峰间期>0.43 ms为异常;③V 波反应阈值≤39 dBnHL 为正常,40~60 dBnHL为轻度异常,61~89 dBnHL为中度异常,≥90 dBnHL为重度异常。
1.3 统计学分析
采用SPSS 20.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验。计数资料以百分比表示,组间比较采用χ2检验、校正χ2检验或Fisher精确概率法检验。采用多元logistic 回归分析新生儿化脓性脑膜炎并发WMD 的危险因素。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,用ROC曲线下面积(area under curve,AUC)评估各独立危险因素在WMD 中的预测价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
共纳入170 例足月化脓性脑膜炎新生儿,其中并发WMD32例,占18.82%。WMD组中男20例、女12例,平均胎龄为(38.71±1.14)周,平均出生体质量为(2.94±0.26)kg;另138例患儿未并发WMD(对照组),男80例、女58例,平均胎龄为(38.62±1.04)周,平均出生体质量为(2.97±0.25)kg。两组患儿性别、出生胎龄、出生体质量差异无统计学意义(P>0.05)。见表1。
WMD组中28例头颅MRI表现为脑室周围T1低信号、T2高信号影;3例表现为T1低信号、T2混合信号影;1例为T1高信号、T2低信号影,并T1低信号、T2高信号影。32例WMD组新生儿中,合并脑积水9例,合并硬膜下积液1例。
2.2 两组患儿临床资料比较
单因素分析显示,惊厥表现、意识改变、前囟张力增高、CRP>100 mg/L、脑脊液异常(CSFWBC>500×106/L、CSF-LDH>300 U/L、CSFPro>2.0 g/L,CSF-Glu<1.1 mmol/L)及细菌培养阳性,在WMD 组与对照组之间的差异有统计学意义(P<0.05)。见表1。
细菌培养结果显示,170 例患儿中有6 0 例(35.29%)有明确的细菌病原学诊断,其中革兰阴性杆菌25例:大肠埃希菌20例,肺炎-克雷伯杆菌3例,洋葱伯克霍菌2 例;革兰阳性球菌35 例:B 族溶血链球菌16 例,表皮葡萄球菌10 例,溶血葡萄球菌4 例,粪肠球菌3例,肺炎链球菌2例。
32 例WMD 组新生儿中17 例病原菌培养阳性,其中革兰阴性杆菌7 例:大肠埃希菌4 例、肺炎克雷伯杆菌1例、洋葱伯克霍菌2例;革兰阳性球菌10例:B 族溶血链球菌6 例、表皮葡萄球菌2 例、溶血葡萄球菌1 例、粪肠球菌1 例。WMD 组的洋葱伯克霍菌阳性率高于对照组,差异有统计学意义(P<0.05);但WMD 组和对照组之间革兰阳性球菌及阴性杆菌阳性率差异无统计学意义(P>0.05)。见表2。
170例患儿中14例(8.24%)出现同年龄组异常脑电图,轻度异常脑电图8例、中度5例、重度1例。BAEP结果提示并发单侧或双侧听力异常31例(18.24%),其中轻度10例、中度8例、重度13例。WMD组出现同年龄组异常脑电图8例(25.00%),轻度异常脑电图4例、中度3例、重度1例。听力损害16例(50.00%),其中轻度3例、中度4例、重度9例。WMD组同年龄组异常脑电图以及听力损害发生率均高于对照组,差异有统计学意义(P<0.05)。见表1。
2.3 Logistic回归分析
把单因素分析具有统计学意义的因素纳入多元logistic 回归分析,结果显示,惊厥表现(OR=5.28,95%CI:1.80~15.56,P=0.003)、CSF-WBC 升高(OR=4.22,95%CI:1.47~12.07,P=0.007)、CSF-LDH 升高(OR=3.64,95%CI:1.11~11.99,P=0.034)、细菌培养阳性(OR=3.12,95%CI:1.13~8.62,P=0.028)为足月新生儿化脓性脑膜炎并发WMD 的独立危险因素。见表3。
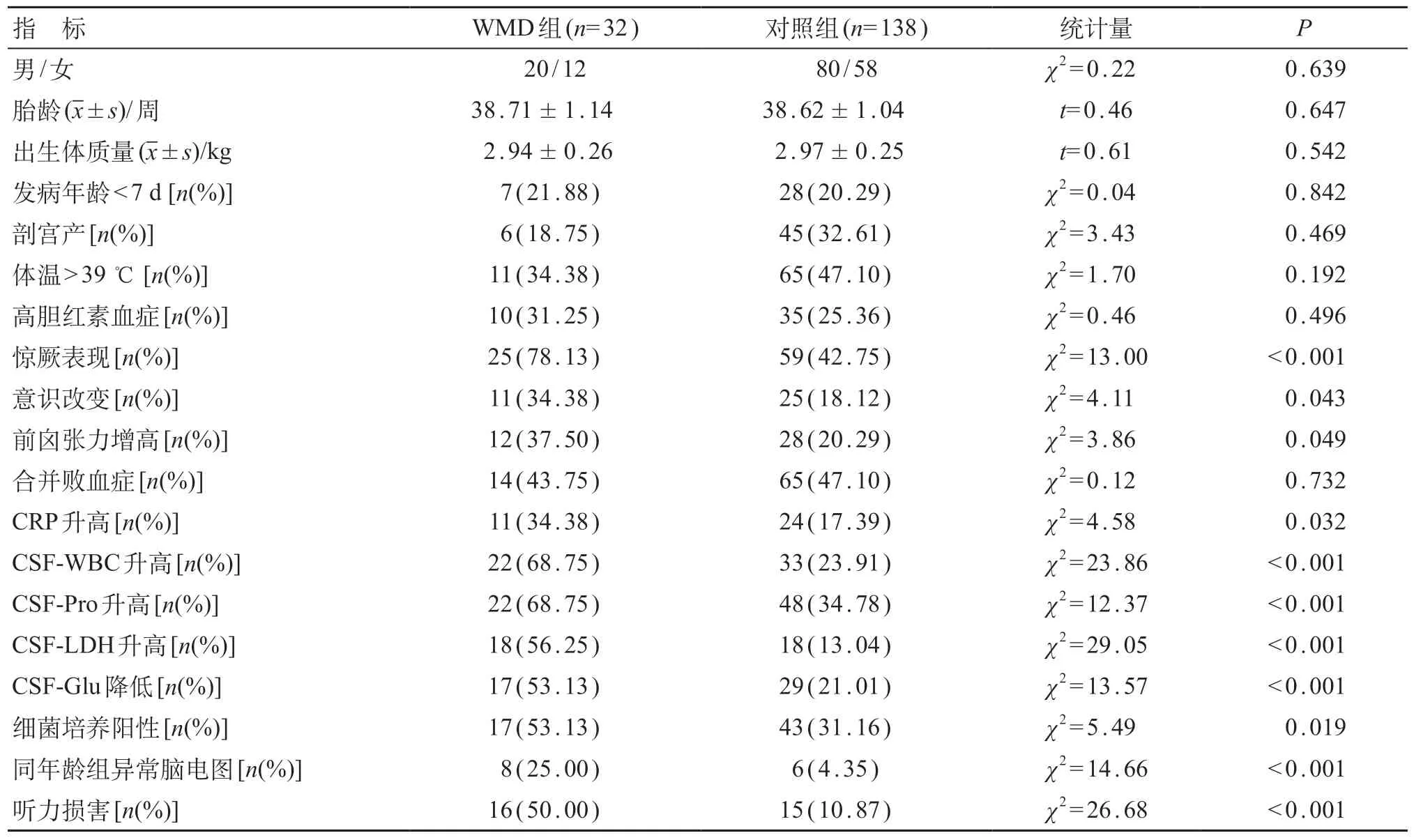
表1 两组足月化脓性脑膜炎新生儿一般情况及并发WMD单因素分析
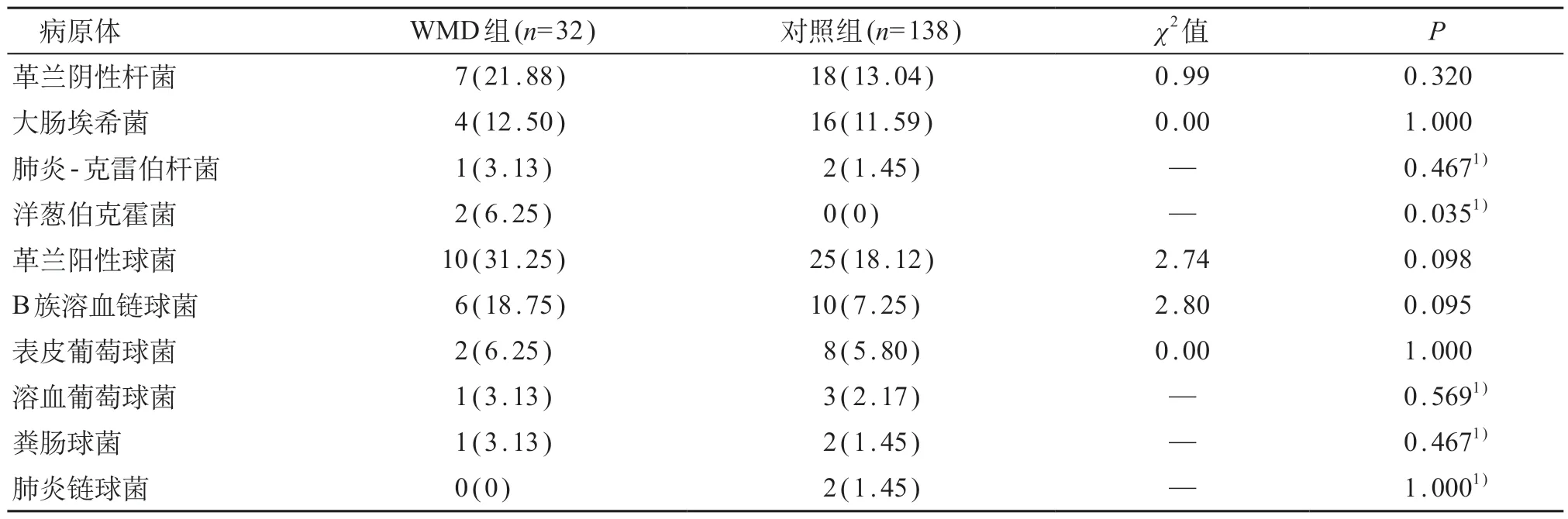
表2 170例足月新生儿化脓性脑膜炎病原学分析[n(%)]
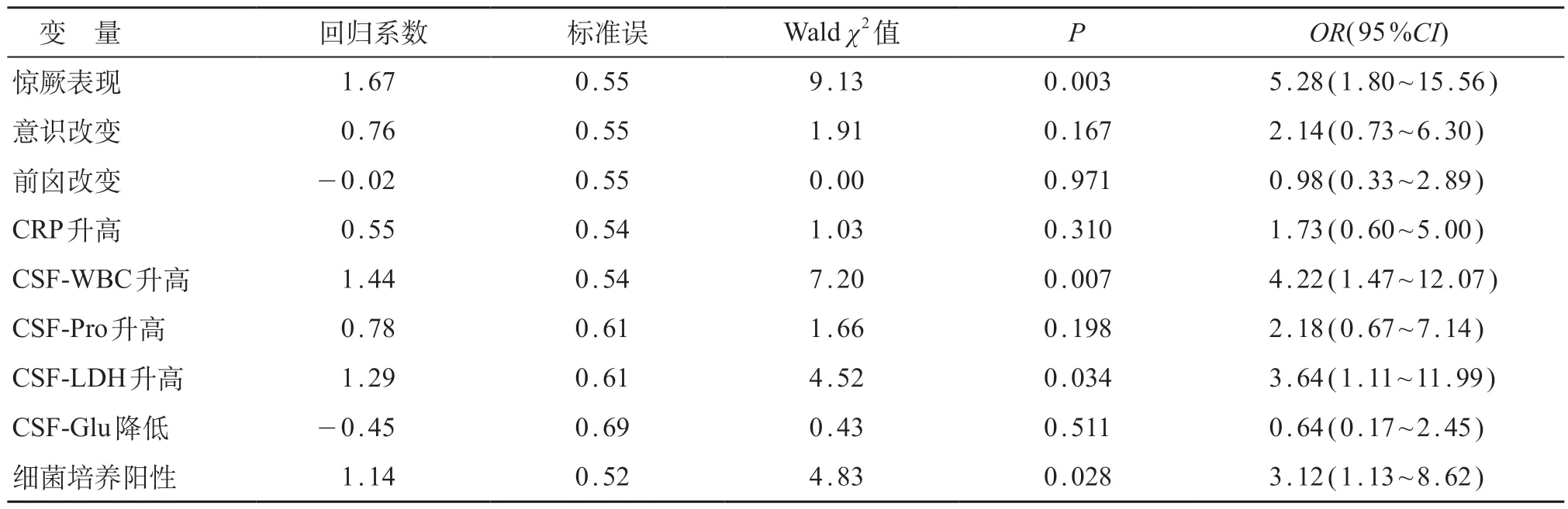
表3 新生儿化脓性脑膜炎并发WMD危险因素的多元logistic回归分析
2.4 ROC曲线
将连续变量CSF-WBC、CSF-LDH 绘制ROC 曲线,发现CSF-WBC(AUC=0.707)以及 CSF-LDH(AUC=0.672)对于预测化脓性脑膜炎并发WMD 有一定准确性。见图1。
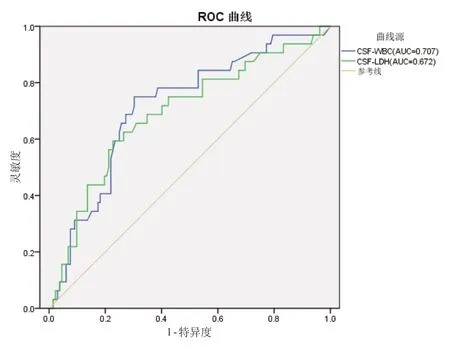
图1 CSF-WBC 和CSF-LDH 预测WMD 的ROC 曲线图
2.5 随访
32例WMD组新生儿,出院后失访17例,其余15例进行规律随访,随访时间最短半年,最长2 年。8 例患儿神经系统发育无异常,6例出现不同程度精神、运动发育迟缓,1例出院后死亡。
3 讨论
新生儿化性脑膜炎是临床上较为常见的中枢神经系统感染性疾病,是引起神经功能障碍的主要原因之一[9]。研究认为,并发异常的头颅彩超和MRI表现与神经系统后遗症有关,其中并发WMD、脑积水等是出现神经系统后遗症的常见高危因素[10]。化脓性脑膜炎除了累及脑膜,还累及脑实质及脑室系统,尤其是脑白质损伤,易受早产、低出生体质量等因素的损害,此外也跟感染及炎症密切相关,导致神经系统发育落后,严重者发展为脑瘫[2]。本研究以足月新生儿为研究对象,共收集170例新生儿化脓性脑膜炎病例,其中32 例(18.82%)并发WMD。WMD 并不仅仅发生在早产儿,其在足月新生儿中的发生也越来越多被认识到,国内外等研究结果认为新生儿化脓性脑膜炎可并发不同程度WMD[2,11]。WMD的机制包括小胶质细胞活化和细胞凋亡紊乱,导致少突胶质细胞成熟停止,神经发生、轴突生长和突触生成受损[12]。炎症引起WMD 可能与免疫递质的诱导、活性氧、兴奋毒性反应、线粒体损伤和血管完整性降低等因素有关[13]。
本研究WMD组同年龄组异常脑电图以及听力损害发生率均高于对照组,与相关研究结果一致[14]。广泛的WMD 会造成视听功能受损,导致神经系统后遗症,如癫痫发作、听力缺陷、学习和行为问题。新生儿化脓性脑膜炎缺乏典型临床表现[15],本研究提示体温>39.0 ℃(44.71%)、早期惊厥表现(46.41%)、高胆红素血症(26.47%)为新生儿化脓性脑膜炎最常见的临床表现。多元logistic分析结果提示,早期惊厥表现是并发WMD 的独立危险因素。据报道,入院时或住院期间惊厥发作是新生儿细菌性脑膜炎发生后遗症和死亡的高危因素[16]。相关研究认为化脓性脑膜炎患儿早期惊厥发作可能是其不良预后的早期预测因子,需要密切监测[17]。
本研究发现CSF-WBC 和CSF-LDH 升高是并发WMD 的独立危险因素,ROC 曲线分析提示CSFWBC(AUC=0.707)、CSF-LDH(AUC=0.672)对预测WMD发生有一定准确性。由于细菌突破新生儿未成熟的血脑屏障后迅速繁殖,消耗大量葡萄糖并释放具有大量高免疫原性的毒素,导致炎性因子释放及血脑屏障通透性增加,出现脑脊液化学改变[18]。化脓性脑膜炎由于致病菌的生长繁殖出现炎性坏死,以及脑组织病变缺氧、缺血,通过加强糖酵解作用,使酶活性增强以及细胞释放量增加,使CSF中LDH明显升高。此外,有研究认为CSF中LDH升高提示中枢神经系统损伤的可能性很高[19]。因此临床实践中应综合分析CSF化学改变情况,为预后判断提供客观依据。
本研究提示细菌培养阳性(OR=3.12)是并发WMD 的独立危险因素。相关研究认为化脓性脑膜炎新生儿的细菌培养阳性与神经系统并发症高度相关[20],可能由于细菌直接入侵,也可能是脓毒症相关性脑病,或两者同时引起神经系统并发症。新生儿化脓性脑膜炎病原菌的分布存在地域差异,发达国家主要为B 族溶血链球菌,其次为大肠埃希菌[4]。本研究中32 例化脓性脑膜炎并发WMD 患儿中有17 例病原菌培养阳性,其中革兰阳性菌10 例,革兰阴性菌7例,最常见的为大肠埃希菌,其次为B族溶血链球菌。WMD 组的洋葱伯克霍菌阳性率高于对照组。相关研究提示B 族溶血链球菌脑膜炎可并发WMD[10],与没有白质病变的患者相比,白质中广泛双侧病变的患儿发生不良运动结果的风险更高,与较差的神经发育结局有关。据报道,B族溶血链球菌仍然是引起3个月以下幼儿细菌性脑膜炎最常见的病原体,小婴儿中B族溶血链球菌脑膜炎的病死率为11.4%,B族溶血链球菌脑膜炎幸存者中有32%存在神经发育障碍[17]。B族溶血链球菌化脓性脑膜炎预后与患儿血清型有关,其中血清III型与脑膜炎有关系,而且严重的患儿大部分以III型为主,III型B族溶血链球菌对血管内皮组织、绒毛膜以及新生儿肺等组织具有很强的黏附能力,并且难以肃清[21],因此临床工作中对于B族溶血链球菌脑膜炎需要引起足够的重视。
此外,本研究中,洋葱伯克霍菌病原体感染的患儿并发WMD的比例更高。该菌属于革兰阴性需氧非发酵菌,成人的报道相对较多,在儿童较少。该菌容易引发耐药,因此在治疗上存在一定的困难,由于患儿年龄小,抵抗力低下,大多存在严重的基础疾病,所以治疗时间长,病死率高[22]。但由于相关报道及病例少见,仍需要进一步研究。
综上所述,惊厥表现、CSF-WBC升高、CSF-LDH升高、细菌培养阳性均为新生儿化脓性脑膜炎并发WMD的独立危险因素,在临床实践中应高度警惕,并予积极治疗及干预。但本研究由于部分家属依从性欠佳,不能跟踪随访其远期出现神经系统发育不良及神经系统后遗症(癫痫、听力障碍等)的情况,因此在后续研究中需对这些患儿进行长期随访。此外,未来应进一步进行新生儿化脓性脑膜炎的神经影像学表现与远期预后相关性的研究。

