人源化免疫肺癌小鼠模型的建立及其在程序性死亡受体1 抑制剂疗效评估中的作用
周 箴,徐云华,张菲菲,赵 艺,郭 林,付国龙,沈盛萍,冷雪娇
1. 上海市胸科医院,上海交通大学附属胸科医院,上海肺部肿瘤临床医学中心,上海 200030;2. 上海立迪生物技术股份有限公司,上海201203
肺癌是世界上最常见的恶性肿瘤之一和最常见的癌症死亡原因之一,被认为是当今世界上对人类健康危害最大的恶性肿瘤,其中以非小细胞肺癌(non-small cell lung cancer,NSCLC)最为常见,约占肺癌的80%[1]。临床上晚期肺癌的主要治疗方式包括化学治疗(化疗)、放射治疗(放疗)及分子靶向治疗等。尽管有多种化疗药物和分子靶向药物在临床上得到应用,但存在化疗药物效果不够理想和分子靶向药物易耐药等问题。晚期肺癌患者的5年生存率仍很低,因此临床上迫切需要寻找新的治疗手段和治疗靶点[2-4]。
近年来,肿瘤免疫治疗技术发展迅速,其中以程序性死亡受体1(programmed death-1,PD-1)及其配体程序性死亡配体1(programmed death-ligand 1,PD-L1)为靶点的免疫检查点抑制剂在肺癌临床治疗中取得了突破性的进展,其机制是通过阻断免疫细胞上的PD-1与肿瘤细胞上PD-L1的相互作用,从而解除T细胞活性的受抑状态,促进T细胞再活化,从而发挥抗肿瘤效果[5-8]。随着2015年PD-1抑制剂纳武单抗(nivolumab)和派姆单抗(pembrolizumab)获批用于转移性鳞状NSCLC和非鳞状NSCLC的治疗,免疫治疗在肺癌的治疗中越来越受到重视。同时,国内也陆续有自主研发的免疫检查点抑制剂进入临床试验。
然而,PD-1/PD-L1免疫检查点抑制剂的临床疗效仅为20%~45%,显示出明显的个体差异,并且存在由免疫介导产生的不良事件以及肿瘤快速进展等情况[9-10]。因此,明确哪些患者能从PD-1/PD-L1免疫治疗中获益是一个亟需解决的问题。
来源于患者原代肿瘤组织的人源异种移植(patientderived tumor xenograft,PDX)模型与传统细胞系异种移植(cell-derived xenograft,CDX)模型[11-12]及基因工程鼠模型不同,其直接采用患者肿瘤组织来建立皮下移植瘤模型,能更好地保留肿瘤在个体中特殊的功能性基因结构及生物学标志物,更接近个体化的临床生物学特征,重现人类癌症的复杂状态,如肿瘤细胞的异质性和肿瘤微环境等[13-14],是目前国际公认的最能代表人类肿瘤遗传信息特征的小鼠异种移植瘤模型[15-17],能为药物的筛选及疗效观察提供更好的预测。近年来,PDX技术发展迅速,展现出其在药物筛选、疗效评估、临床同期治疗效果预测和临床后期耐药原因剖析上的重要作用。在一定条件下,PDX样本对传统化疗药物的有效率和耐药率的预测准确度可达90%和97%[15]。近年来人源化免疫PDX模型均建立在PDX模型的基础上,使之同时包含人类肿瘤细胞和免疫细胞;该模型是评价新型免疫治疗剂效果的一个具有巨大潜力的转化医学平台[18-20]。长久以来,以人类CD34+造血干细胞和祖细胞(hematopoietic stem and progenitor cell,HSPC)为基础的人源免疫系统重建是多数研究的重点[21-24],但因为模型使用的小鼠为免疫缺陷小鼠,缺少T细胞发育所必需的胸腺,所以该模型小鼠体内无法形成成熟的T细胞,在细胞免疫和体液免疫方面均存在功能缺陷。此外,该模型构建时间长,构建过程复杂;而且人脐带血来源的CD34+HSPC多来自不同个体,导致实验结果不稳定,因此该模型很难大规模应用。
目前仅有少量研究[25-26]使用外周血单核细胞(peripheral blood mononuclear cell,PBMC)建立人源化免疫小鼠。PBMC包含已经发育成熟的免疫细胞,细胞功能完善,而且模型制备时间短,可以较快获得人CD3+T细胞。因此,本研究在此基础上探索了PBMC人源化免疫PDX模型的方法,对采用PBMC建立人源化免疫肺癌PDX模型的可行性进行了研究,并初步验证该模型用于评估PD-1抑制剂治疗NSCLC的效果。
1 材料与方法
1.1 肿瘤样本
样本来源于2015年8月—2017年12月在上海交通大学附属胸科医院治疗的晚期NSCLC患者的胸腔积液或活检组织(多数为肺癌小活检组织,少数为远处淋巴结活检组织)。样本入组标准为未见驱动基因突变、基因重排或融合的晚期NSCLC。本项目获上海市胸科医院伦理委员会审查及批准(KS1872)。
1.2 实验动物
雌性CB17-SCID小鼠(重症联合免疫缺陷小鼠),6~8周龄,购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2016-0006。雌性NCG小鼠(高度免疫缺陷小鼠),6~8周龄,购自南京大学-南京生物医药研究院,生产许可证号为SCXK(苏)2015-0001。所有小鼠均饲养于上海立迪生物技术股份有限公司SPF级动物房的独立通风换气(IVC)恒温恒压系统[实验动物使用许可证号SYXK(沪)2015-0015],环境温度20~26 ℃,湿度40%~70%,12 h/d明暗交替。在正式实验前,适应性饲养5 d。
1.3 PDX模型建立
在生物安全柜中,取新鲜的活检组织样品,置于冰上,加Hank's平衡盐溶液洗涤2次,剔除非肿瘤组织。将肿瘤组织切成1 cm×1 cm×1 cm大小,植入CB17-SCID小鼠的一侧背部近腋窝的皮下(记为P0代)。患者的胸腔积液采用微流控技术(ClearCell FX1系统,新加坡Clearbridge BioMedics公司)富集肿瘤细胞,每只小鼠接种约5×106细胞至小鼠背部皮下(记为P0代)。当P0代肿瘤生长至500~800 mm3时,取出肿瘤,采用上述活检样品的操作,进行小鼠体内传代(记为P1代),随后传代依次记为P2代、P3代……。传代期间对小鼠体质量以及肿瘤大小进行观察,并冻存肿瘤样品。
取PDX模型传代肿瘤组织经苏木精-伊红染色(hematoxylin and eosin staining,H-E staining,H-E染色)后行组织病理学观察,验证其与患者原始肿瘤组织病理形态的相似性。
1.4 肿瘤的PD-L1表达检测
通过免疫组织化学法(免疫组化)检测肺癌PDX模型传代肿瘤组织PD-L1的表达情况。收集P1~P2代PDX肿瘤组织检查样本,用10%甲醛溶液固定,经过包埋、切片、脱蜡、抗原修复、背景封闭、PD-L1染色[ (E1L3N)XP®兔抗人PD-L1单抗,美国CST]、显色等步骤进行PD-L1免疫组化染色。按照染色程度评分,评分标准如下:得分=染色密度评分(0~3分)×染色面积评分(0~3分)。若得分<1分,则样品PD-L1的表达为阴性(-);若得分≥1分,则样品PD-L1的表达为阳性。得分1~3分记为+,4~6分记为++,7~9分记为+++。
1.5 PDX模型人源化免疫重建
1.5.1 PDX肿瘤单细胞悬液的制备 将已建好的PDX模型传代肿瘤(P1~P2代)自小鼠体内取出,于生物安全柜中去除非肿瘤组织和坏死组织;将组织剪切成1~3 mm3,使用胶原酶于37 ℃消化肿瘤块1~2 h;200×g离心3 min,去除上清液,收集细胞悬液。
1.5.2 PBMC的分离与培养 取正常人外周血,用密度梯度离心法分离PBMC,用含10%胎牛血清的RPMI 1640培养液重悬,细胞密度调整至3×106/mL。将分离的PBMC加入经丝裂霉素C处理的1×106/mL肿瘤细胞中,共培养6 d,培养液为含10 ng/mL IL-2和10%胎牛血清的RPMI 1640培养液。
1.5.3 细胞接种 收集共培养6 d后致敏的PBMC,与新鲜消化后的PDX肿瘤细胞按1:10的比例混合,接种约5.5 ×106细胞至NCG小鼠背部皮下。
1.5.4 免疫荧光检测 待肿瘤组织长至100 mm3后取出,用4%多聚甲醛溶液固定、30%蔗糖溶液脱水、OCT包埋剂包埋后,进行冰冻切片,切片厚度为10 μm。用兔抗人CD45抗体(英国Abcam)作为一抗,Alexa Fluo 488标记的羊抗兔IgG(英国Abcam)进行二抗染色,DAPI进行核染色。
1.6 采用人源化免疫PDX模型评估PD-1抑制剂疗效
待人源化免疫重建PDX模型上肿瘤长至约100 mm3时,将不同临床样本建立的模型小鼠分别随机分成2组,即给药组和对照组,每组6只。给药组按20 mg/kg的剂量给予PD-1抑制剂信迪利单抗(sintilimab)注射液[信达生物制药(苏州)有限公司],给药频率为每2 d 1次,腹腔注射,至实验结束(至少21 d),给予CO2窒息处死。对照组给予PBS。每周测量小鼠体质量和肿瘤体积2次,肿瘤体积计算公式为V=0.5×ab2(a、b分别代表肿瘤的长径和短径);并计算肿瘤生长抑制率(TGI,tumor growth inhibition)(%)=[1- (给药组给药后的肿瘤体积-给药组首次给药时的肿瘤体积) / (对照组给药后的肿瘤体积-对照组首次给药时的肿瘤体积) ]×100%。
1.7 统计学分析
应用Graphpad 6.0统计软件进行作图及数据处理,定量资料用表示,采用t检验比较组间差异。P<0.05认为差异有统计学意义。
2 结果
2.1 PDX模型建立
共获得NSCLC患者44份活检组织样本和29份胸腔积液样本,每份样本接种1~2只小鼠。其中活检组织样本有15份建模成功,成功率为34.1%(15/44);胸腔积液样本有13份建模成功,成功率为44.8%(13/29);总建模成功率为38.4%(28/73)。对成功建立的PDX模型进行编号,其中来源于活检组织的以LUPF开头,来源于胸腔积液的以CTC开头。
通过H-E染色发现,PDX模型肿瘤与患者原始肿瘤的细胞病理形态相似(图1),表明PDX模型能够很好地保持临床肿瘤的细胞形态特征。
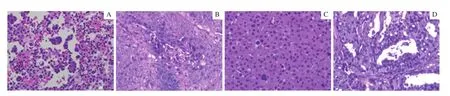
图1 患者临床样本与PDX模型肿瘤样本的病理学观察(H-E染色,×100)Fig 1 Pathological observation of clinical samples and PDX tumors (H-E staining, ×100)
2.2 免疫组化法检测PD-L1的表达
对成功建立的28个肺癌PDX模型中的16个PDX模型P1~P2代进行PD-L1表达检测,共发现6个PD-L1表达阳性的模型(表1,图2)。
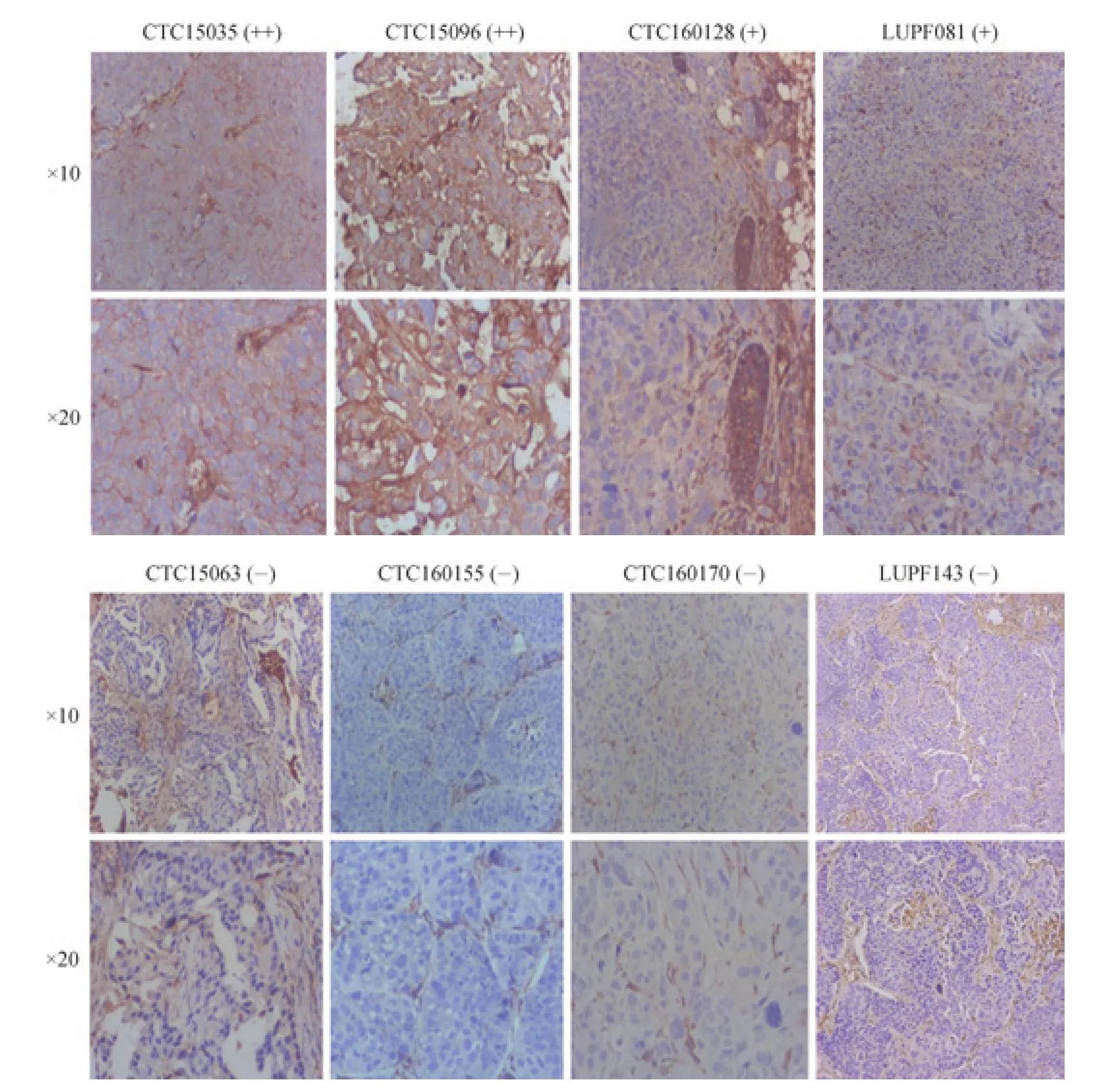
图2 免疫组化法检测PDX模型肿瘤的PD-L1表达Fig 2 PD-L1 expression in the tumors from PDX models by immunohistochemistry

表1 PDX模型肿瘤的PD-L1表达检测结果Tab 1 Results of PD-L1 expression in PDX models
2.3 PDX模型人源化免疫重建
将新鲜消化后的PDX肿瘤细胞重悬,与致敏的PBMC混合后,接种至NCG小鼠皮下。28 d后,取人源化免疫PDX模型中的肿瘤组织,行CD45免疫荧光染色,检测肿瘤组织中是否含有人源免疫细胞。结果发现CD45染色阳性的免疫细胞散在分布于肿瘤组织中,而未混合人PBMC的PDX模型中,未检测到免疫细胞(图3)。
本 研 究 分 别 选 择 了 CTC15035、CTC160049、LUPF143的PDX模型肿瘤细胞来构建人源化免疫PDX肿瘤模型,其中CTC15035和CTC160049为PD-L1不同阳性表达水平的PDX肿瘤模型,LUPF143为PD-L1表达阴性的PDX肿瘤模型。人源化免疫PDX肿瘤模型的编号与原PDX模型编号保持一致。

图3 人源化免疫PDX模型肿瘤组织的CD45免疫荧光染色(×200)Fig 3 CD45 immunof l uoresence staining in the tumor tissue of PDX model with humanized immunity (×200)
2.4 采用PBMC人源化免疫肺癌模型评估PD-1抑制剂的效果
CTC15035模型PD-L1表达呈强阳性(++),给予PD-1抑制剂后,肿瘤生长明显被抑制,初次给药后21 d PD-1抑制剂的TGI为82.6%;CTC160049模型PD-L1表达呈阳性(+),同样看到PD-1抑制剂对肿瘤有一定的抑制作用,初次给药后21 d PD-1抑制剂的TGI为11.9%;LUPF143模型PD-L1表达阴性(-),至初次给药后42 d仍未观察到PD-1抑制剂对肿瘤的抑制作用(图4)。
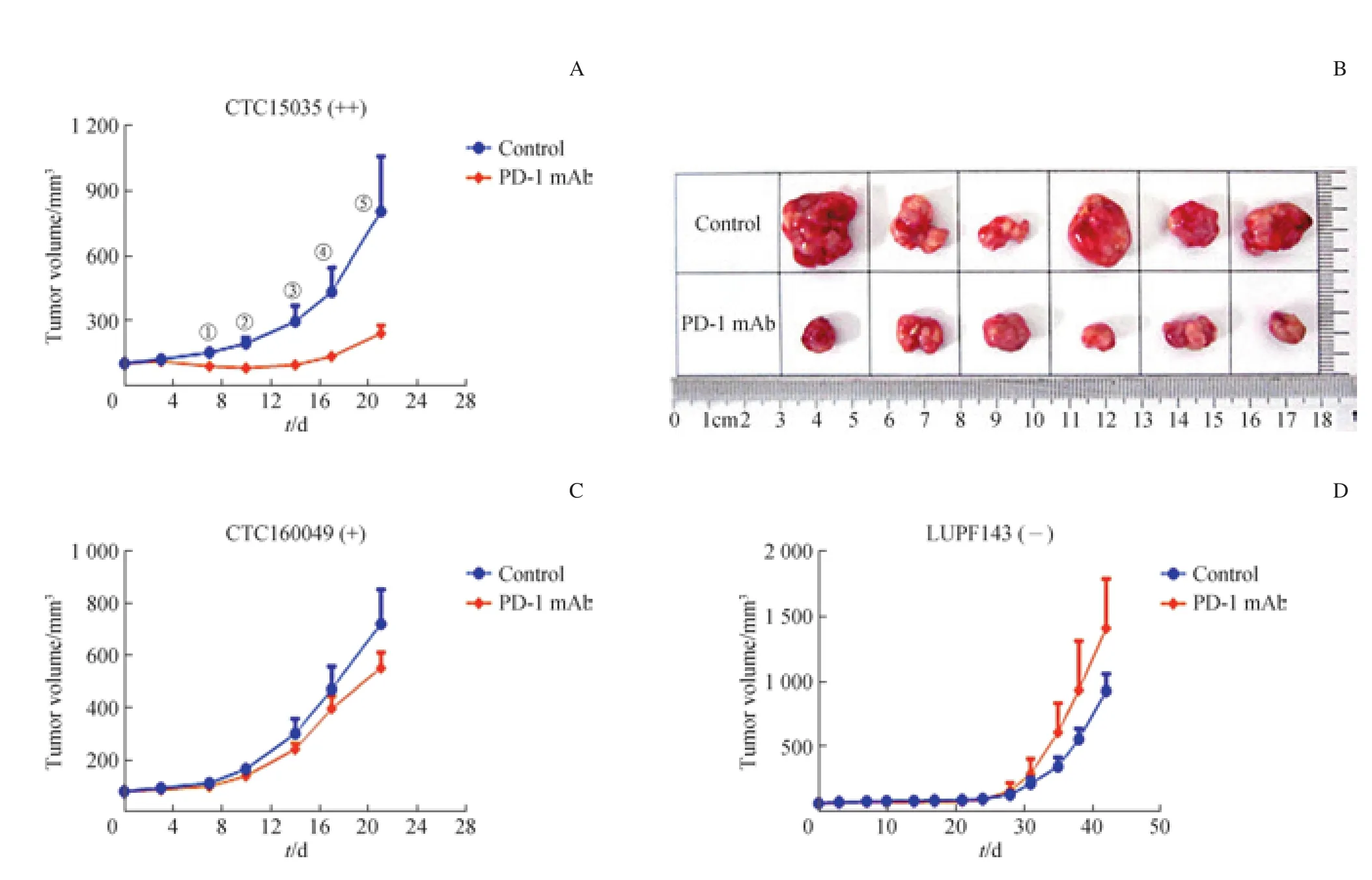
图4 PD-1抑制剂在人源化免疫肿瘤模型中的效果评价Fig 4 Evaluation of PD-1 inhibitors in PDX models with humanized immunity
3 讨论
近年来,肿瘤免疫治疗技术发展迅速,其中以PD-1/PD-L1为靶点的免疫检查点抑制剂已在肺癌临床治疗中取得了突破性的进展,PD-1抑制剂派姆单抗和纳武单抗已在中国获批用于转移性NSCLC的一线/二线治疗。但是,PD-1/PD-L1免疫检查点抑制剂的临床疗效有限。
本研究建立了能用于评估PD-1/PD-L1免疫检查点抑制剂疗效的人源化免疫肺癌PDX动物模型,对于肺癌的抗肿瘤免疫治疗的转化医学研究具有重要意义,为肿瘤免疫及其微环境的研究提供了一个动物模型的研究平台。
传统的PD-1/PD-L1免疫检查点抑制剂疗效临床前评价的指标体系是采用鼠源同系动物模型或人源肿瘤细胞系异种移植动物模型,但这些肿瘤模型存在着诸多缺陷。比如鼠源同系动物模型的免疫系统和人的免疫系统存在一定的差异,不能反映药物在人体里的免疫作用机制。人源肿瘤细胞系在长期体外培养条件下,表现出均一的组织学特征,其生物学特性和分子特征已经和原发肿瘤相差甚远。利用新鲜肿瘤标本,将肿瘤组织块异种移植至免疫缺陷小鼠皮下,建立PDX模型,最大限度地保留了肿瘤的原有特性,是目前肿瘤新药研究及转化医学研究最理想的动物模型[15,27]。许多实验研究[28-31]表明,PDX肿瘤组织经过连续传代,仍然保持与原始肿瘤相似的肿瘤特性,如肿瘤标志物、蛋白表达谱、基因组水平、药物敏感性等。免疫系统人源化小鼠就是指通过移植人的造血干细胞或免疫组织、细胞,在小鼠体内重建人类免疫系统。近年来人们建立了有效的免疫系统人源化小鼠模型,应用于人类免疫应答及相关疾病的研究。这种人源化小鼠模型还可应用于感染、肿瘤、移植等多个领域[12,32]。
本课题先在SCID小鼠上建立人肺癌PDX肿瘤动物模型,并将成熟的人PBMC与肿瘤细胞共培养,然后将共培养后的PBMC再与新鲜消化的肿瘤细胞混合直接注射于NCG小鼠皮下,使人的PBMC在小鼠肿瘤局部出现,成为肿瘤浸润的免疫细胞,同时创建了肿瘤免疫微环境,由此建立了人源化免疫的肺癌PDX模型。本方法克服了通过尾静脉注射PBMC[33-34]可能导致的宿主免疫排斥反应,同时保证了免疫治疗药物药效方面数据的准确性。
临床试验数据(KEYNOTE-042研究)[35]表明:PD-1抑制剂如帕博利珠单抗(pembrolizumab)治疗必须有伴随诊断,仅PD-L1表达≥1%的患者可以从治疗中获益,并且PD-L1表达水平越高,受益越多。我们选用PD-1抑制剂信迪利单抗对不同PD-L1表达水平的人源化免疫肺癌PDX模型进行肿瘤干预,观察药物疗效,以此验证我们建立的该模型能在动物体内评估PD-1/PD-L1免疫检查点抑制剂的疗效。实验数据显示:PD-L1表达阳性的人源化免疫肺癌PDX模型的肿瘤生长能被PD-1抑制剂抑制,并且PD-L1表达水平越高,TGI越大;但是,本实验挑选的模型数量较少,证据尚不充分,有待在更多的不同PD-L1表达水平的模型加以验证。
本研究的PBMC人源化免疫肺癌PDX动物模型可能可以帮助指导临床用药,比如预测NSCLC患者能否从PD-L1/PD-1免疫治疗中获益,以及研究是否有预测PD-1/PD-L1抑制剂临床疗效的其他生物学标志物;同时,该模型可以作为预测其他免疫治疗方法临床疗效的新平台。

