IL-7及IL-15在肿瘤免疫疗法中的应用
聂文冰,尹鸿萍
(中国药科大学,江苏 南京 211198)
嵌合抗原受体T细胞(chimeric antigen receptor T,CAR-T)疗法是一种在体外分离患者T细胞后,利用慢病毒转导或转座子技术等对T细胞进行修饰,使其携带CAR基因,在回输入患者体内后对肿瘤细胞进行识别并杀伤的技术。其发挥作用的关键在于CAR的设计。CAR主要包含3个部分:胞外抗原识别区ScFv,跨膜区以及胞内信号区。根据胞内信号结构域的不同,其又可分为4代[1-2],一代CAR胞内部分只含有CD3-zeta结构域,修饰后T细胞扩增困难,体内实验显示其在小鼠体内的持久性较弱,因而疗效不佳[3];二代CAR中除了CD3-zeta结构域,额外含有一个共刺激结构域如CD28、4-1BB等,可显著促进T细胞扩增;三代CAR中包含两个共刺激结构域,CD28、4-1BB、OX40等;四代CAR将额外的分子原件如自杀基因,白介素基因等插入到CAR中一方面提高CAR的安全性,另一方面表达功能蛋白,使其更好地发挥作用[4]。目前CAR-T疗法在血液瘤中包括急性B淋巴细胞白血病、非霍奇金氏淋巴瘤以及多发性骨髓瘤等的治疗方面取得了显著成效。然而其针对实体瘤的治疗仍有待解决,主要是实体瘤中合适的靶点寻找受限、T细胞难以浸润肿瘤部位以及肿瘤微环境的免疫抑制等原因引起[5]。
为了确保CAR-T的疗效需要T细胞在体外能够快速增殖。目前IL-2已经是公认的可促进T细胞增殖的细胞因子。在naive T细胞被激活后,效应T细胞可分泌IL-2并且增加IL-2受体的表达,从而促进T细胞的增殖。但是其本身对体内存在的naive T细胞以及memory T细胞的促增殖作用有限。在研究中,实验者常常额外加入IL-7/IL-15来确保T细胞的增殖能力,本文主要就IL-7、IL-15促增殖作用的机制以及其在CAR-T免疫疗法中的临床应用进行综述。
1 IL-7及IL-15的作用原理
1.1 IL-7的作用原理 人IL-7是一种由骨髓基质细胞分泌的,分子量为25 kDa左右的糖蛋白[6]。其基因长度为72 kb,位于染色体8q12~13上,由177个氨基酸构成。分子上含有3个糖基化位点,根据糖基化程度的不同,体外蛋白水平检测时可于20、25、28 kDa左右出现3条蛋白条带。IL-7的受体由高亲和力受体α链(CD127)以及γc链(CD132)组成异二聚体[7-8]。
如图1所示,当IL-7与其受体结合后,主要依赖两条信号通路发挥作用:JAK-STAT通路以及pI3K-AKt通路[9-10]。经pI3K-AKt通路,IL-7一方面下调细胞周期相关抑制蛋白p27kipl的表达,另一方面促进周期蛋白cyclinD1的表达,从而促进细胞周期进展,诱导细胞增殖。另一方面,当IL-7与其受体结合后会导致胞质内JAK1及JAK3的激活,磷酸化STAT蛋白。磷酸化的STAT蛋白会形成异二聚体然后进入细胞核激活抗凋亡基因如Bcl-2和Mcl-1表达,抑制促凋亡蛋白如Bax和Bak等的表达,从而促进细胞存活。通过上述信号转导,IL-7可促进自身Naive T细胞以及记忆T细胞的增殖,对CAR-T疗法具有重要意义。
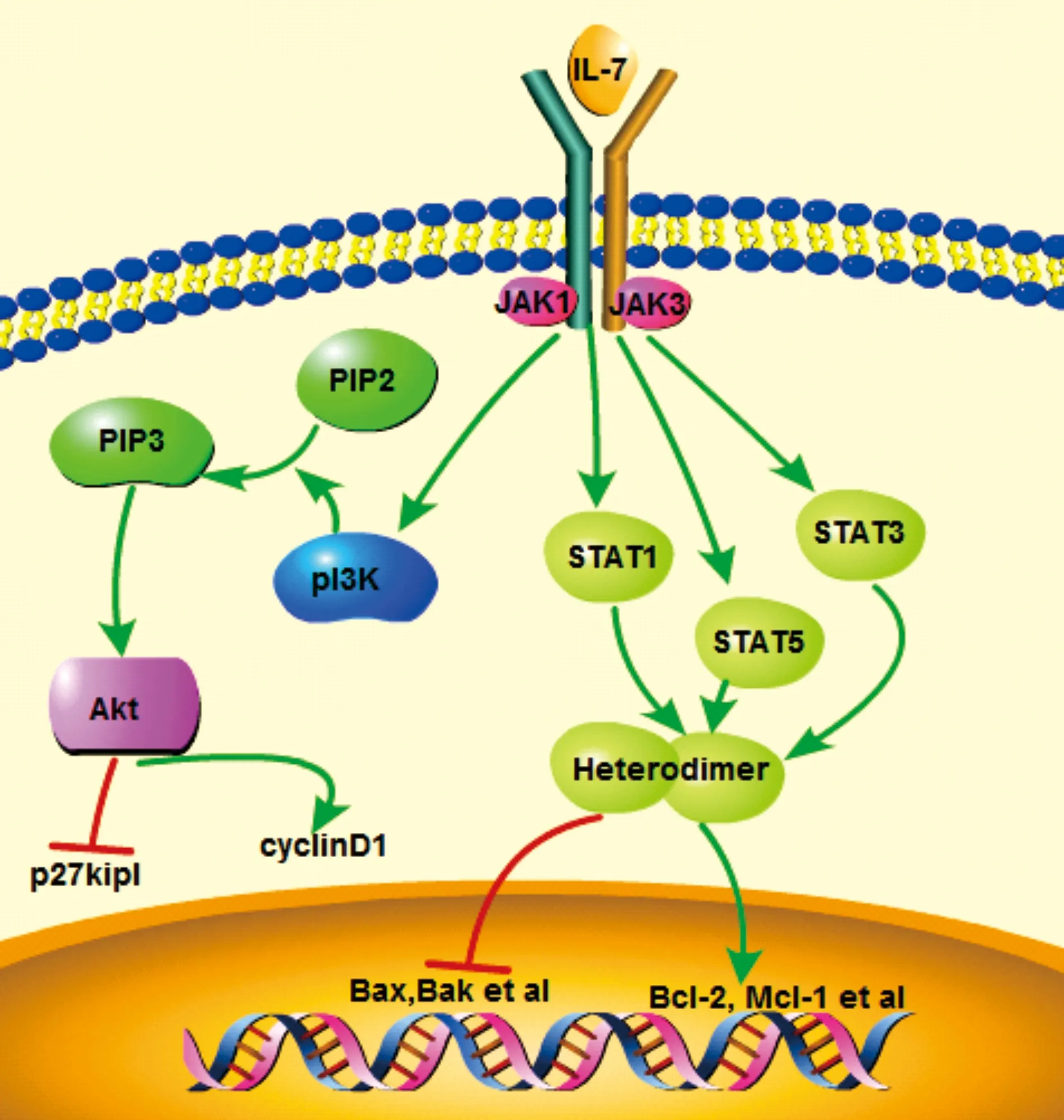
图1 IL-7的信号通路图
1.2 IL-15的作用原理 IL-15因子于1994年被Giri等[11]发现并命名,其编码基因位于染色体4q31上,由162个氨基酸构成分子量为14~15 kDa的糖蛋白。其中48个氨基酸构成前导序列,114个氨基酸形成成熟的IL-15亚基。IL-15分子中含有2个二硫键以及2个糖基化位点使其构成4个α-螺旋束结构。IL-15的受体同IL-2一样为异源三聚体,由IL-15Rα、IL-2/15Rβ及γc链组成。其是除IL-2外,唯一与IL-2共享受体β链的因子[12]。
如图2所示,多数情况下IL-15与高亲和力配体IL-15Rα结合形成复合物表达于多种细胞表面。当细胞被激活后,信号经IL-15/IL-15Rα反式递呈到表达β/γc受体的效应细胞中,主要经JAK/STAT、pI3K-AKt以及MAPK 3条信号通路调节下游效应分子如Bcl-2、Bim、NF-κB、IFN-γ等发挥作用[13-15]。当JAKs被激活后,一方面促使STAT磷酸化入核,调节相关基因的转录与表达;另一方面,通过接头蛋白Shc激活Grb2,Grb2既可作用于GAB2蛋白经pI3K-AKt通路促进细胞增殖及存活,又可与鸟嘌呤核苷酸交换因子SOS结合形成Grb2-SOS复合物经Ras-Raf途径进一步激活MAPK来促进细胞增殖。与IL-7作用区别在于其主要经反式信号传递来发挥作用,从而促进记忆T细胞,特别是CD8+记忆T细胞的增殖。
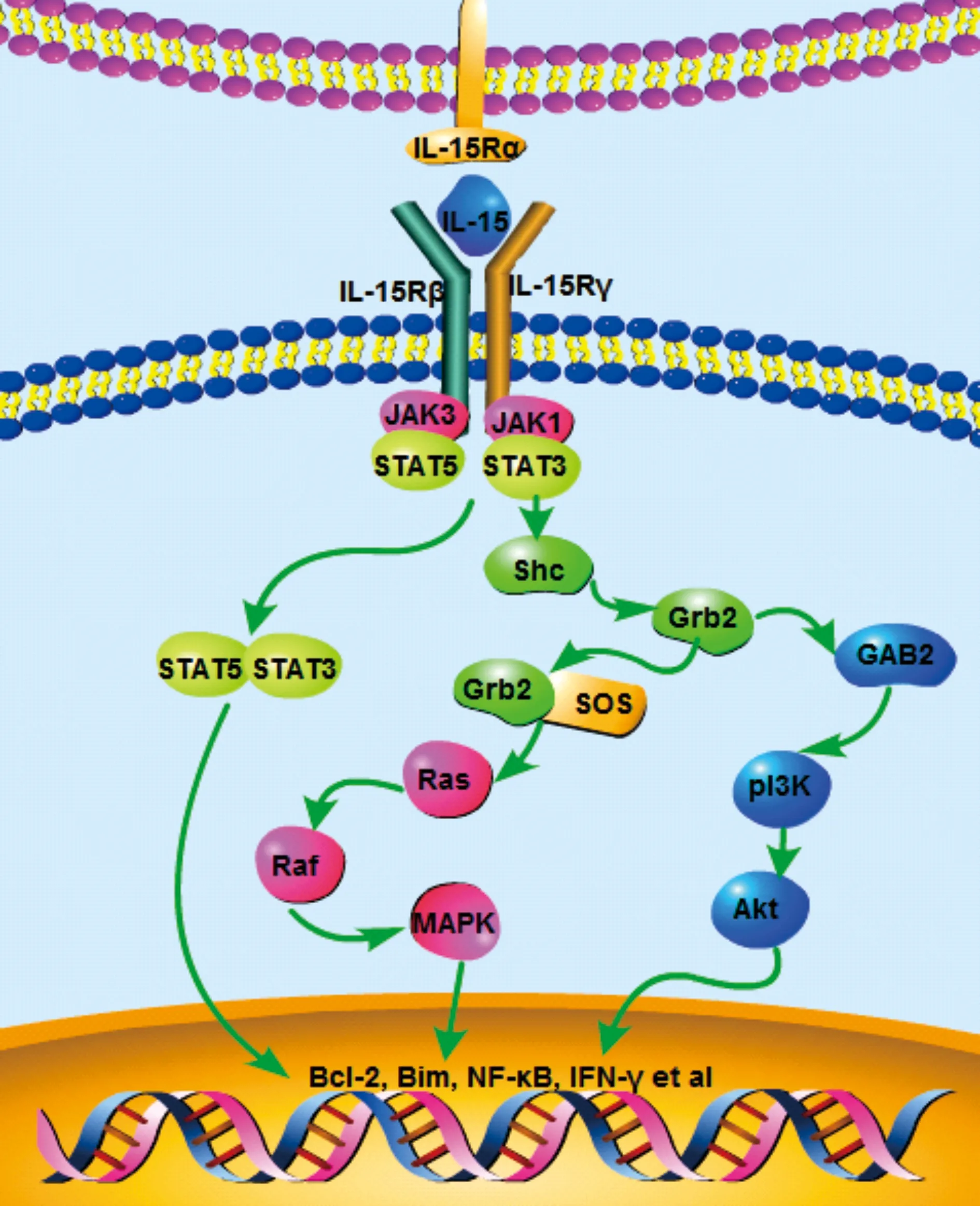
图2 IL-15的信号通路图
2 IL-7及IL-15的体内外作用
2.1 促进CAR-T细胞的体内外增殖 Zhou等[16]利用一个携带eGFP标签的anti-CD19 (4-1BB) CAR,转导入T细胞后,比较其在不同因子IL-2或IL-7/IL-15共刺激条件下,细胞的增殖、凋亡以及抗肿瘤作用的差异。尽管IL-2组细胞在2周内可扩增100倍左右,但是经IL-7/IL-15共培养,细胞的扩增倍数约为IL-2组的2倍多。并且抗凋亡蛋白Bcl-2表达增加,细胞具有低凋亡率。此外有研究显示在IL-2 (50 U·mL-1)中培养的T细胞从第20天开始细胞即有数量减少的趋势,而在IL-7 (10 ng·mL-1)和IL-15 (10 ng·mL-1)中培养的T细胞在培养至35 d时仍有较好的扩增趋势[17]。Hoyos等[18]将CAR-19+与自杀基因iC9、细胞因子IL-15共表达,构成一个新型的CAR载体,将其与常规的CAR19+相比较,每周以效靶比1∶2的比例用B细胞慢性淋巴性白血病CD19+刺激,共培养5周,作者发现构建的新型CAR体外扩增相较于CAR-19+增加10倍。此外,将CAR-T细胞经eGFP-FFLuc基因编辑后,经小鼠体内研究显示携带IL-15的新型CAR-19+的扩增速度要优于CAR-19+3~15倍。
尽管在CAR-T研究中IL-2已有显著的促增殖作用,但是其本身对部分T细胞的促增殖作用有限,通过与IL-7、IL-15联合作用,可显著提高整体CAR-T细胞的扩增速率,从而在确保回输剂量的条件下可缩短培养时间,一方面减少操作时间,更易确保产品的质量;另一方面保持CAR-T细胞的活性以达到最佳疗效。
2.2 调节细胞表型,减弱细胞分化,促进存活 Xu等[19]比较了100 U·mL-1的IL-2与10 ng·mL-1的IL-7及5 ng·mL-1的IL-15培养条件下,CAR-T扩增后表型变化以及体内外抗B细胞恶性肿瘤的差异。研究者发现经IL-7/IL-15培养后,CAR-T终产品中CD8+CD45RA+CCR7+占比要明显优于IL-2培养组(31%±4% vs 14%±5%)。Chen等[20]研究发现携带IL-15的GD2.CAR-T细胞与神经母细胞瘤CHLA255共孵育后与单纯的GD2.CAR相比,可明显增加IL-15的表达,并降低细胞分化水平,使TSCM/TCM细胞亚群占比较高(25%±11% vs 6%±2%,P<0.001)。并从转录水平上降低耗竭标记PD-1以及LAG-3的表达。因此可从体内外在无外源因子以及抗原刺激的条件下促进CAR-T增殖并延长其存活。Alizadeh的研究显示,IL-15可通过降低mTORC1的活性使T细胞维持TSCM表型,促进细胞存活[21]。
在T细胞亚群中,尽管效应T细胞具有较强的细胞毒作用,而低分化的TN、TSCM、TCM细胞亚群在体内的存活时间更长,具有更佳的增殖潜力,对于CAR-T疗效的持久性具有重要作用。在IL-2培养的条件下,T细胞的分化程度较高,尽管短时对肿瘤细胞的细胞毒作用优于IL-7/IL-15共培养组,但是其作用持久性较弱。IL-7、IL-15共培养条件下,可减弱细胞分化,增加TSCM以及TCM细胞的比例,从而延长CAR-T在体内生存期,对增加体内外抗肿瘤疗效具有重要意义。
2.3 提高细胞毒作用 除了促进细胞增殖及存活外,IL-15还可通过增加穿孔素及颗粒酶的产生、促进产生IFN-γ及TNF-α等因子来增加淋巴细胞的细胞毒作用。Yao等[22]从健康招募者外周血内获得双阴性T细胞(DNTs)后在体外经5 μg·mL-1anti-CD3抗体激活后培养15~20 d。作者发现当DNTs额外用IL-15培养后,其可增加DNTs表面NKG2D、DNAM-1、NKp30、NKp44、颗粒酶B、穿孔素等表达,并促进IFN-γ及sTRAIL的分泌,从而增加体内外DNTs对肿瘤细胞的杀伤作用。此外,有研究显示尽管IL-7/IL-15培养的CAR-T细胞与淋巴瘤细胞共孵育后对体外因子释放以及细胞毒作用与IL-2组无显著差异,但是小鼠模型显示,输注IL-7/IL-15 CAR-T细胞的小鼠抗肿瘤作用更强,并且小鼠的存活期更久[16]。因此相较于IL-2组,联合IL-7、IL-15共培养的CAR-T细胞作用效果更佳。
3 IL-7及IL-15的临床应用
关于IL-7/IL-15的临床应用主要涉及两个方面,一方面是在体外培养CAR-T的过程中外加IL-7及IL-15来考察CAR-T的疗效;另一方面即在CAR设计过程中,直接将IL-7或IL-15与CAR的基因连接,形成一个嵌合抗原受体后来评估其疗效。在重庆新桥医院开展的一项临床试验通过IL-7/IL-15体外培养来替换原来的IL-2培养,旨在判断输注淋巴瘤患者后,IL-7/IL-15培养的抗CD19 CAR-T细胞是否能在体内持续更长的时间,以及CAR-T细胞的持久性是否可以提高抗淋巴瘤的疗效。钱文斌等通过2A肽段将IL-7以及趋化因子CCL19与CD19.CAR构建成新的嵌合抗原受体,用于治疗B细胞淋巴瘤。同样的,在温州医科大学第六附属医院开展的一项临床实验也利用四代CAR (含IL-7/CCL19/IL-21)用于治疗Nectin-4/FAP高表达的实体瘤。一项关于 iC9.GD2.CAR.IL-15 T细胞治疗复发/难治性神经母细胞瘤的Ⅰ期临床试验也正在北卡莱茵伯格综合癌症中心展开。
通过表1所示这些临床试验,根据患者输注后的应答情况可以直观的考察IL-7/IL-15与CAR-T联用后,CAR-T免疫疗法的疗效是否得到显著提升,从而更好地为患者带来福音。
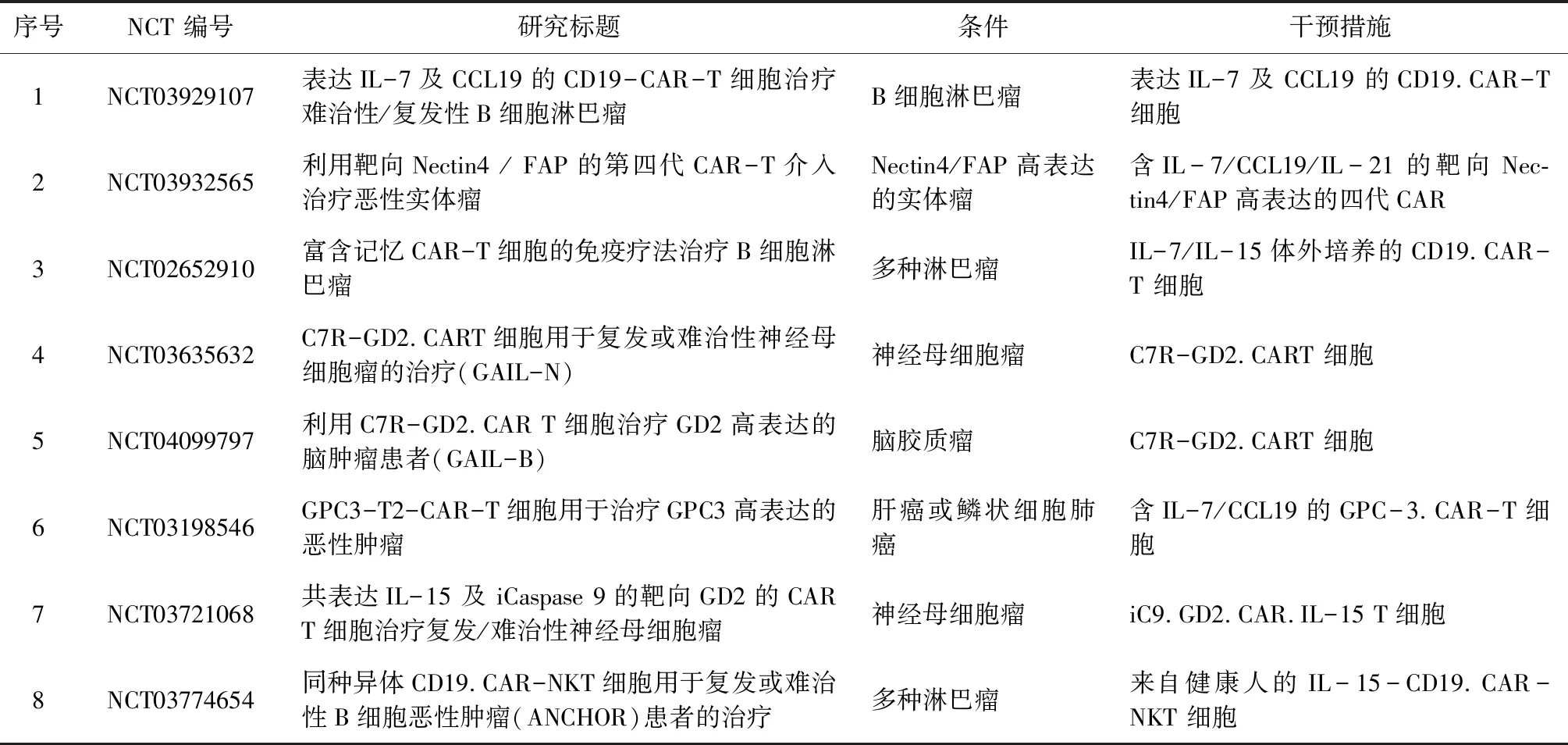
表1 IL-7/IL-15在CAR-T免疫疗法中的临床应用
4 结语
迄今为止,CAR-T疗法在肿瘤治疗领域方兴未艾,截至目前共有429项涉及不同种类肿瘤、不同靶点的CAR-T临床项目在全球展开,我国多家医疗企业、机构也在开展多项针对不同肿瘤的CAR-T临床试验,而IL-7及IL-15因子已显示出对CAR-T优异的促增殖作用,可使CAR-T减弱分化表型,延长体内存活,增加其疗效。在体外培养过程中将IL-7/IL-15替代IL-2;或与IL-2连用;或者在CAR的设计过程中加入IL-7/IL-15基因均有利于CAR-T疗效。然而IL-7及IL-15因子对CAR-T疗法的疗效针对患者而言具体有多大的提升作用还需要临床试验数据来进一步支撑。

